3.2.3: Electronegatividad y efectos de tamaño atómico
- Page ID
- 81289
Introducción
Vimos en secciones anteriores cómo pares solitarios de electrones y enlaces múltiples distorsionan los ángulos de enlace entre átomos no centrales (ligandos) alrededor de un átomo central. Esta sección describe cómo la electronegatividad y el tamaño del ligando también influyen en los ángulos de enlace y la geometría molecular. La electronegatividad generalmente se correlaciona con el tamaño atómico que desciende por cualquier grupo de la tabla periódica. Hay algunos casos en los que los ángulos de enlace pueden ser predichos por estas correlaciones. Sin embargo, el tamaño y la electronegatividad también pueden funcionar como factores competidores en la determinación de los ángulos de unión.
Definiciones de Electronegatividad
Linus Pauling introdujo la primera escala de electronegatividad en 1932 para explicar la estabilidad extra de moléculas con enlaces polares. [1] La electronegatividad de un átomo, representada por la letra griega\(χ\) (chi), puede definirse como la tendencia de un átomo a atraer electrones hacia sí mismo en un enlace químico. En la escala Pauling, la diferencia de electronegatividad entre dos átomos A y B se definió en términos de las energías de disociación E d de los enlaces A-A, B-B y A-B:
\[\chi_{A} - \chi_{B} = \sqrt{E_{d}(AB) - [E_{d}(AA) + E_{d}(BB)]/2} \nonumber \]
donde las energías se expresan en electrón-voltios. La escala de electronegatividad de Pauling va desde Flúor (más electronegativo = 4.0) hasta Francium (menos electronegativo = 0.7). [2,3] La polaridad de los bonos y la asignación de cargos formales se predice por diferencias de electronegatividad.
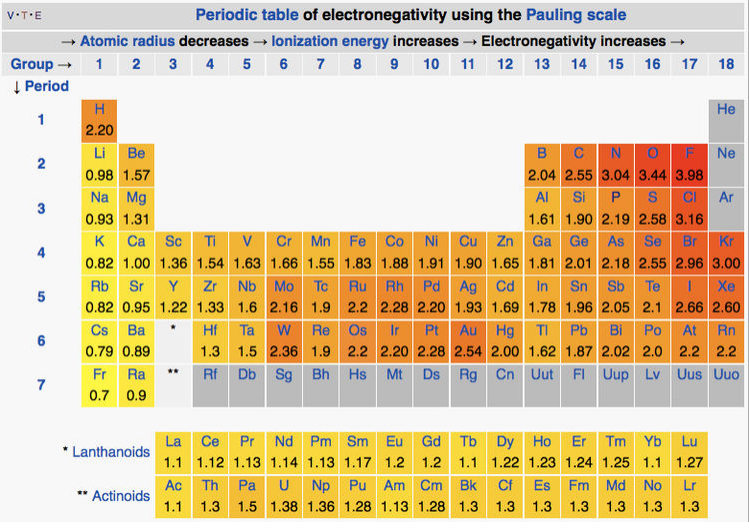
Si bien es directamente relevante para la fuerza de los enlaces químicos, la definición Pauling de electronegatividad tiene una limitación significativa: calcular cada valor requiere datos de varios compuestos en los que están unidos átomos específicos. Esto significa que la escala no se puede aplicar con éxito a todas las situaciones. Para superar esta limitación, se desarrollaron escalas alternativas de electronegatividad basadas en diferentes mediciones o cálculos termoquímicos. Estas otras escalas se enumeran en la siguiente tabla. Descripciones más completas de cómo se calculan los valores en cada escala se describen en la página de Electronegatividad de Wikipedia (clic) y una historia concisa de las escalas de electronegatividad se resume en la ref 4.
| Desarrollador de básculas | Año descrito por primera vez | Características |
|---|---|---|
| Linus Pauling [1] | 1932 | Basado en energías de enlace |
| Robert S. Mulliken [5,6] | 1934 | Basado en las propiedades electrónicas de valencia de los átomos (afinidad electrónica y energía de ionización) |
| Louis Allred y Eugene G. Rochow [7] | 1958 | Basado en la fuerza electrostática (carga nuclear efectiva) |
| Robert T. Sanderson [8] | 1983 | Basado en la densidad de electrones atómicos |
| Ralph G. Pearson [9] | 1985 | Relacionada con la teoría basada en ácido duro-blando |
| Leland C. Allen, Joseph Mann, Terry L. Manso [10,11,12] | 1989, 2000 |
Energías de ionización promedio de electrones de concha de valencia, energías de configuración (CE)\[\mathrm{CE}=\frac{n \varepsilon_{s}+m \varepsilon_{p}}{n+m} \nonumber \]\(n = \text{number of s electrons}\) |
La principal ventaja de esta escala desarrollada por Mann, Meek y Allen [12] es que se basa en la energía de configuración (CE), las energías de ionización promedio de los electrones de valencia en átomos libres en estado fundamental. Una escala basada en energías de ionización se puede calcular más directamente para cualquier elemento. Sin embargo, una crítica de todas las escalas de electronegatividad, incluida esta, es que todas se basan en suposiciones que fracasan en algunos casos.
Existe una relación entre la electronegatividad y el tamaño atómico porque ambos están relacionados con la energía de ionización. Al igual que la energía de ionización, existe una tendencia general a través de la tabla periódica tanto para la electronegatividad como para el tamaño atómico; en general, los átomos más pequeños hacia la parte superior derecha de la tabla periódica tienen mayores valores de electronegatividad y menor tamaño atómico. A continuación veremos que tanto la electronegatividad como el tamaño atómico influyen en los ángulos de enlace y la geometría molecular absoluta alrededor de un átomo central. En algunos casos, el tamaño y los efectos de electronegatividad están alineados; en algunos casos estos efectos compiten.
Electronegatividad y Tamaño Influencia Ángulos de Enlace
Comencemos por examinar los ángulos de enlace de varias moléculas piramidales trigonales. Las moléculas mostradas en la Figura tienen\(\PageIndex{2}\) cada una tres “grupos colgantes” idénticos en el átomo central (Figura\(\PageIndex{2}\)). Los átomos colgantes o grupos colgantes son los átomos, o grupos de átomos, que están unidos directamente al átomo central. Las moléculas aquí mostradas están dispuestas de acuerdo con el tamaño de los átomos central y colgante. Los átomos centrales aumentan de tamaño bajando esta cifra, y los átomos colgantes aumentan de tamaño atravesando de izquierda a derecha. Los ángulos de unión y las longitudes de unión están etiquetados en cada caso.
¿Qué tendencias puedes identificar?
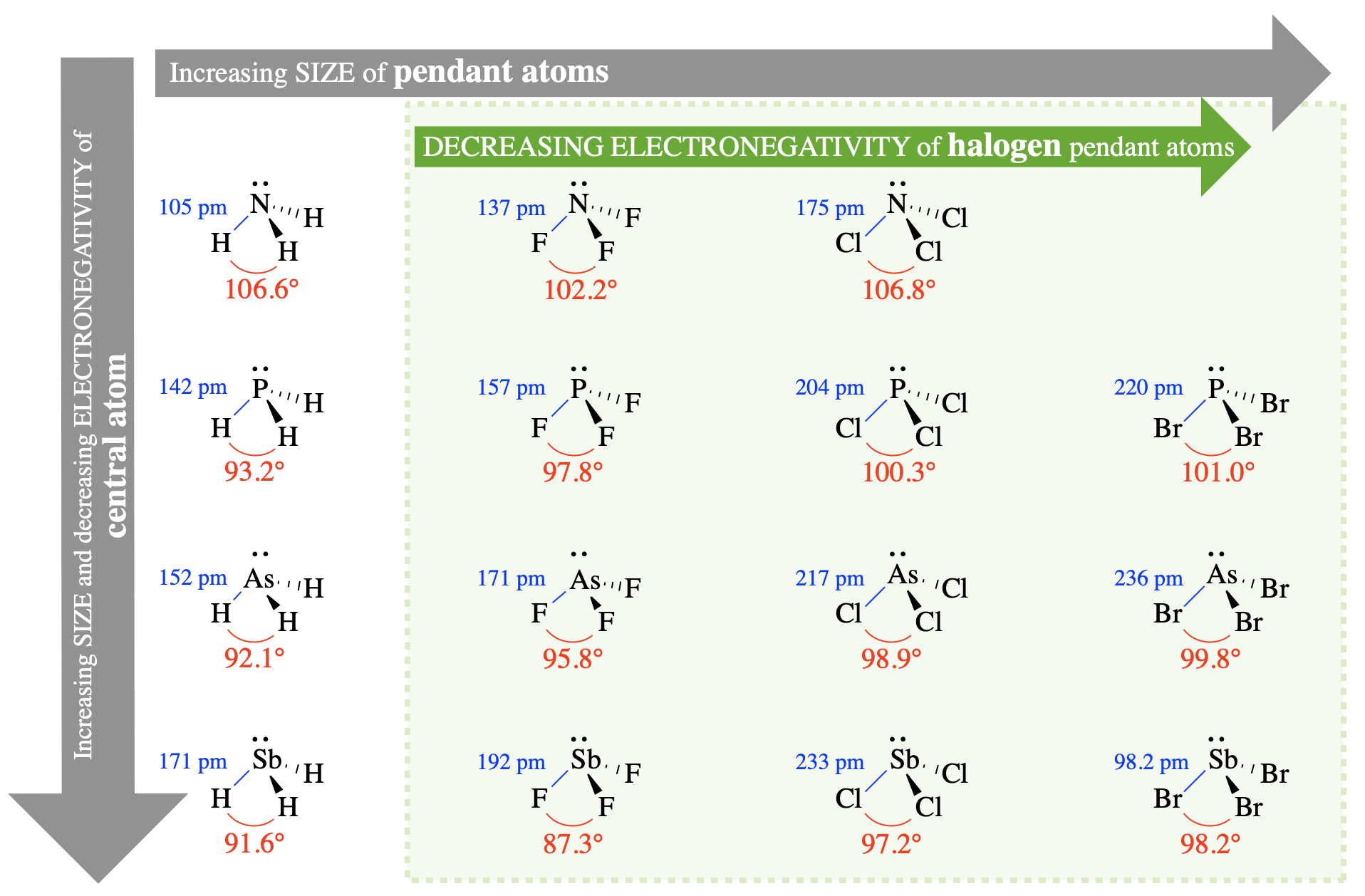
Tendencias en Tamaño
Primero, examinemos cómo el tamaño de los grupos central y colgante podría influir en el ángulo de unión. En la teoría de VSEPR, el tamaño de los átomos (o grupos de átomos) afectará los ángulos de enlace debido a cambios en las interacciones estéricas entre grupos colgantes.
Tamaño del átomo central
Examinar la relación entre el tamaño del átomo central y los ángulos de enlace en la Figura\(\PageIndex{2}\) (bajar cualquier columna de la figura). Por ejemplo, compare NH 3, PH 3, aSH 3 y SBh 3, con ángulos de unión 106.6°, 93.2°, 92.1° y 91.6°, respectivamente. En esta serie, el tamaño del átomo central aumenta de N a Sb mientras que el tamaño del átomo colgante (hidrógeno) permanece constante. A medida que aumenta el tamaño del átomo central, los ángulos de enlace disminuyen; así, observamos una relación negativa entre el tamaño del átomo central y el ángulo de enlace en estas moléculas. Esta relación se explica por los esterinos. A medida que el átomo central aumenta de tamaño, las longitudes de los enlaces también aumentan y los átomos colgantes están más alejados entre sí en el espacio. En la teoría de VSEPR, esto reducirá las interacciones estéricas entre los grupos colgantes. Dado que el par solitario en estas moléculas es más repulsivo que los grupos unidos, la disminución en las interacciones estéricas entre los grupos unidos resulta en una disminución en los ángulos de enlace.
Tamaño de los átomos colgantes (o grupos)
Examine las relaciones entre el tamaño de los átomos colgantes de halógeno y el ángulo de enlace en la Figura\(\PageIndex{2}\) (vaya a través de cualquier fila dentro de la región sombreada). Por ejemplo, compare PF 3, PCl 3 y PBr 3, con ángulos de unión 97.8°, 100.3° y 101.0°, respectivamente. En esta serie, el tamaño del átomo colgante aumenta de F a Br mientras que el átomo central permanece constante (fósforo). A medida que aumenta el tamaño de los átomos colgantes, el ángulo de enlace aumenta; así, observamos una relación directa entre el tamaño del grupo colgante y el ángulo de enlace en estas moléculas. Nuevamente, podemos explicar esto usando esterics. A medida que aumenta el tamaño de los átomos colgantes, los esterinos entre los grupos colgantes aumentarán (a pesar de pequeños cambios en la longitud del enlace). El aumento de las interacciones estéricas entre los grupos colgantes preferirá ángulos de unión más grandes entre los grupos.
Esta tendencia falla, sin embargo, si consideramos a las moléculas con hidrógeno como los átomos colgantes. Observe, por ejemplo, que H es el átomo colgante más pequeño. Si consideramos la tendencia descrita anteriormente, debemos asumir que XH 3 (donde X es un átomo variable) tendría el ángulo de enlace más pequeño en las series de XH 3, XF 3, XCl 3 y XBr 3. Sin embargo este no es el caso de NH 3, NF 3 y NCl 3, con ángulos de unión 106.6°, 102.2° y 106.8°, respectivamente. Para explicar la variación en estos ángulos de unión, debemos considerar la electronegatividad.
Tendencias en Electronegatividad
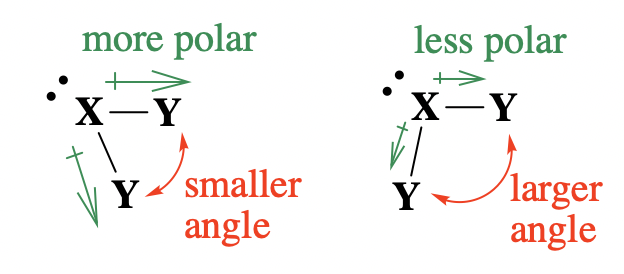
Ahora examinemos cómo la electronegatividad influye en los ángulos de enlace alrededor de un átomo central. En la teoría de VSEPR, la electronegatividad de átomos/grupos afectará los ángulos de enlace debido a cambios en la distribución de pares de electrones alrededor del átomo central (y por lo tanto cambios en la severidad de la repulsión de pares de electrones). Esto realmente se reduce a la polaridad de enlace causada por la diferencia en la electronegatividad entre el átomo central y los grupos colgantes (polaridad de enlace en el contexto de la teoría del enlace de valencia). En un enlace polar, el átomo más electronegativo arrastrará la densidad de electrones hacia sí mismo. Cuando un átomo colgante es más electronegativo, tirará del par de electrones unido hacia sí mismo y lejos del átomo central; esto reducirá la repulsión del par de electrones entre pares de electrones unidos en el átomo central. Una disminución en la repulsión de pares de electrones en el átomo central debería disminuir los ángulos de enlace entre los grupos (Figura\(\PageIndex{3}\)).
La electronegatividad es una explicación alternativa a las tendencias que ya examinamos anteriormente en la Figura\(\PageIndex{2}\). Por ejemplo, cuando comparamos los átomos colgantes de halógeno (región sombreada en la Figura\(\PageIndex{2}\)), la electronegatividad de los grupos colgantes disminuye, la polaridad de enlace de los enlaces disminuye y los ángulos de enlace aumentan yendo de izquierda a derecha y de F a Br. A medida que más densidad de electrones permanece en el átomo central, la repulsión de electrones entre los pares unidos aumenta y los ángulos de enlace aumentan.
El argumento de la electronegatividad también se puede utilizar para explicar el hecho de que NH 3 (106.6°) tiene un ángulo de enlace mayor que NF 3 (102.2°). Este caso particular ilustra cómo la electronegatividad y el tamaño pueden ser factores competidores. Si bien las diferencias de electronegatividad parecen dominar en el caso de NH 3 (106.6°) en comparación con NF 3 (102.2°), las diferencias de tamaño aún dominan en los casos de otros ejemplos de XH 3 y XF 3 en la Figura\(\PageIndex{2}\)).
Predecir la geometría y aproximar los ángulos de unión. Luego ponga las moléculas en cada serie en orden de menor a mayor ángulo de unión. Defiende tu respuesta.
- El ángulo de unión X-S-X en OSF 2, OSCl 2, OSBr 2
- H 2 O, H 2 S, H 2 Se, H 2 Te
- H 2 O, DE 2, OCl 2
- Respuesta (a)
-
Geometría y ángulos de enlace predichos: Se trata de moléculas con número estérico 4. Se pueden escribir como dos estructuras de resonancia diferentes, y el híbrido de resonancia tendría carácter de doble enlace entre S y O.
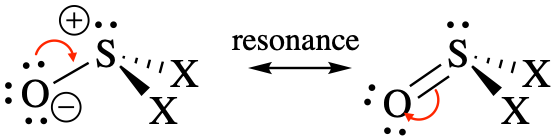
Se esperaría una geometría piramidal trigonal con todos los ángulos de unión <109.5° porque el par solitario es más repulsivo que los enlaces. Debido a que el doble enlace es más repulsivo que los enlaces simples, también debemos esperar que los ángulos de enlace O-S-X sean mayores que los ángulos de enlace X-S-X.
Tendencia: Se trata de una serie de moléculas que varía en la identidad de los átomos colgantes; la variación se encuentra dentro de los halógenos. El tamaño de los halógenos aumenta y la electronegatividad disminuye en el orden F, Cl, Br. Tanto el tamaño como la electronegatividad nos llevarían a concluir que los ángulos de enlace X-S-X aumentarían en el orden OSF 2 < OscL 2 < OsBr 2
Explicación: (1) El aumento de la electonegatividad del átomo colgante (F > Cl > Br) aumenta la polaridad del enlace y reduce la densidad electrónica del par unido en el átomo central. Esto reduce las repulsiones e-e de pares de electrones unidos adyacentes en S, permitiendo que los halógenos se acerquen más. Los átomos colgantes más electronegativos pueden tener ángulos de enlace más pequeños. (2) Aumentar el tamaño de los átomos colgantes (F < Cl < Br) aumenta las repulsiones estéricas y aumenta el ángulo de enlace. Ambas explicaciones conducen a la misma tendencia predicha.
Los ángulos de enlace X-S-X medidos reales son OSF 2 (92.3°)/OscL 2 (96.2°)/OsBr 2 (98.2°). La tendencia en estos ángulos de enlace es consistente con la predicción.
- Respuesta (b)
-
Geometría y ángulos de enlace predichos: Se trata de moléculas con número estérico 4, geometría molecular doblada, con ángulos de enlace predichos <109.5° porque los dos pares solitarios son cada uno más repulsivos que los enlaces. Hay dos pares solitarios y dos enlaces simples a H alrededor de cada átomo central.
Tendencia: Se trata de una serie de moléculas que varían en la identidad del átomo central. El átomo central aumenta en el orden O < S < Se < Te, donde Te es el elemento más grande y O es el más pequeño. Argumentos basados en el tamaño nos llevarían a predecir que los grupos colgantes de H 2 Te estarían menos abarrotados estéricamente y así tendrían un ángulo de unión menor que los grupos colgantes de H 2 O. La electronegatividad disminuye en el orden O > S > Se > Te, donde O es el elemento más electronegativo y Te es el de menos. Así, esperamos que los electro pares de unión estén más cerca del átomo central en O de lo que estarían en Te; deberíamos esperar que H 2 Te tenga las menores repulsiones de pares de electrones y, por lo tanto, el ángulo de enlace más pequeño en esta serie, mientras que H 2 O tendría las repulsiones de pares de electrones más fuertes y ángulos de unión más grandes.
Ambos argumentos llevan a la misma conclusión, que el orden de aumento del ángulo de unión es H 2 Te < H 2 Se < H 2 S < H 2 O.
Los ángulos de unión medidos reales son H 2 Te (90.2°)/H 2 Se (90.6°)/H 2 S (92.1°)/H 2 O (104.5). La tendencia en estos ángulos de enlace es consistente con la predicción.
- Respuesta (c)
-
Geometría y ángulos de enlace predichos: Se trata de moléculas con número estérico 4, geometría molecular doblada, con ángulos de enlace predichos <109.5° porque los dos pares solitarios son cada uno más repulsivos que los enlaces. Hay dos pares solitarios y dos enlaces simples a H alrededor de cada átomo central. (Esto es similar al caso de la letra b)).
Tendencia: Se trata de una serie de moléculas que varía en la identidad de los átomos colgantes; dos de las moléculas tienen halógenos, y la otra tiene átomos colgantes de hidrógeno. Este es un caso donde el tamaño y la electronegatividad serán factores conflictivos porque las tendencias en electronegatividad no reflejan la tendencia en tamaño.
- Tamaño: El tamaño de los átomos colgantes aumenta en el orden H < F < Cl donde H es más pequeño y Cl es el más grande. La predicción de ángulos de enlace basada solo en el tamaño conduciría al orden predicho de aumento del ángulo de enlace H 2 O < DE 2 < OCl 2.
- Electronegatividad: La electronegatividad disminuye en el orden F > Cl > H donde F tiene la mayor electronegatividad y H tiene la menor. Dado que esperamos que los átomos colgantes más electronegativos tengan los ángulos de enlace más pequeños, la predicción basada solo en la electronegatividad conduciría al orden predicho de aumentar el ángulo de enlace OF 2 < OCl 2 < H 2 O.
Los puntos anteriores ilustran cómo los dos argumentos diferentes conducirían a diferentes predicciones sobre la tendencia en el ángulo de enlace. Esto hace que sea difícil predecir el orden real de aumento del ángulo de unión. Sin embargo, vimos anteriormente en el ejemplo de NH 3 vs NF 3 que la electronegatividad es más importante que el tamaño; sin embargo, en el caso de NH 3 vs NCl 3, el tamaño mucho mayor del átomo colgante es más importante. Si aplicamos esta lección al problema actual, podríamos predecir el orden OF 2 < H 2 O< OCl 2, y de hecho esta predicción más matizada, basada en un caso similar, coincide con el orden real para los ángulos de enlace medidos: OF 2 (103.3°) < H 2 O (104. 5°) < OCl 2 (110.9°).
Electronegatividades grupales
Probablemente escuchaste los términos “grupo donador de electrones” y “grupo extractor de electrones” de tus cursos de Química Orgánica. Por ejemplo, el ácido trifluoroacético (TFA) es más ácido que el ácido acético debido a los efectos de extracción de electrones del grupo CF 3 en comparación con CH 3. CF 3 es un grupo aceptor de electrones, mientras que CH 3 es un grupo donador de electrones. Es decir, CF 3 es más electronegativo que CH 3.
La capacidad de extracción de electrones (electronegatividad) de los grupos puede ser estimada y comparada, tal como lo son con los átomos. Aunque no existe una escala única que se utilice para las electronegatividades grupales, y los valores publicados incluso para los mismos grupos varían ampliamente, existen tendencias confiables dentro de grupos similares. Los mismos factores de tamaño y electronegatividad discutidos anteriormente que afectan los ángulos de enlace para los átomos colgantes, también se pueden usar para racionalizar los ángulos de enlace distorsionados para grupos colgantes alrededor de un átomo central.
Considere las electronegatividades y tamaños relativos de los átomos/grupos colgantes en los siguientes ejemplos. ¿Es la tendencia en los ángulos de enlace lo que esperarías de las electronegatividades y tamaños relativos del grupo relativo? ¿Cuál, en su caso, es el factor más dominante para determinar la tendencia?
- N (CH 3) 3 tiene un ángulo de unión C-N-C de 110.9°, mientras que N (CF 3) 3 tiene un ángulo de unión de 117.9°.
- Los ángulos de enlace X-S-X en moléculas de la forma SO 2 (X) 2 son: SO 2 (OH) 2 101.3°; SO 2 (CF 3) 2 102.0°; SO 2 (CH 3) 2 102.6°.
- Respuesta (a)
-
Agrega textos aquí. No elimine primero este texto.
- Respuesta (b)
-
Agrega textos aquí. No elimine primero este texto.
Caso especial de electronegatividad y tamaño en número estérico 5 (bypyramid trigonal)
Las moléculas con número estérico 5 son interesantes porque poseen dos tipos diferentes de posiciones (ecuatorial y axial). Estas posiciones tienen ángulos de unión únicos y longitudes de unión. Los átomos/grupos colgantes tienen diferentes preferencias por las posiciones axial y ecuatorial que dependen algo de su electronegatividad.
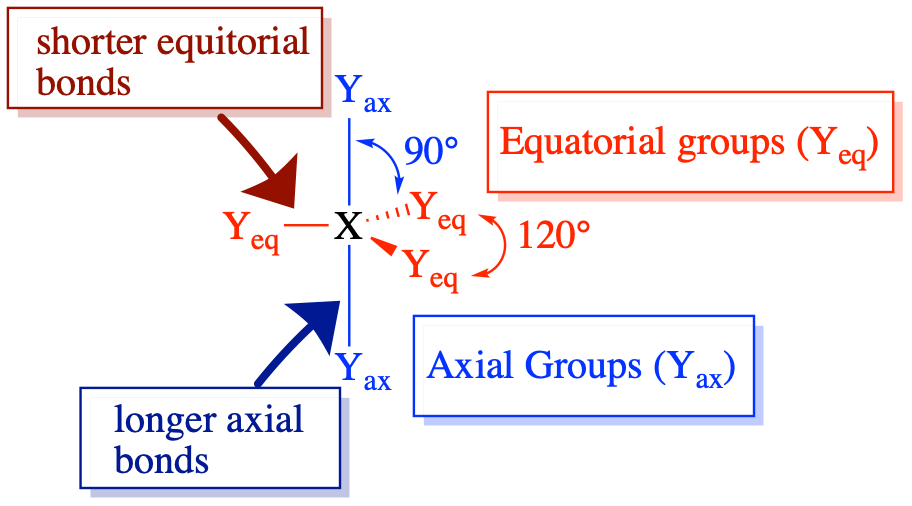
En una sección anterior, se discutió la preferencia de pares solitarios y enlaces múltiples por las posiciones ecuatoriales en moléculas bipiramidales trigonales. La teoría de VSEPR racionaliza esto asumiendo que los pares solitarios y los enlaces múltiples son más repulsivos que los pares de electrones en los enlaces simples. Las posiciones ecuatoriales están menos concurridas (con solo dos vecinos más cercanos a 90° y dos vecinos más lejanos a 120°) en comparación con las posiciones axiales (con tres vecinos más cercanos a 90°), por lo que los grupos más repulsivos prefieren las posiciones ecuatoriales menos abarrotadas.
Los grupos colgantes que son más electronegativos dan como resultado una repulsión de pares de electrones más débil alrededor del átomo central, mientras que los grupos que son menos electronegativos dan como resultado una repulsión de pares de electrones más fuerte alrededor del átomo central (como se describió anteriormente). El resultado para el número estérico 5: los pares de unión a elementos menos electronegativos son más repulsivos, y generalmente prefieren las posiciones ecuatoriales. Aún así, los pares solitarios y los enlaces múltiples son más repulsivos que los bonos simples y mostrarían una preferencia más fuerte por las posiciones ecuatoriales.
Ejemplos y matices
A continuación se encuentran algunos ejemplos de moléculas que demuestran la preferencia ecuatorial de grupos menos electronegativos. Predecir (dibujar) sus estructuras.
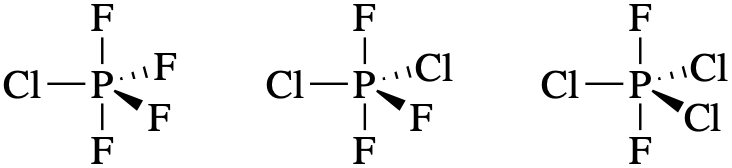
- PF 4 Cl, PF 3 Cl 2 y PF 2 Cl 3
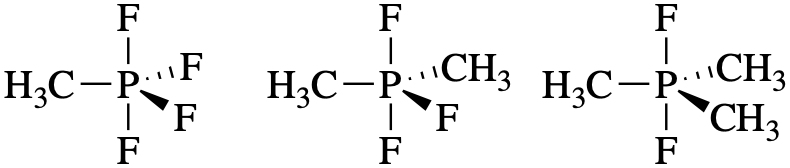
- PF 4 (CH 3) PF 3 (CH 3) 2 y PF 2 (CH 3) 3
- Respuesta (a)
-
Cl es menos electronegativo que F; por lo tanto, esperamos que Cl tenga mayor preferencia por las posiciones ecuatoriales.
- Respuesta (b)
-
CH 3, un grupo donador de electrones, es menos electronegativo que F. Esperamos que CH 3 tenga una preferencia más fuerte por las posiciones ecuatoriales.
En el ejercicio anterior, las estructuras pueden explicarse por la electronegatividad de los grupos colgantes; los grupos menos electronegativos prefieren las posiciones ecuatoriales. Existen otras moléculas similares para las cuales las explicaciones (o predicciones) son difíciles. Por ejemplo, la serie de moléculas a continuación parece tener una colocación completamente aleatoria de los grupos F y CF 3. Estas estructuras no se pudieron predecir con base en la teoría de VSEPR. Parece que en este caso, se prefieren los arreglos más simétricos de los grupos colgantes.
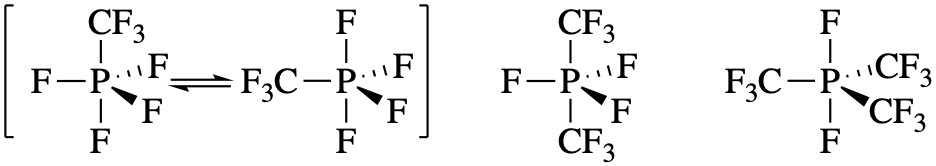
Referencias y recursos
- Pauling, L. (1932). “La Naturaleza del Enlace Químico. IV. La energía de los enlaces simples y la electronegatividad relativa de los átomos”. J. Am. Chem. Soc. 54 (9): 3570—3582. doi: 10.1021/ja01348a011.
- Housecroft, Catherine E. et. al. “Química Inorgánica” 3ª Edición. Pearson Education Limited 2008. Capítulo 2.5 “Valores de Electronegatividad” págs. 42-44
- Unión Internacional de Química Pura y Aplicada. “Electronegatividad “. goldbook.iupac.org/e01990.html.
- Pearson, R.G. Acc. Chem. Res. 1990, 23, 1, 1—2. https://doi.org/10.1021/ar00169a001
- Mulliken, R. S. (1934). “Una nueva escala de electroafinidad; junto con datos sobre estados de valencia y sobre potenciales de ionización de valencia y afinidades electrónicas”. J. Chem. Phys. 2 (11): 782—793. doi:10.1063/1.1749394.
- Mulliken, R. S. (1935). “Estructuras Electrónicas de Moléculas XI. Electroafinidad, Orbitales Moleculares y Momentos Dipolares”. J. Chem. Phys. 3 (9): 573—585. doi:10.1063/1.1749731.
- Allred, A. L.; Rochow, E. G. (1958). “Una escala de electronegatividad basada en la fuerza electrostática”. Revista de Química Inorgánica y Nuclear. 5 (4): 264—268. doi:10.1016/0022-1902 (58) 80003-2
- Sanderson, R. T. (1983). “Electronegatividad y energía de enlace”. Revista de la Sociedad Americana de Química. 105 (8): 2259—2261. doi:10.1021/ja00346a026
- Pearson, R. G. (1985). “Electronegatividad absoluta y dureza absoluta de ácidos y bases de Lewis”. J. Am. Chem. Soc. 107 (24): 6801. doi:10.1021/ja00310a009.
- Allen, Leland C. (1989). “La electronegatividad es la energía promedio de un electrón de los electrones de la capa de valencia en los átomos libres del estado de tierra”. Revista de la Sociedad Americana de Química. 111 (25): 9003—9014. doi:10.1021/ja00207a003.
- Mann, Joseph B.; Manso, Terry L.; Allen, Leland C. (2000). “Energías de Configuración de los Elementos del Grupo Principal”. Revista de la Sociedad Americana de Química. 122 (12): 2780—2783. doi:10.1021/ja992866e.
- Mann, Joseph B.; Manso, Terry L.; Caballero, Eugene T.; Capitani, Joseph F.; Allen, Leland C. (2000). “Energías de configuración de los elementos del bloque d”. Revista de la Sociedad Americana de Química. 122 (21): 5132—5137. doi:10.1021/ja9928677
Agradecimiento
- Matthew Salem (UC Davis) (Pauling Electronegativity)
- Introduction to Inorganic Chemistry Wikibook (https://chem.libretexts.org/Bookshel..._Bond_Strength)
Modified by Kathryn Haas (khaaslab.com)


