5.3.2: Vínculos polares
- Page ID
- 81046
Diagramas orbitales moleculares para moléculas diatómicas heteronucleares
El diagrama orbital molecular de una molécula diatómica heteronuclear se aborda de manera similar a la de una molécula diatómica homonuclear. Los diagramas orbitales también pueden tener un aspecto similar. Una diferencia importante es que el átomo más electronegativo tendrá orbitales a un nivel de energía más bajo. A continuación se explorarán dos ejemplos de moléculas diatómicas heteronucleares como ejemplos ilustrativos.
Diagrama MO de monóxido de carbono
El monóxido de carbono es un ejemplo de una molécula diatómica heteronuclear donde ambos átomos son elementos de segunda fila. Los orbitales moleculares de valencia en ambos átomos son los\(2p\) orbitales\(2s\) y. El diagrama orbital molecular para monóxido de carbono (Figura\(\PageIndex{1}\)) se construye de una manera similar a como se construiría dicarbono o dioxígeno, excepto que los orbitales de oxígeno tienen una energía potencial menor que los orbitales de carbono análogos. El etiquetado de orbitales moleculares en este diagrama sigue una convención mediante la cual a los orbitales se les dan etiquetas seriales según el tipo de orbital (\(\sigma\)\(\pi\),, etc.). A los orbitales de menor energía de cualquier tipo se les asigna un valor de 1 y se asignan orbitales de mayor energía del mismo tipo mediante intervalos crecientes (.. 2, 3, 4...). El sistema de marcaje orbital descrito anteriormente es inapropiado para moléculas diatómicas heteronucleares que no pueden asignarse\(g\) y\(u\) subíndices.
Una consecuencia de los niveles desiguales de energía orbital atómica es que la mezcla orbital es significativa. Observe el orden de los orbitales moleculares etiquetados\(1\pi\) y\(3\sigma\) en la Figura\(\PageIndex{1}\). Este es un orden\(\pi\) y\(\sigma\) orbitales similares al que vimos en el caso de las\(\sigma_g\) y\(\pi_u\) orbitales\(N_2\) y diatómicas más ligeras del segundo periodo. Debido a que la\(2p_z\) órbita del oxígeno es cercana en energía tanto al carbono\(2p_z\) como al carbono\(2s\), estos tres orbitales tendrán una interacción significativa (mezcla). El resultado es un incremento en la energía de la\(3\sigma\) órbita y una disminución en la energía de la\(2\sigma^*\) órbita, dando como resultado el diagrama mostrado en la Figura\(\PageIndex{1}\).
En el caso del monóxido de carbono (Figura\(\PageIndex{1}\)), los orbitales atómicos contribuyen de manera desigual a cada orbital molecular. Por ejemplo, debido a que el\(2s\) orbital del oxígeno es muy cercano en energía a la órbita\(2\sigma\) moelcular, contribuye a ese orbital molecular más que el\(2s\) orbital del carbono. Observe la forma de este\(2\sigma\) orbital y cómo se distribuye de manera desigual sobre los dos átomos; se distribuye más fuertemente en el oxígeno porque se parece más al oxígeno\(2s\). Esto está en línea con la suposición de que la densidad electrónica se distribuye más en el oxígeno porque es más electronegativo que el carbono. De igual manera, los\(1\pi\) orbitales están distribuidos de manera desigual, con más distribución cercana al oxígeno.
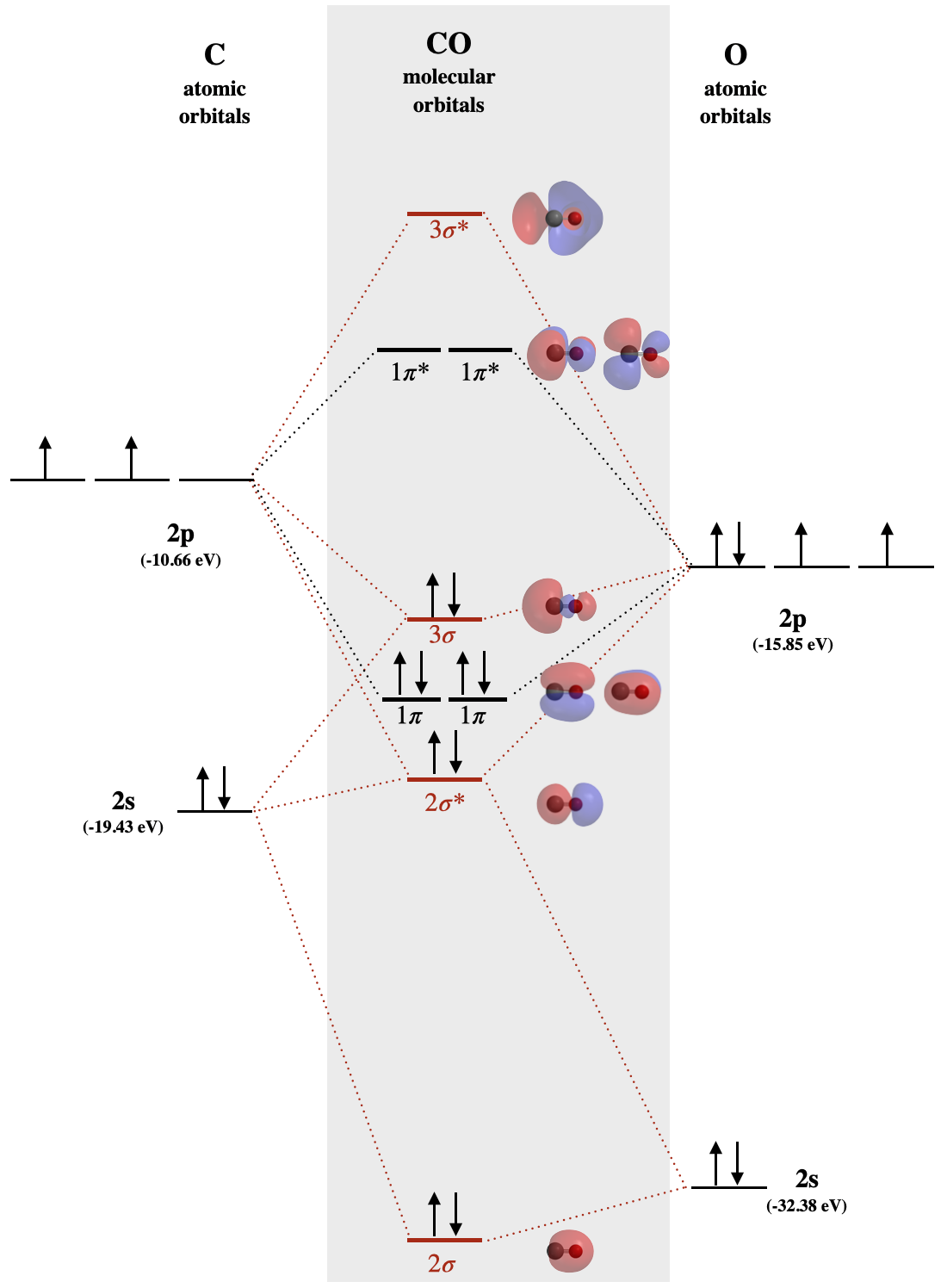
Examinar la forma de la\(3\sigma\) órbita del monóxido de carbono en la Figura\(\PageIndex{1}\). Describir en qué formas esta forma es diferente de la forma de los\(\sigma_g\) orbitales de las moléculas diatómicas homonucleares del segundo período (ver Fig. 5.2.1.1). Racionalizar estas diferencias. Ambos orbitales se recrean a continuación para mayor comodidad.

- Responder
-
El\(\sigma\) orbital 3 es como el\(\sigma_g\) en que tiene tres lóbulos y dos nodos distribuidos a lo largo del enlace internuclear. Son diferentes en su distribución. Los dos lóbulos externos de\(\sigma_g\) están distribuidos uniformemente porque son una combinación igual de dos\(p_z\) orbitales (uno de cada átomo). El\(3\sigma\) orbital está más fuertemente distribuido hacia el átomo de carbono, el átomo menos electronegativo, que hacia el oxígeno. La distribución desigual de\(3\sigma\) es evidente en los tamaños desiguales de sus lóbulos exteriores y la forma desigual del lóbulo interior. La distribución más pesada dentro del lóbulo exterior sobre el carbono es causada por la mezcla de la órbita de carbono con\(2s\)\(2p_z\) orbitales de carbono y oxígeno. La forma irregular del lóbulo interior, donde se inclina hacia el oxígeno, se explica mejor por el hecho de que la\(3\sigma\) órbita está más cerca en energía al oxígeno\(2p_z\) que al carbono\(2p_z\).
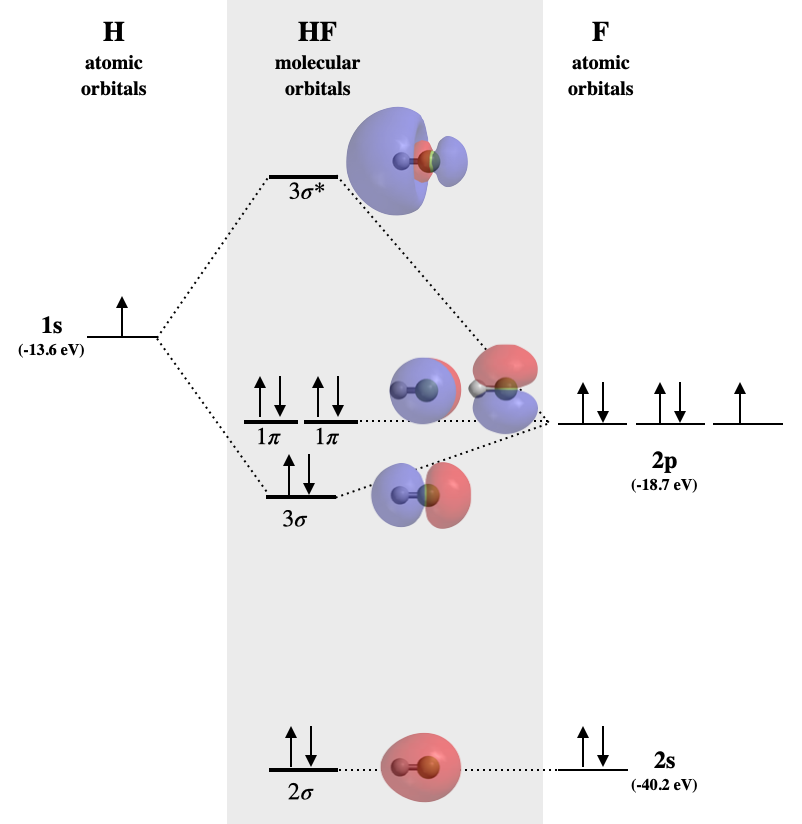
Diagrama MO de fluoruro de hidrógeno
El fluoruro de hidrógeno es un ejemplo de una molécula diatómica heteronuclear en la que los dos átomos son de diferentes períodos. En este caso, la valencia orbital de H es\(1s\) mientras que las de F son\(2s\) y\(2p\). El diagrama orbital molecular para HF se muestra en la Figura\(\PageIndex{2}\).
Tres de estos orbitales tienen simetría compatible para la mezcla; estos son el hidrógeno\(1s\), el flúor\(2s\) y el flúor\(2p\). Sin embargo, la medida en que interactuarán depende de sus energías relativas. El flúor es más electronegativo que el H, y el átomo de flúor tiene una energía de primera ionización más alta que el hidrógeno. De estas tendencias, podemos esperar que los orbitales de valencia de flúor sean más bajos en energía que el del hidrógeno. Del Cuadro 5.3.1, encontramos que la órbita 1s de H (-13.6 eV) es mayor en energía que ambos orbitales de flúor (-18.7 y -40.2 eV, respectivamente para\(2p\) y\(2s\)). Las energías de hidrógeno\(1s\) y flúor\(2p\) son una buena coincidencia para la combinación; sin embargo, la\(2s\) órbita del flúor es muy diferente para crear una interacción productiva. Por lo tanto, esperamos que el flúor\(2s\) cree un orbital molecular sin unión, mientras que los\(2p_z\) orbitales\(1s\) y se combinan para hacer orbitales moleculares de\(\sigma\)\(\sigma^*\) unión y antiunión. El resto\(2p_x\) y\(2p_y\) los orbitales no tienen simetría compatible para enlazar con hidrógeno, y formarán orbitales\(\pi\) moleculares no vinculantes. Los orbitales no vinculantes tendrán energía y carácter similares a sus orbitales atómicos componentes.
Las reacciones químicas tienen lugar en los orbitales HOMO y LUMO
El conocimiento de los diagramas orbitales moleculares y las formas de los orbitales moleculares se puede utilizar para explicar y predecir con precisión la reactividad química. Las reacciones químicas se llevan a cabo utilizando los orbitales moleculares más altos ocupados (HOMO) de un nucleófilo o base de Lewis, y el orbital molecular desocupado más bajo (LUMO) de un electrófilo o ácido de Lewis.
Las bases de Lewis reaccionan usando electrones en el HOMO, mientras que los ácidos de Lewis reaccionan usando el LUMO vacío.
Ejemplo: Reactividad del CO con iones metálicos
El CO es un excelente ligando para muchos iones metálicos. De hecho, la fuerte afinidad entre el CO y los iones de hierro hemo (Fe) en la hemoglobina puede explicar el mecanismo de intoxicación por monóxido de carbono. Cuando el CO se une en lugar de\(O_2\) a la hemoglobina, esa hemoglobina ya no puede transportarse\(O_2\) a las células tisulares. La unión de CO a la hemoglobina es fuerte y prácticamente irreversible. Cuando el CO se une a iones metálicos, lo hace a través del átomo de carbono. Esto es contrario a las expectativas basadas en la estructura de Lewis y la polaridad de enlace conocida, donde la densidad de electrones se polariza hacia el oxígeno. ¡La distribución de la densidad electrónica del HOMO de CO puede explicar esta observación!
Consulte el diagrama MO para CO. Identificar el HOMO y explicar por qué el CO se une a iones metálicos a través del átomo de carbono y no a través del átomo de oxígeno.
- Responder
-
En la interacción entre CO y un ion metálico, el CO actuaría como base de Lewis; así reaccionará usando electrones en su HOMO. El diagrama MO para CO se muestra en la Figura\(\PageIndex{1}\): el HOMO es el\(3\sigma\) orbital (también discutido en. La densidad electrónica de ese MO se centra alrededor del átomo de carbono, por lo que el átomo de carbono será una mejor base de Lewis que el átomo de O.


