5.3.3: Compuestos Iónicos y Orbitales Moleculares
- Page ID
- 81037
Las interacciones iónicas se encuentran en un extremo en un espectro de unión. En el extremo opuesto del espectro están los enlaces covalentes no polares (por ejemplo, diatomeas homonucleares). En estas moléculas, los orbitales moleculares están formados por orbitales atómicos de igual energía, dando como resultado una densidad electrónica distribuida uniformemente sobre la molécula. En la mitad del espectro se encuentran los casos de enlaces covalentes polares (por ejemplo, diatómicos heteronucleares), en los que los orbitales atómicos de energías desiguales contribuyen de manera desigual a los orbitales moleculares, dando como resultado una distribución desigual de la densidad electrónica a través de la molécula. En el caso de los enlaces polares, la densidad electrónica se desplaza hacia el átomo más electronegativo ya que ese átomo contribuye más a los orbitales moleculares de unión de energía más baja. Se pueden dibujar diagramas orbitales moleculares para compuestos iónicos como si fueran enlaces extremadamente polares en los que los electrones no solo se desplazan hacia, sino que se transfieren completamente al átomo más electronegativo.
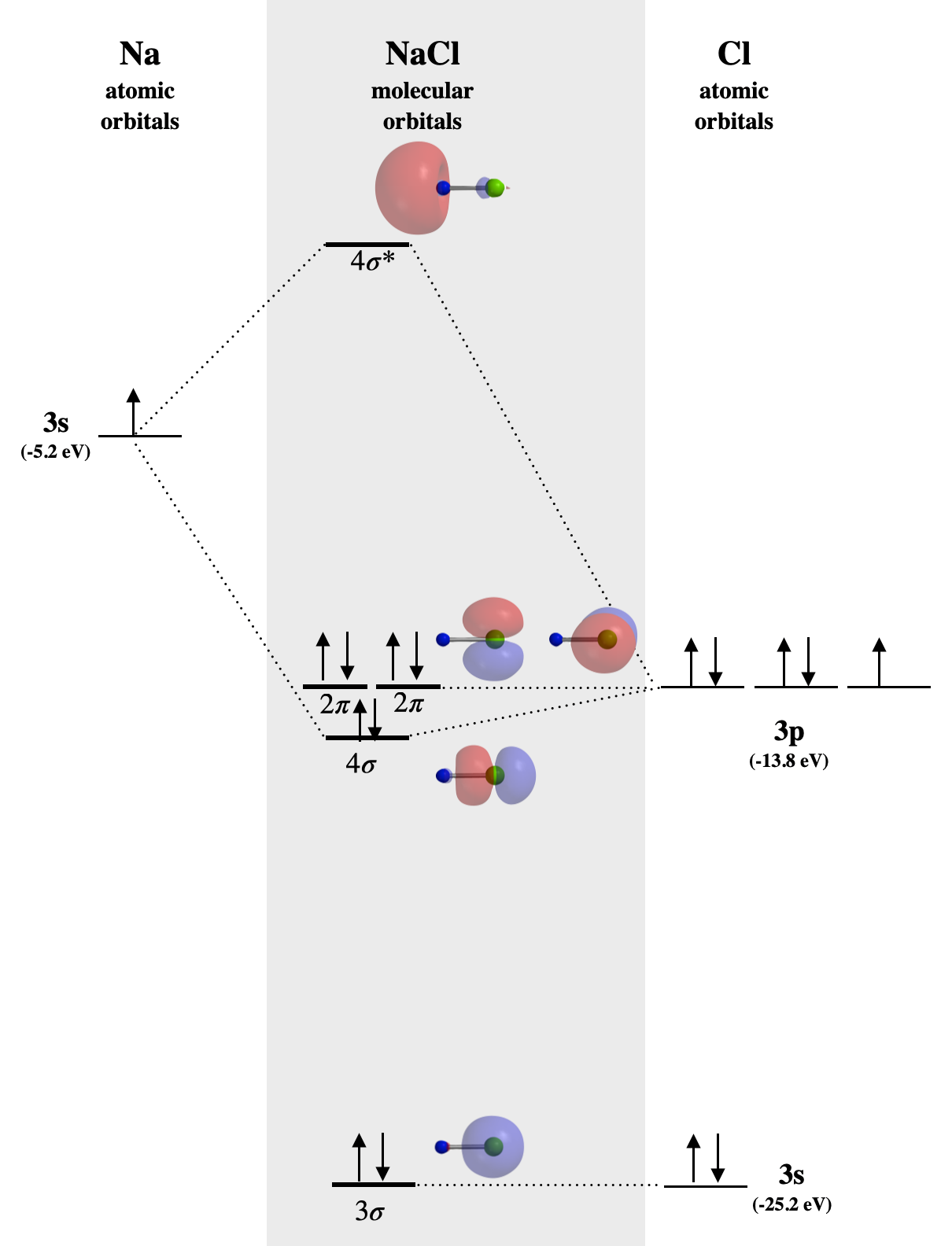
Ejemplo: NaCl
En\(\ce{NaCl}\), el\(3s\) orbital de sodio (-5.2 eV) es significativamente mayor en energía que los orbitales de valencia de cloro. El cloro\(3s\) y\(3p_z\) los orbitales tienen simetría compatible, sin embargo, solo el\(3p_z\) orbital (-13.8 eV) está lo suficientemente cerca en energía como para interactuar con el Na\(3s\); aún así, la diferencia de energía es lo suficientemente grande como para debilitar la unión. El\(3s\) orbital de Na se combina con Cl\(3p_z\) para formar los orbitales moleculares marcados\(4\sigma\) y\(4\sigma^*\) en la Figura\(\PageIndex{1}\). El\(4\sigma\) orbital se une débilmente, pero es muy cercano en energía al\(3p_z\) orbital Cl, y en su mayoría tiene un carácter similar a Cl. Observe que todos\(\sigma\) los orbitales se parecen mucho a cualquiera\(s\) o a\(p\) orbitales centrados en el\(\ce{Cl}\) átomo, mientras que el\(4\sigma^*\) orbital está centrado casi en su totalidad en Na. La falta de orbitales moleculares que se distribuyen sobre ambos átomos a la vez es consistente con una falta de carácter significativo de enlace covalente en\(\ce{NaCl}\). La unión aquí se caracteriza por la transferencia de un electrón de\(\ce{Na}\) a\(\ce{Cl}\) y es casi completamente electrostática. La unión que es principalmente de carácter electrostático es no direccional, a diferencia de la unión covalente verdadera.
Dibuja el diagrama orbital molecular para\(\ce{LiF}\). Asegúrese de etiquetar todos los orbitales moleculares de manera apropiada y especifique si en su mayoría son vinculantes, no enlazantes o antiligantes. Identificar el HOMO y LUMO. Dibuja las formas aproximadas de todos los orbitales.
- Contestar
-
Esperamos\(\ce{LiF}\) ser un compuesto iónico porque la diferencia de energía en los orbitales de valencia es de al menos 10-14 eV. (Ver Cuadro 5.3.1) Hay una variedad de formas utilizadas para etiquetar orbitales moleculares. En la siguiente figura, estamos utilizando la convención de etiquetar cada tipo de orbital con números a partir de los orbitales de menor energía. El\(1\sigma\) orbital sería\(1s\) en su mayoría de carácter F y no se muestra. El\(2\sigma\) orbital es mayormente de naturaleza no ligante, aunque tiene una contribución muy pequeña\(2s\) de Li debido a la simetría compatible. El\(3\sigma\) orbital está ligeramente unido pero\(2p\) en su mayoría es de carácter F. Los dos\(1\pi\) orbitales son completamente no vinculantes. El\(3\sigma^*\) orbital es antiadhesión.
- HOMO es\(1\pi\)
- LUMO es\(3\sigma^*\)
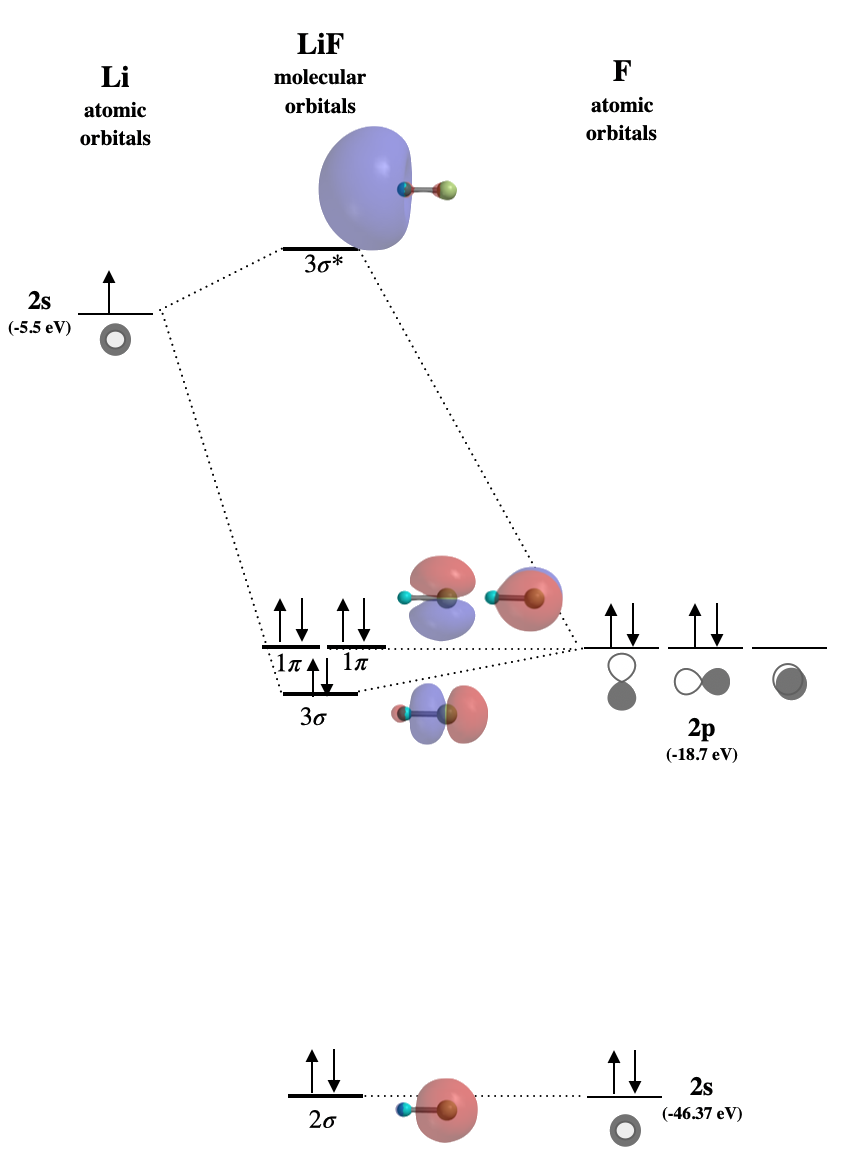
Figura para Ejercicio\(\PageIndex{1}\): Diagrama orbital molecular para el compuesto iónico, LiF. (CC-BY-NC-SA, Kathryn Haas)


