5.4.3: H2O
- Page ID
- 81020
Construye las SALC y el diagrama orbital molecular para H\(_2\) O.
Este es el primer ejemplo hasta ahora que no es una molécula lineal. El agua es una molécula doblada, por lo que es importante recordar que las interacciones de los ligandos colgantes dependen de sus posiciones en el espacio. Se debe considerar que las posiciones de los tres átomos en el agua están esencialmente fijas en relación entre sí. El proceso para construir el diagrama orbital molecular para una molécula no lineal, como el agua, es similar al proceso para moléculas lineales. Caminaremos por los pasos a continuación para construir el diagrama orbital molecular del agua.
Pasos Preliminares
Paso 1. Encuentra el grupo de puntos de la molécula y asigna coordenadas cartesianas para que z sea el eje principal.
La molécula H\(_2\) O está doblada y su grupo puntual es\(C_{2v}\). El\(z\) eje es colineal con el eje principal, el\(C_2\) eje. No hay necesidad de simplificar este problema, como lo habíamos hecho para ejemplos anteriores. El grupo de\(C_{2v}\) puntos es bastante sencillo.
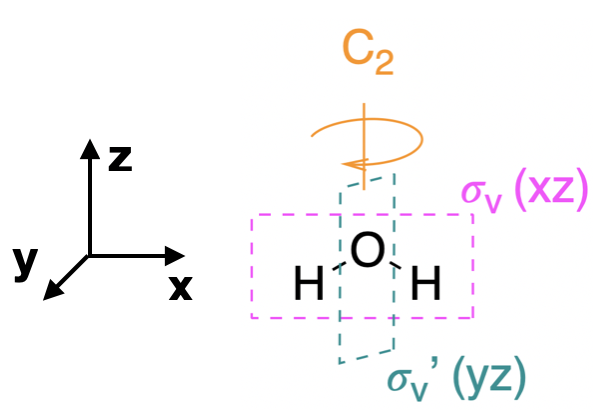
Paso 2. Identificar y contar los orbitales de valencia de los átomos colgantes.
Cada uno de los dos átomos de hidrógeno colgantes tiene una valencia orbital, la\(1s\). Así, podemos esperar un total de dos SALC de estos dos átomos.
Generar SALC
Las SALC para H\(_2\) O son bastante simples, sin embargo, derivaremos sistemáticamente las SALC aquí para demostrar el proceso.
Paso 3. Generar los\(\Gamma\)'s
Usa la tabla de\(C_{2v}\) caracteres para generar una representación reducible (\(\Gamma\)); en este caso solo necesitamos una\(\Gamma\) porque solo hay un tipo de valencia orbital (la\(1s\)). Para cada\(s\) orbital, asigne un valor de 1 si permanece en su lugar durante la operación o cero si se mueve fuera de su lugar original. El\(\Gamma\) se da a continuación:
\[\begin{array}{|c|cccc|} \hline \bf{C_{2v}} & E & C_2 &\sigma_v (xz) & \sigma_v' (yz) \\ \hline \bf{\Gamma_{1s}} & 2 & 0 & 2 & 0 \\ \hline \end{array} \nonumber \]
Paso 4. Romper\(\Gamma\) en representaciones irreducibles para SALC individuales
Reducir cada uno\(\Gamma\) en sus representaciones componentes irreducibles. Utilizando cualquiera de los procesos descritos anteriormente, encontramos que el\(\Gamma\) reduce a las dos representaciones irreducibles\(A_1\) y\(B_1\) bajo el grupo de\(C_{2v}\) puntos.
\ [\ begin {array} {|c|cccc|}\ hline\ bf {C_ {2v}} & E & C_2 &\ sigma_v (xz) &\ sigma_v' (yz)\\\ hline\ bf {\ gamma_ {1s}} &\ bf 2 &\ bf 0 &\ bf 2 &\ bf 0\
A_ {1} & 1 & 1 & 1 & 1\\
B_ {1} & 1 & -1 & 1 & -1\\
\ hline\ end {array}\ nonumber\]
Paso 5. Esbozar las SALC
Del proceso sistemático anterior, se han encontrado las simetrías (las representaciones irreducibles) de ambas SALC bajo el grupo de\(C_{2v}\) puntos. Para bosquejar el SALC que corresponde a cada representación irreducible, nuevamente usamos la tabla de\(C_{2v}\) caracteres, y específicamente las funciones listadas en las columnas del lado derecho de la tabla.
Una\(A_1\) SALC: La\(A_1\) SALC es individualmente degenerada y simétrica con respecto tanto al eje principal (\(z\)) como al centro de inversión (\(i\)) (basado en su Etiqueta Mulliken). Podemos observar las funciones en la tabla de\(C_{2v}\) caracteres que corresponden\(A_1\) y ver que es completamente simétrica bajo el grupo (porque la combinación de\(x^2,y^2,z^2\) muestra que es totalmente simétrica). Esta sería la misma simetría que un\(s\) orbital en el átomo de oxígeno central. A partir de esta información, sabemos que esta SALC debe tener simetría compatible con un\(s\) orbital en el átomo central. También podemos ver en la tabla de caracteres que el\(z\) eje, y por lo tanto un\(p_z\) orbital sobre el oxígeno, también posee\(A_1\) simetría. Esto nos dice que además de ser compatible con el\(s\) orbital de oxígeno, también debería ser compatible con el\(p_z\) orbital de oxígeno. A partir de esta información podemos dibujar el\(A_1\) SALC que se muestra en la Figura\(\PageIndex{2}\). Si no es obvio cómo se realiza el\(A_1\) boceto en la Fig. \(\PageIndex{2}\)es compatible con los\(p_z\) orbitales\(s\) y del oxígeno, inspeccionar los dibujos correspondientes a orbitales moleculares\(2a_1\) y\(3a_1\) en la Fig. \(\PageIndex{3}\).
Una\(B_{1}\) SALC: La Etiqueta Mulliken nos dice que la\(B_{1}\) SALC es individualmente degenerada y antisimétrica con respecto tanto al eje principal como al centro de inversión. La función,\(x\), apareciendo con\(B_{1}\) en la tabla de caracteres nos dice que esta SALC tiene la misma simetría que el\(x\) eje, o un\(p_x\) orbital sobre el átomo de oxígeno central. A partir de esta información, sabemos que esta SALC debe ser compatible con un\(p_x\) orbital en el átomo central, y podemos dibujar las\(B_{1}\) SALC mostradas en la Figura\(\PageIndex{2}\). Si no es obvio cómo se realiza el\(B_1\) boceto en la Fig. \(\PageIndex{2}\)es compatible con la\(p_x\) órbita del oxígeno, inspeccionar el dibujo correspondiente al orbital molecular\(1b_1\) en la Fig. \(\PageIndex{3}\).
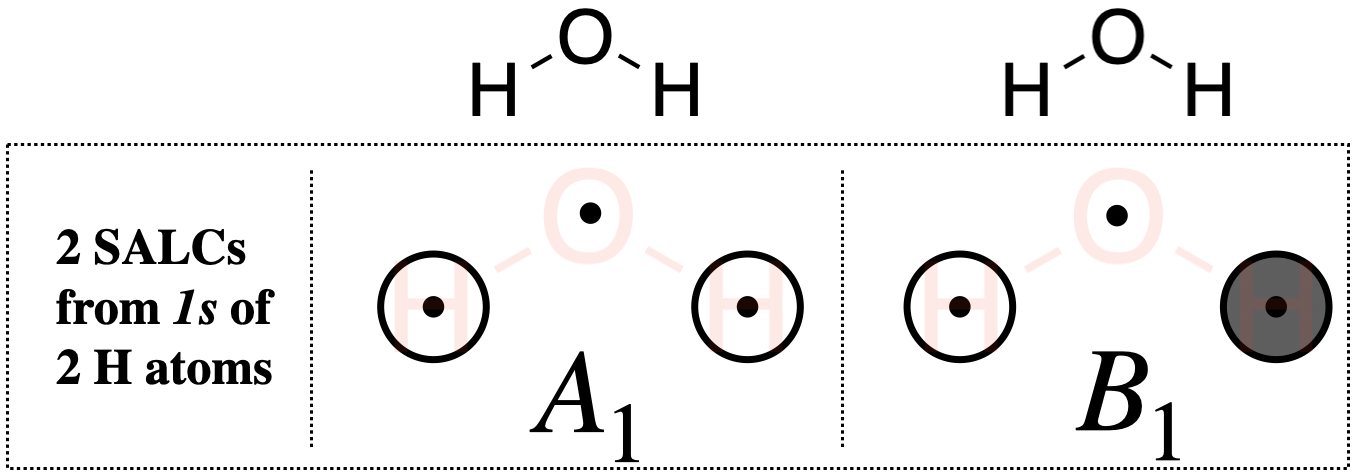
¿No estás convencido de los bocetos de estos SALC? Puedes convencerte poniéndolos a prueba. Prueba el ejercicio a continuación.
Realizar todas las operaciones del grupo de\(C_{2v}\) puntos sobre los dos bocetos de las SALC H que se muestran en la Figura\(\PageIndex{2}\), y convencerse de que cada boceto sí posee las\(B_1\) simetrías\(A_1\) y las simetrías asignadas a ellos, respectivamente, bajo el grupo de\(C_{2v}\) puntos.
- Responder
-
Agrega textos aquí. No elimine primero este texto.
Dibuja el diagrama MO para\(H_2O\)
Paso 6. Combina SALC con AO de simetría similar.
Primero debemos identificar los orbitales de valencia en el oxígeno central: hay cuatro incluyendo\(2s\),\(2p_x\),\(2p_y\), y\(2p_z\). Ahora identificamos la simetría de cada uno usando la tabla de\(C_{2v}\) caracteres. La simetría de un\(2s\) orbital central corresponde a la combinación de funciones\(x^2\),\(y^2\), y\(z^2\) en la tabla de caracteres; esto es\(A_1\). El\(p_z\) orbital también corresponde a\(A_1\). Y así sucesivamente... A continuación se enumeran las simetrías de los orbitales de valencia de oxígeno. \[2s =A_1 \\ 2p_x = B_1 \\ 2p_y = B_2 \\ 2p_z = A_1 \nonumber \]
Ahora que hemos identificado las simetrías de las dos SALC de hidrógeno y los cuatro orbitales de valencia sobre el oxígeno, sabemos qué orbitales atómicos y SALC pueden combinar en base a simetrías compatibles. También necesitamos conocer los niveles relativos de energía orbital para poder predecir la fuerza relativa de las interacciones orbitales. Las energías de ionización orbital se enumeran en la Sección 5.3 .1.
Con conocimiento tanto de simetrías orbitales como de energías, podemos construir el diagrama orbital molecular. Los orbitales de valencia del oxígeno van en un lado del diagrama mientras que los orbitales del grupo de hidrógeno se dibujan en el lado opuesto. Los orbitales moleculares se dibujan en la columna central del diagrama, como se muestra en la Figura\(\PageIndex{3}\):
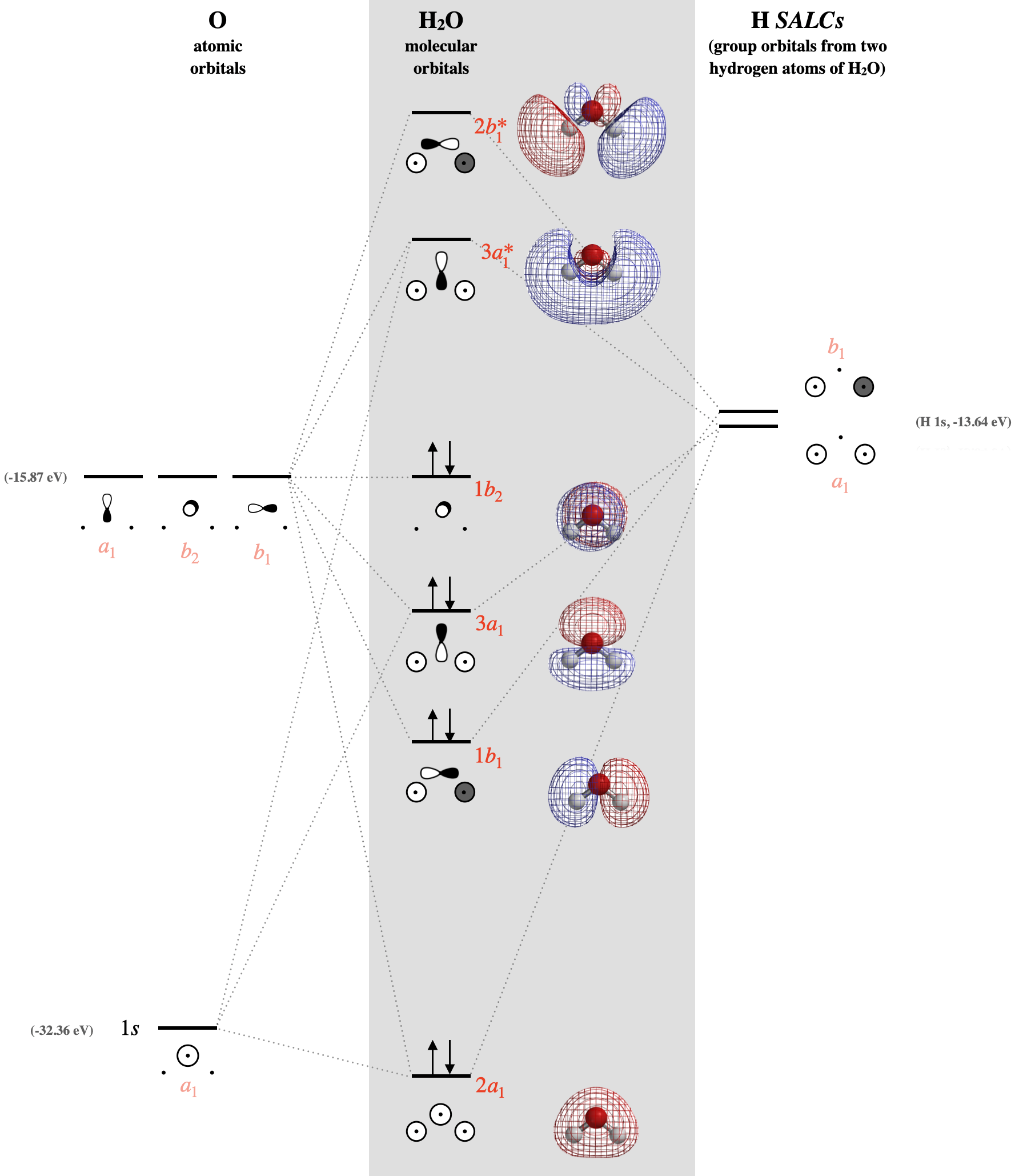
En los ejemplos anteriores mostrados para los diagramas orbitales moleculares del anión bifluoruro y el dióxido de carbono, discutimos las diferencias en la comprensión de esas moléculas a partir de la teoría orbital molecular en comparación con las estructuras de Lewis. El agua contiene dos pares solitarios en su estructura Lewis. Compare las predicciones sobre los pares de electrones solitarios del agua y su reactividad con base en (1) la combinación de modelos elementales (teorías de Lewis, Valence Bond y Orbital Hídrizado) y (2) Teoría Orbital Molecular. Abordar y explicar específicamente en qué se diferencian los modelos elementales de la teoría orbital molecular en los siguientes aspectos:
- ¿Dónde están las parejas solitarios en el agua?
- ¿Los dos pares solitarios son equivalentes o son diferentes?
- ¿Dónde están los sitios en la molécula que sufrirán reacción con electrófilos y nucleófilos?
Solución
1) Modelos elementales: La estructura de Lewis predice que dos pares solitarios están (a) localizados en el átomo de oxígeno del agua y que (b) ambos pares solitarios son equivalentes. La estructura de Lewis, combinada con Valence Bond Theory, predeciría que los pares solitarios ocupan dos orbitales\(sp^3\) atómicos hibridados equivalentes sobre el oxígeno. (c) La teoría de Lewis predeciría que los pares solitarios de oxígeno son nucleófilos; así un electrófilo reaccionaría con los pares solitarios de átomos de oxígeno. El enlace O-H polarizado deja a los átomos de H como las ubicaciones más electrofílicas en la molécula de agua; así los nucleófilos reaccionarían en los átomos de H del agua.
2) Teoría orbital molecular: Los orbitales moleculares predicen que (a) los dos pares solitarios de agua no son equivalentes, y que (b) cada uno se distribuye por toda la molécula. Un par solitario se encuentra en el\(1b_2\) orbital verdaderamente no enlazante (Figura\(\PageIndex{3}\)), que también es el HOMO. No hay otro orbital verdaderamente no enlazante en la molécula, pero el\(2a_1\) orbital de menor energía podría considerarse mayormente no enlazante debido a la gran diferencia de energía entre ésta y otros orbitales de valencia. (c) Aunque el\(2a_1\) orbital puede considerarse en su mayoría no enlazante, no podemos esperar que los electrones en\(2a_1\) reaccionen fácilmente, ya que están en el orbital molecular de menor energía. La teoría orbital molecular predice que las reacciones ocurren en los orbitales HOMO y LUMO. El HOMO reacciona con electrófilos, y en este caso, el HOMO se distribuye sobre las caras superior e inferior de la molécula, y se centra en el átomo de oxígeno. El LUMO reaccionaría con nucleófilos. El LUMO es el orbital marcado\(3a_1^*\) en la Figura\(\PageIndex{3}\), y tiene un lóbulo mayor que se distribuye más fuertemente sobre los átomos de H, y a partir de esto debemos predecir que los átomos de H son el sitio preferido de reacción para los nucleófilos.
Expresar orbitales moleculares en términos de\(\Psi\)
La expresión general para un orbital molecular, o la combinación lineal de orbitales atómicos (LCAO), se dio previamente como\(\Psi=c_{a} \psi_{a}+c_{b} \psi_{b}\). En esta expresión, la función ondulada de dos átomos (\(\psi_a\)y\(\psi_b\)) se combina para formar la función ondulada del orbital molecular. Los coeficientes\(c_a\) y\(c_b\) cuantifican la contribución de cada atómico\(\psi\) a lo molecular\(\Psi\).
\[\Psi=c_{a} \psi_{a}+c_{b} \psi_{b} \nonumber \]
En el caso de los orbitales poliatómicos, cada LCAO está construido de orbitales atómicos a partir de un átomo central y orbitales grupales (SALC) de los átomos pendientes. En el caso del agua, la expresión anterior podría modificarse para dar la expresión a continuación.
\[\Psi = c_{oxygen}\left(\psi_{oxygen}\right) + c_{SALCs}\left(N (\psi_{H_a} \pm \psi_{H_b})\right) \nonumber \]
N representa el requisito normalizador que se mencionó anteriormente en referencia a los requisitos para funciones de onda de electrones y probabilidad. El requisito normalizador simplemente establecido es el requisito de que la probabilidad de encontrar el electrón en cualquier orbital, incluyendo orbitales grupales, es 1. En general, el valor de N para un grupo orbital es... \[N=\frac{1}{\sum{c_i^2} } \nonumber \]... donde\(c_i\) está el coeficiente de cada orbital atómico único que contribuye al grupo. Para las SALC de hidrógeno del agua, existen dos orbitales atómicos que contribuyen a igual a cada SALC, por lo que el coeficiente en cada uno de los dos orbitales es de 1. Esto da\(N=\left(\frac{1}{\sqrt{1^2 + 1^2}}\right) = \frac{1}{\sqrt{2}}\) para las H SALC de agua.
Solo hay dos SALC de hidrógeno: la en la que se agregan las funciones de onda de hidrógeno (\(N(\psi_{H_a} + \psi_{H_b})\)) tiene\(A_1\) simetría, y la en la que se restan las funciones de onda de hidrógeno (\(N(\psi_{H_a} - \psi_{H_b})\)) tiene\(B_1\) simetría.
Los orbitales moleculares de la Figura\(\PageIndex{3}\) se expresan a continuación en términos de su LCAO de funciones de onda individuales. Sin embargo, tenga en cuenta que estas expresiones son simplificaciones que ignoran la mezcla orbital. Por ejemplo, como se expresa a continuación, ignoran las contribuciones de oxígeno\(2s\) a los orbitales moelculares de mayor energía con\(A_1\) simetría (la\(3a_1\) y\(3a_1^*\) en la Figura\(\PageIndex{3}\)).
\ [\ begin {array} {|rcccc|l|}
\ hline MO & & Oxígeno AO & & Hidrógeno SALC & Descripción
\\ hline\ Psi_ {2a_1} & = & c_ {(ox1)}\ psi_ {(2s)} & + & c_ {(hy1)} [N (\ psi_ {h_a} +\ psi_ {h_b})] & c_ {(hy1)}\ text {es positivo; enlace, ligeramente no unido}\\
\ Psi_ {1b_1} & = & c_ {(ox2)}\ psi_ {(2p_x)} & + & c_ {(hy2)} [N (\ psi_ {h_a} -\ psi_ {h_b})] & c_ {(hy2)}\ text {es positivo; vinculación}\
\\ Psi_ {3a_1} & = & _ {(ox3)}\ psi_ {(2p_z)} & + & c_ {(hy3)} [N (\ psi_ {h_a} +\ psi_ {h_b})] & c_ {(hy3)}\ texto {es positivo; unión}\\
\ Psi_ {1b_2} & = &\ psi_ {(2p_y)} & &\ text {no vinculación}\\
\ Psi_ {3a_1} ^* & = & c_ {(ox4)}\ psi_ {(2p_z)} & + & c_ {(hy4)} [N (\ psi_ {h_a} +\ psi_ {h_b})] & c_ {(hy4)}\ text {es negativo; antiadhesión}\\
\ Psi_ {1b_1} ^ * & = & c_ {(ox5)}\ psi_ {(2p_x)} & + & c_ {(hy5)} [N (\ psi_ {h_a} -\ psi_ {h_b})] & c_ {(hy5)}\ text {es negativo; antiadhesión}\
\ hline\ end {array}\ nonumber\]

