6.3.3: El comportamiento ácido-base de los hidruros de elementos binarios está determinado principalmente por la electronegatividad del elemento y secundariamente por la fuerza del enlace elemento-hidrógeno.
- Page ID
- 81279
Los compuestos formados entre los elementos y el hidrógeno se denominan hidruros binarios. Todos estos compuestos pueden actuar en principio como ácidos de Brønsted en reacciones con una base adecuadamente fuerte. Sin embargo, a medida que la electronegatividad disminuye en un grupo y aumenta de izquierda a derecha a través de la tabla periódica, la acidez de los hidruros binarios aumenta. De hecho, en el lado izquierdo de la tabla periódica los hidruros de metales alcalinos y alcalinotérreos extremadamente electropositivos no son ácidos sino básicos. Quizás se consideren mejor como sales iónicas del ion hidruro (\(\ce{H^{-}}\)). En consecuencia sustancias como\(\ce{NaH}\) y\(\ce{CaH2}\) tienden a actuar como bases de Brønsted en sus reacciones.
\[\ce{NaH(s) + H2O(l) → Na^{+}(aq) + OH^{-}(aq) + H2(g)} \nonumber \]
\[\ce{CaH2(s) + 2H2O(l) → Ca^{2+}(aq) + 2OH^{-}(aq) + 2H2(g)} \nonumber \]
En el lado derecho de la tabla periódica los hidruros binarios de los no metales presentan acidez apreciable.
\[\ce{HBr(aq) + H2O(l) → H^{+}(aq) + Br^{-}(aq)} \nonumber \]
Por esta razón, los hidruros binarios no metálicos se denominan hidruros ácidos. Sin embargo, no todos son igualmente ácidos. Las constantes de ionización ácida acuosa diluida para estos hidruros se dan en la Figura\(\PageIndex{1}\). Como puede verse a partir de las constantes de la Figura\(\PageIndex{2}\), la capacidad de los hidruros para transferir un hidrógeno al agua aumenta a lo largo de un periodo y a lo largo de un grupo.
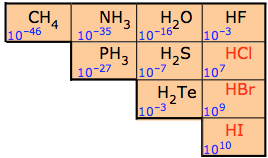
Estas tendencias se deben en gran parte a los cambios en la electronegatividad y tamaño del átomo no metálico:
1. Al pasar por un periodo, la fuerza ácida aumenta a medida que aumenta la electronegatividad y la molécula se vuelve más polar, con el hidrógeno obteniendo una mayor carga positiva parcial. Esto hace que sea más fácil escindir heterolíticamente el enlace E-H para producir un anión estable.
\[E-H → E:^- + H^+ \nonumber \]
2. Bajando un grupo, la fuerza ácida aumenta debido a que la fuerza de unión disminuye en función del aumento del tamaño del no metal, y esto tiene un efecto mayor que la electronegatividad. De hecho, el HF es un ácido débil porque es tan pequeño que el enlace hidrógeno-flúor es tan fuerte que es difícil de romper. Recuerda, cuanto más débil es el enlace, más fuerte es la fuerza ácida. Esto se ilustra adicionalmente en la Tabla\(\PageIndex{1}\), donde el enlace más débil ha producido el ácido más fuerte.
| Fuerza relativa a los ácidos | HF | << | HCl | < | HBr | < | HOLA |
|---|---|---|---|---|---|---|---|
| Energía de enlace H—X (kJ/mol) | 570 | 432 | 366 | 298 | |||
| K a | 10 -3 | 10 7 | 10 9 | 10 10 |
Colaboradores y Atribuciones
- Stephen M. Conakes (Westmont College),
* quien amplió esta sección de una combinación de
https://chem.libretexts.org/Courses/University_of_Arkansas_Little_Rock/Chem_1403%3A_General_Chemistry_2/Text/16%3A_Acids_and_Bases/16.6%3A_Molecular_Structure%2C_Bonding%2C_and_Acid-Base_Behavior y https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Book%3A_Organic_Chemistry_with_a _Biológico_Enfatisis_ (Soderberg) /Capítulo_ 07% 3a_Compuestos orgánico_comos_ácidos_y_bases/ 7.3% 3a_efectos_estructurales_en_acidez_y_basicity

