6.3.4: Superácidos Brønsted-Lowry y la Función de Acidez de Hammett
- Page ID
- 81257
Los ácidos con una acidez mayor que la del ácido sulfúrico se conocen como superácidos.
Los superácidos son capaces de disociarse completamente porque cuando lo hacen dan un anión extremadamente estable en el que la carga negativa residual se distribuye entre múltiples átomos electronegativos. Por ejemplo, en mezclas de pentafluuro de antimonio\(\ce{HF}\) y la disociación de un ion hidrógeno del\(\ce{HF}\) es promovida por la formación de un aducto ácido-base\(\ce{HF}\) de Lewis entre el floro y\(\ce{SbF_5}\).
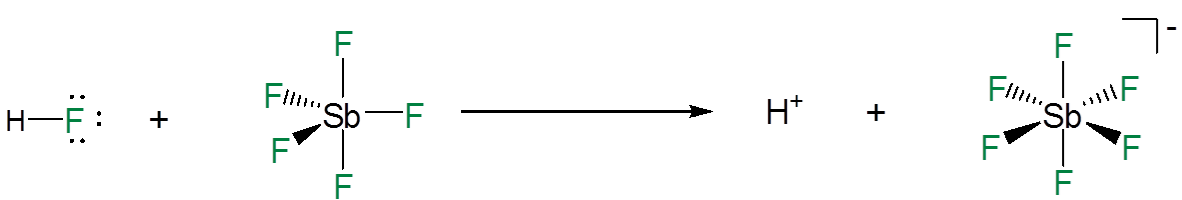
Esto da aniones extremadamente estables como\(\ce{SbF_6^{-}}\) y\(\ce{Sb_2F_{11}^{-}}\), en los que una sola carga negativa se deslocaliza entre muchos grupos electronegativos y átomos; de estos,\(CF_3\) y F son particularmente comunes.

Los superácidos son capaces de protonar especies que de otro modo actuarían como especies neutras o incluso ácidas en agua o medios apróticos. Los ácidos fosfórico, nítrico, carboxílico y otros ácidos ordinarios se protonan cuando se disuelven en superácidos:
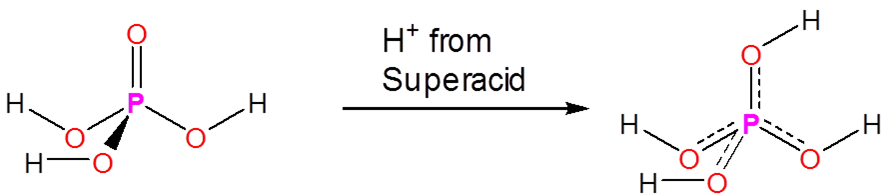
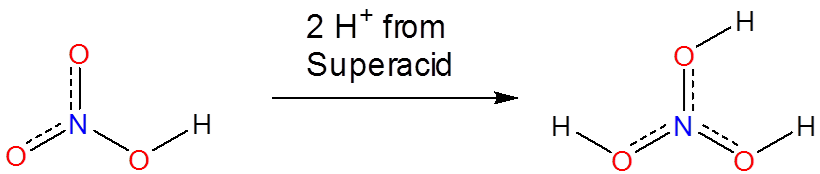
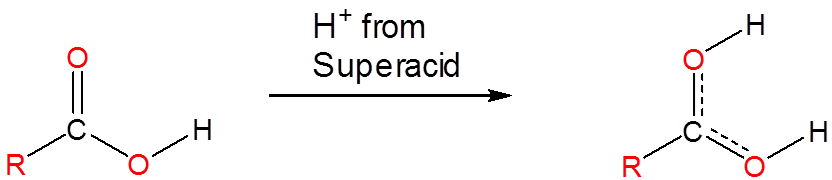
Sin embargo, los superácidos también protonan muchas especies que generalmente no se consideran que tengan propiedades ácido-base. Incluso los alcanos pueden protonarse y, de hecho, los superácidos se utilizan para generar carbocationes en una variedad de aplicaciones sintéticas. Lo hacen protonando alcanos para dar especies inestables que luego se descomponen en carbocationes en reacciones posteriores. Por ejemplo, mezclas de\(\ce{SbF_5}\) y\(\ce{FSO_3H}\) llamadas Magic Acid pueden incluso protonar metano, lo que da un\(\ce{CH_5^{+}}\) catión:
\[\ce{F_5Sb + FSO_3H + CH_4 -> F_5Sb-OSO_2F^{-} + CH_5^{+}} \nonumber \]
que posteriormente se descompone para dar un carbocatión ordinario
\[\ce{CH_5^{+} -> CH_3^{+} + H_2}\nonumber \]
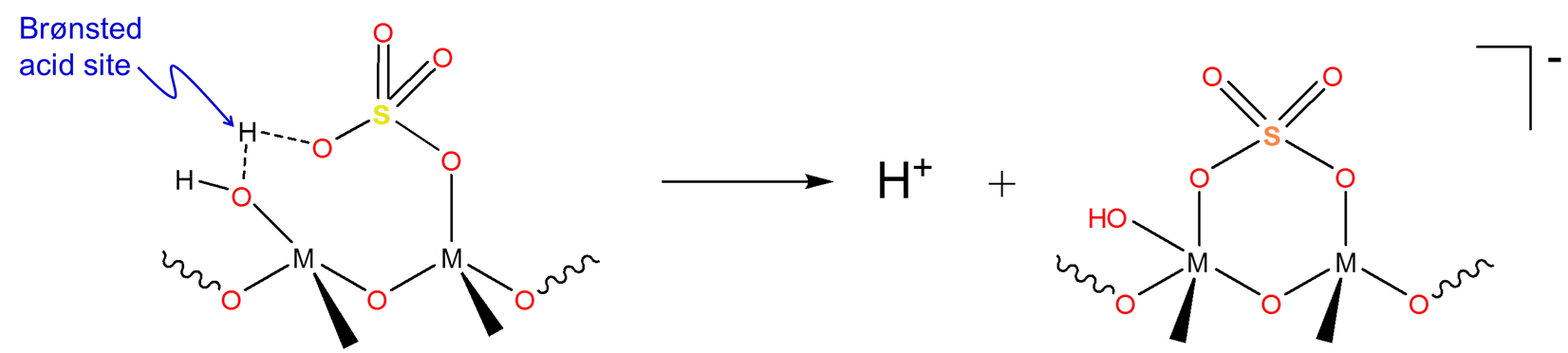
Dado que los superácidos líquidos son extremadamente corrosivos y pueden ser costosos de separar de las mezclas de reacción, los superácidos sólidos se utilizan industrialmente en su lugar. El uso principal de estos superácidos sólidos es generar carbocationes para su uso en la química de isomerización y alquilación de hidrocarburos. Muchos superácidos sólidos consisten en ácido sulfúrico/sulfatos unidos a una superficie de óxido metálico para dar estructuras similares a las que se muestran a continuación:
 \ []\
\ []\
Estas estructuras presentan parámetros de acidez de Hammett en el rango de superácidos. Sin embargo, el mecanismo por el cual estos superácidos sólidos generan carbocationes no está del todo claro ya que contienen sitios ácidos de Brønsted (en OH) y sitios ácidos de Lewis (en M) que podrían estar involucrados en el proceso de generación de carbocationes.
La función de acidez de Hammett
Las constantes de ionización ácida utilizadas típicamente para medir la acidez de los ácidos débiles solo son válidas en soluciones acuosas diluidas. Una medida más general de acidez que en principio es válida para cualquier ácido es la función de acidez de Hammett. La función de acidez de Hammett\(H_o\),, es análoga al pH utilizado para describir la acidez de soluciones acuosas pero en cambio se refiere al ácido puro:
\[pH = -\log(A_{\ce{H^{+}}}) \tag{for dilute aqueous solutions} \]
\[H_o = -\log (A_{\ce{H^{+}}}) \tag{for pure acids} \]
donde\(\ce{A_{H^{+}}}\) está la actividad de\(\ce{H^{+}}\), que en muchas soluciones diluidas es aproximadamente igual a la concentración de iones hidrógeno (es por eso que el pH a menudo se define en términos de [H +].
A primera vista puede parecer que la función de acidez de Hammett es simplemente una generalización del concepto de pH para su uso en soluciones no acuosas. Esto es especialmente así ya que en el agua el pH y\(H_o\) sí se refieren a la misma cantidad. Sin embargo, el ion hidrógeno de la función de acidez de Hammett es más que una generalización del concepto de pH. Su verdadero genio radica en que\(A_{H^+}\) no necesariamente representa una especie química real de identidad\(H^+\) sino más bien la capacidad de un ácido para protonar bases indicadoras débiles, B, específicamente a través de la reacción:
\[\ce{H^{+} + B <=> BH^{+}}\nonumber \]
Esta reacción da el ácido débil\(BH^+\) que puede ionizarse en la reacción que es la inversa de la anterior:
\[\ce{BH^{+} <=> B + H^{+}}\nonumber \]
El alcance de esta ionización dependerá de\(A_{H^+}\) según
\[K_{ion} = \dfrac{[\ce{BH^{+}}]}{A_{\ce{H^{+}}}[B]}\nonumber \]
Tomando el logaritmo negativo de ambos lados y reordenarlo da la ecuación de Henderson-Hasselbach para la base del indicador,\(\ce{B}\):
\[-K_{ion} = -\log{A_{\ce{H^{+}}}} -\log{\dfrac{[\ce{BH^{+}}]}{[\ce{B}]}}\nonumber \]
que se puede reorganizar para dar
\[pK_{ion} = H_o -\log{\dfrac{[\ce{BH^{+}}]}{[\ce{B}]}}\nonumber \]
o
\[H_o= pK_{ion} -\log{\dfrac{[\ce{BH^{+}}]}{[\ce{B}]}}\nonumber \]
De esto es evidente que\(H_o\) representa la capacidad de un ácido para donar un ión hidrógeno, medida en términos de su capacidad para desplazar el equilibrio entre\(\ce{B}\) y\(\ce{BH^{+}}\) hacia\(\ce{BH^{+}}\). Los valores más negativos\(H_o\) corresponden a ácidos Brønsted más fuertes con una mayor capacidad de transferencia de iones de hidrógeno, mientras que los menos negativos indican una acidez de Brønsted más débil.
El valor de\(H_o\) ha sido determinado experimentalmente para una serie de ácidos fuertes midiendo la relación de\(\ce{BH^{+}}\) al\(\ce{B}\) uso de aromáticos débilmente básicos como 2,4,6-trinitroanilina, diversos nitrotoluenos y trifluorometilbenceno como base indicadora, B. Algunos de estos acidez de Hammett los parámetros se muestran en la Tabla\(\PageIndex{1}\).
Como puede verse en la tabla\(\PageIndex{1}\), el ácido sulfúrico tiene una acidez de Hammett de -12. Dado que los superácidos se definen como ácidos con mayor acidez de Brønsted que el ácido sulfúrico puro esto significa que los superácidos tienen\((H_o<-12)\).
| Ácido | \(H_o\) |
|---|---|
| Ácido sulfúrico,\(H_2SO_4\) | \ (H_o\) ">-12 |
| Ácido perclórico,\(HClO_4\) | \ (H_o\) ">-13.0 |
| Ácido tríflico (ácido trifluorometanosulfónico),\(CF_3SO_3H\) | \ (H_o\) ">-14.6 |
| Ácido fluorosulfónico,\(FSO_3H\) | \ (H_o\) ">-15.6 |
| Ácido Mágico,\(F_5Sb---FSO_3H\) | \ (H_o\) ">-24 a -21\(^a\) |
| Ácido fluoroantimónico,\(SbF_5---FH\) | \ (H_o\) ">-24 a -21\(^{a,b}\) |
a. Difícil de estimar de manera confiable.
b. Depende de la\(FSO_3H\) relación\(SF_5\) a.
Referencias
- Gillespie, R. J.; T. E. Peel, T. E.; Robinson, E.A. J. Am. Chem. Soc. 1971, 93 (20), 5083-5087.
- Gillespie, R. J.; T. E. Peel, T. E. J. Am. Chem. Soc., 1973, 95 (16), 5173-5178.3.
- Olah, George A. Química superácida, 2a ed. Hoboken, N.J.: Wiley. 2009.

