6.4.1: El enfoque orbital fronterizo considera las reacciones ácido-base de Lewis en términos de la donación de electrones desde el orbital ocupado más alto de la base hacia el orbital desocupado más bajo del ácido.
- Page ID
- 81303
Otra forma en que el concepto de base Lewis-Acid se emplea ampliamente para comprender la reactividad química es a través del enfoque orbital fronterizo de las reacciones químicas. El concepto orbital fronterizo conceptualiza el enlace químico y la reactividad en términos de las interacciones entre orbitales fronterizos en las especies químicas que experimentan una interacción (por ejemplo, moléculas, átomos, iones o grupos a medida que interactúan para formar un enlace o sufrir una reacción). Los orbitales fronterizos son los que se encuentran en la frontera entre ocupados y desocupados. A menudo se toman como la energía más alta o ccupied y l owest energy u orbitales moleculares noccupied, llamados los niveles HOMO y LUMO. Sin embargo, a veces puede ser más conveniente pensarlos como orbitales atómicos o orbitales derivados del enfoque de Valence Bond. Al desarrollar descripciones orbitales fronterizas cualitativas aproximadas de las interacciones orbitales involucradas en un sistema dado, la elección de qué tipos de orbitales usar suele ser cuestión de cuál es el más informativo y conveniente.
En particular, el concepto orbital fronterizo prevé una interacción ácido-base de Lewis como una interacción entre algunos de los orbitales fronterizos del ácido y la base de Lewis, específicamente la donación de electrones desde el nivel HOMO de la base al nivel LUMO del ácido. Por ejemplo, en la aproximación orbital fronteriza, la formación de aductos entre\(NH_3\) e\(BH_3\) implica la donación de electrones de un 1 HOMO de amoníaco a BH 3 es un nivel LUMO de 2”.
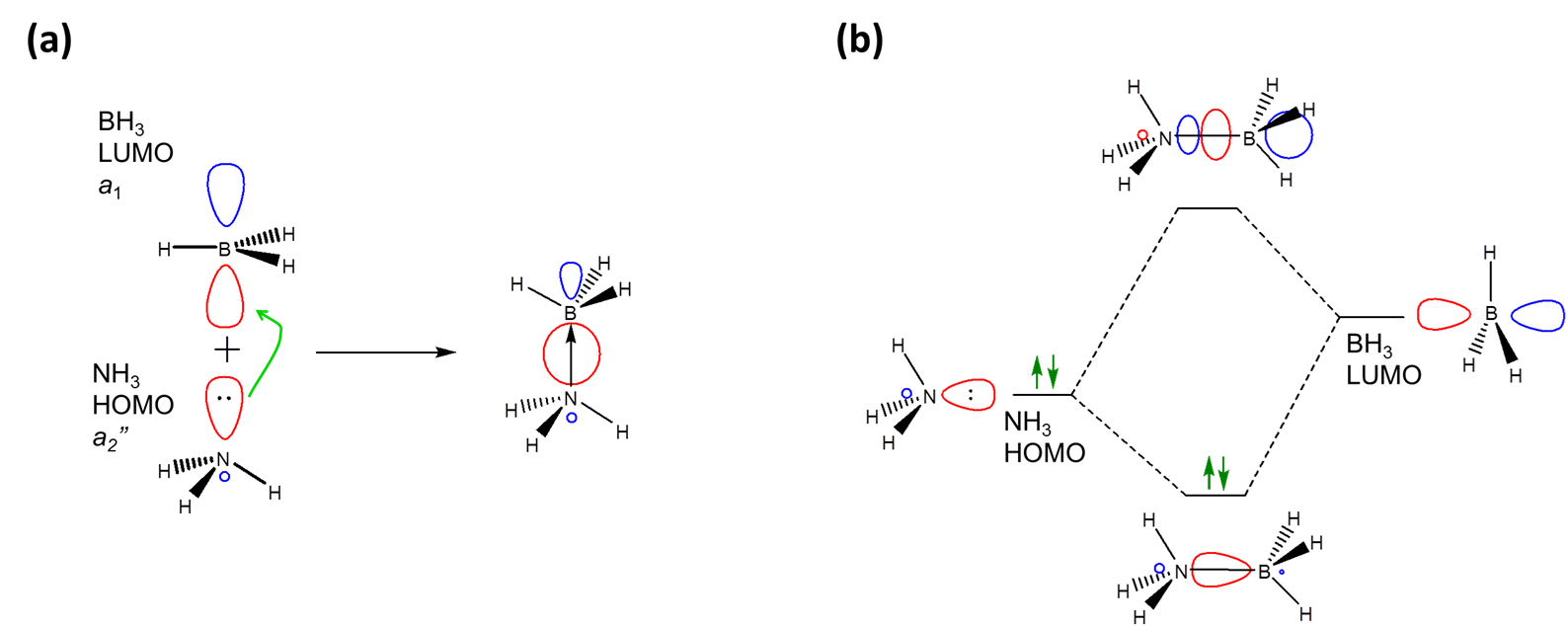
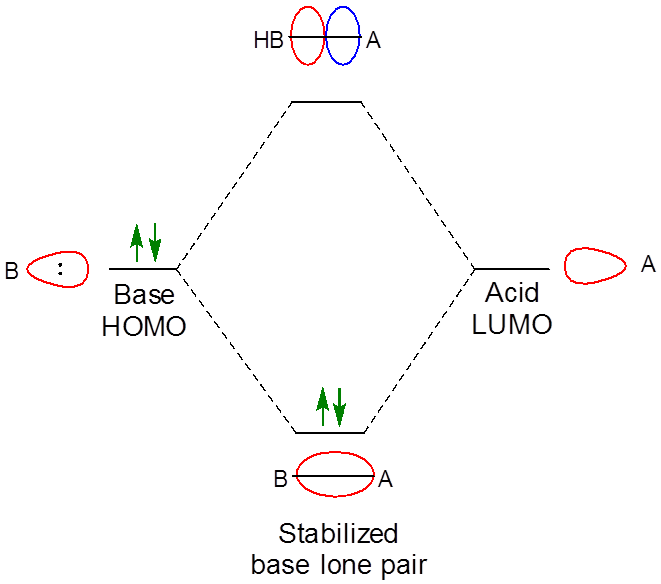
Como era de esperar cuando se combinan dos orbitales de la simetría apropiada, el resultado de la interacción es la formación de un orbital de unión de menor energía entre el ácido y la base (Figura\( \PageIndex{1}\)). Dado que está ocupada por un electrón, el resultado neto de la interacción es la disminución de la energía de pares solitarios de la base ya que interactúa con el ácido de Lewis. En este caso, la interacción solo sigue el patrón general para la formación de aductos de base Lewis-Acid, que es:
El concepto orbital fronterizo ilumina las interacciones orbitales involucradas en las reacciones. Por ejemplo, desde una perspectiva orbital fronteriza, la reacción de sustitución de haluro de alquilo entre hidróxido y CH 3 Cl a través del mecanismo S N 2 implica una interacción ácido-base de Lewis:
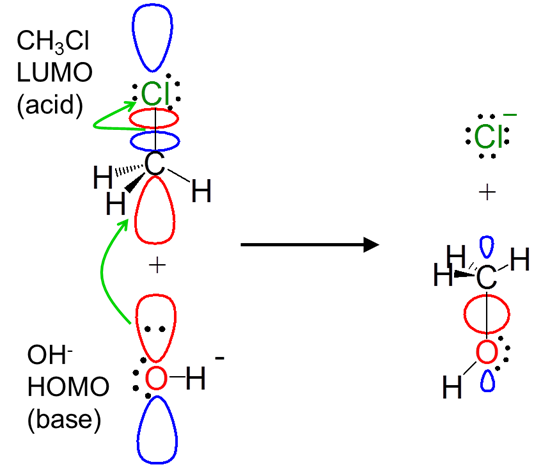
Observe cómo la aproximación orbital fronteriza incluso explica el desplazamiento del grupo de salida de cloruro. La donación de electrones del hidróxido HOMO puebla el antienlace CH 3 Cl LUMO, rompiendo el enlace C-Cl.
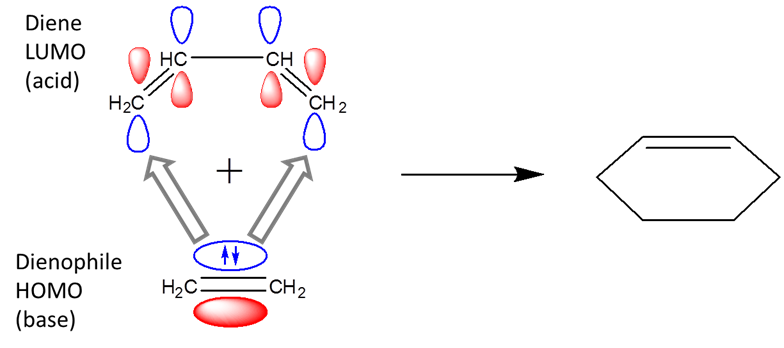
Con la aproximación orbital fronteriza, se hace evidente que las reacciones pericílicas son reacciones ácido-base de Lewis. Por ejemplo, en la reacción de Diels-Alder, el dienófilo actúa como una base de Lewis y el dieno como un ácido de Lewis.
Las interacciones orbitales involucradas en una reacción dada pueden incluir tanto reactivos que actúan como ácido como base. En estos casos el HOMO de cada reactivo interactúa con el LUMO del otro. Un buen ejemplo de esto implica interacciones de\( \Pi \) tipo entre un ión metálico con orbitales d ocupados y un ligando aceptor pi-aceptor. El ligando actúa como una base y el metal como un ácido para dar un enlace sencillo M-CO:
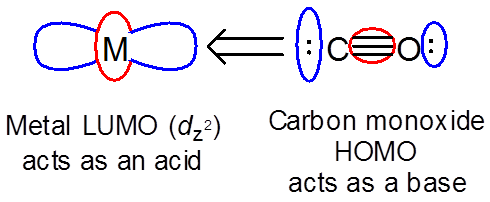
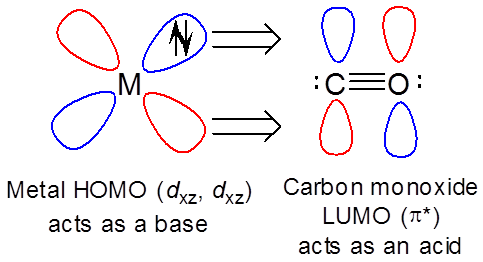
Sin embargo, el metal también puede actuar como base hacia el ligando LUMO (\( \pi ^*\)) orbitales.
El concepto orbital fronterizo también se puede utilizar para describir las interacciones entre uno o más orbitales fronterizos ocupados individualmente. De hecho, cuando se construyen diagramas orbitales moleculares aproximados, a menudo puede ser útil enfocarse en una o dos interacciones particularmente instructivas. En estos casos, a veces es conveniente pensar en un enlace químico que implica la formación de interacciones de unión y antiunión entre orbitales fronterizos ocupados individualmente en diferentes fragmentos moleculares. Por ejemplo, cuando se piensa en la química del\(CH_3Re(CO)_5\) mismo a veces puede ser útil pensar en el enlace C-Re como derivado de la interacción entre un orbital de tipo sp 3 solo ocupado en un grupo CH 3 y un d 2 ocupado individualmente sp 3 orbital en el Re.
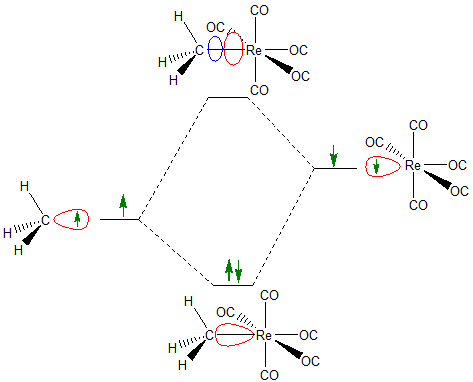
Al introducir orbitales ocupados individualmente, el concepto orbital fronterizo maneja formalmente interacciones que el concepto ácido-base de Lewis no hace, ya que el comportamiento ácido-base de Lewis se limita formalmente a la aceptación y donación de pares de electrones.

