6.4: Concepto Lewis y Orbitales Fronterizos
- Page ID
- 81273
El concepto ácido-base de Lewis generaliza los conceptos de Brønsted y del sistema solvente ácido-base al describir las reacciones ácido-base en términos de la donación y aceptación de un par de electrones.
Bajo la definición de Lewis
- Los ácidos de Lewis son aceptores de pares de electrones
- Las bases de Lewis son donantes de pares de electrones
y en reacciones ácido-base de Lewis, una base de Lewis dona un par de electrones al ácido de Lewis, que lo acepta. La reacción entre borano,\(BH_3\), y\(NH_3\) es el ejemplo clásico:
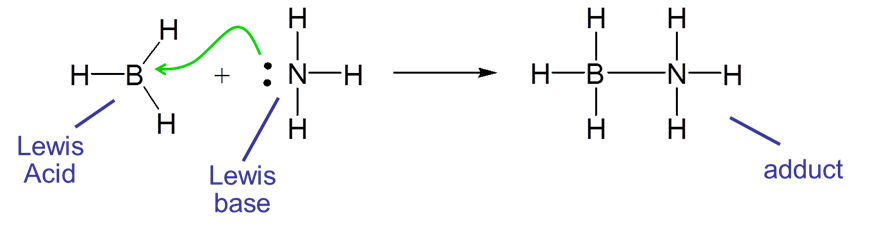
En este caso la reacción ácido-base de Lewis da como resultado la formación de un enlace entre\(BH_3\), y\(NH_3\). Cuando el ácido y la base se combinan para formar una unidad mayor, se dice que esa unidad es un aducto, y el enlace resultante se dice que es un enlace covalente o dativo coordinado. Dichos enlaces covalentes coordinados a menudo están representados por una flecha que indica la dirección de la donación de electrones desde la base hasta el ácido. Por ejemplo, la reacción entre\(BH_3\) y también\(NH_3\) podría haberse escrito como
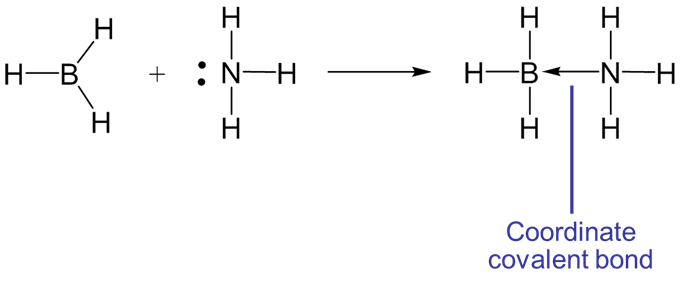
La notación de flecha para el enlace covalente coordinado es realmente solo un formalismo conveniente, una herramienta de contabilidad para ayudar a realizar un seguimiento de dónde provienen los electrones y de dónde podrían regresar si ocurre la reacción inversa. En la actualidad, un enlace covalente coordinado es solo un enlace covalente ordinario como cualquier otro.
Por ejemplo, en las reacciones ácido-base de Brønsted, el ión hidrógeno es un ácido porque acepta un par de electrones de la base de Brønsted. En consecuencia, bajo el concepto ácido-base de Lewis, las reacciones ácido-base de Brønsted implican la formación de un aducto entre\(H^+\) y una base.
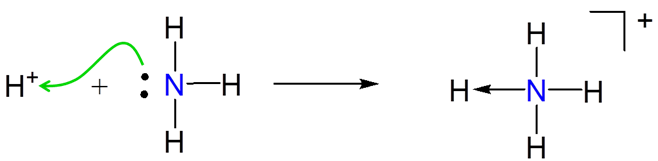 \[ \nonumber \]
\[ \nonumber \]
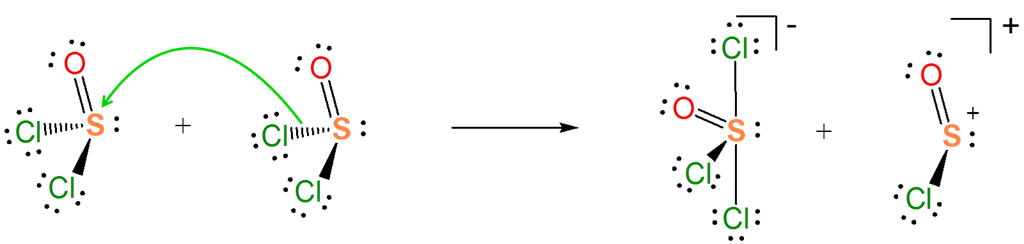
El concepto ácido-base de Lewis explica muy bien las reacciones de ionización que involucran solventes no acuosos. Por ejemplo, la autoionización de\(SOCl_2\) es una reacción ácido-base entre dos\(SOCl_2\) moléculas.
 \[ \nonumber \]
\[ \nonumber \]
Explicar cómo la autoionización de\(SOCl_2\) es una reacción de desplazamiento ácido-base de Lewis.
Solución
En la autoionización\(SOCl_2\) del par de electrones donados proviene del enlace S-Cl, y el enlace S-Cl se rompe para dar un par solitario que lleva una\(Cl^-\) base y un fragmento de ácido de\(SOCl^+\) Lewis. Si estás teniendo problemas para ver cómo funciona esto, puede ser instructivo considerar lo contrario de este proceso. Es una reacción ácido-base de Lewis para dar un aducto ácido-base de Lewis:
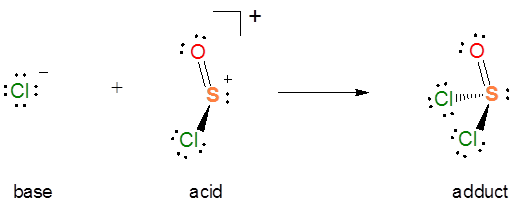
De la reacción de autoionización también es evidente que\(SOCl_2\) en sí mismo actúa como un ácido de Lewis hacia los liberados\(Cl^-\). Por lo que la reacción de autoionización implica una transferencia de la\(Cl^-\) base entre los dos ácidos de Lewis, una reacción de desplazamiento ácido-base de Lewis.
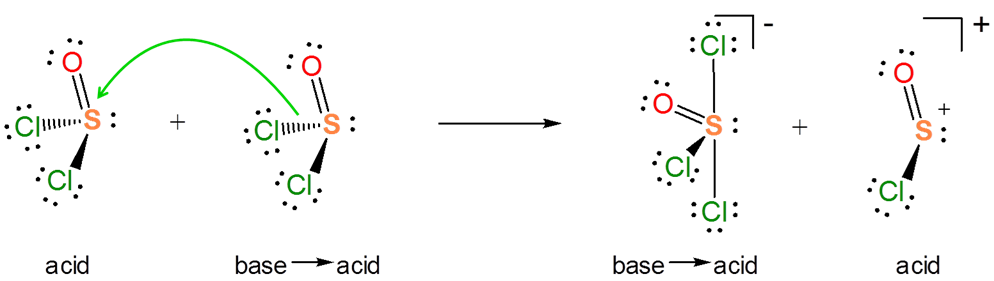
Puede ser útil tener en cuenta varias distinciones al usar el concepto ácido-base de Lewis para describir reacciones químicas.
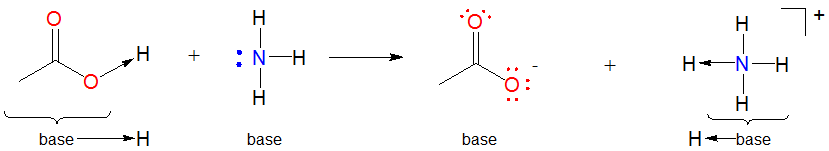
1. Muchas reacciones de base de Lewis-ácido son reacciones de desplazamiento. Esto se debe a que el ión hidrógeno suele estar ligado a algo al inicio de la reacción. En tales casos la\(H^+\) unidad de ácido de Lewis se transfiere de una base de Lewis a otra:
 \[ \nonumber \]
\[ \nonumber \]
Tales reacciones ácido-base a veces se denominan reacciones de desplazamiento ya que el grupo base en el complejo ácido-base de Lewis inicial es desplazado por la base de Lewis entrante para generar otro complejo.
2. Las sustancias a veces se consideran anfóteras porque presentan acidez y basicidad de Lewis en diferentes tipos de centros atómicos. El ejemplo clásico es el hidróxido de aluminio,\(\ce{Al(OH)3}\). En el agua\(\ce{Al(OH)3}\) puede actuar como un ácido de Lewis hacia OH - ion. La reacción se produce por formación de un aducto en\(\ce{Al(OH)3}\) el centro de Al 3 +:
\[\ce{Al(OH)3 + OH^{-} \rightarrow Al(OH)4^{-}} \nonumber \]
Observe que además de actuar como un ácido de Lewis, en esta reacción\(Al(OH)_3\)
- no actúa como ácido o base de Brønsted ya que no se produce transferencia de iones H +
- pero sí actúa como un ácido de Arrhenius ya que el ion OH - se consume de la solución, disminuyendo [OH -] y aumentando [H +]
En el agua\(\ce{Al(OH)_3}\) también actúa como una base de Lewis hacia H + a través de los pares solitarios en sus ligandos de hidróxido.
\[\ce{Al(OH)3 + 3 H^{+} + 3 H2O \rightarrow Al(H2O)6^{3+}} \nonumber \]
Observe que además de actuar como base de Lewis, en esta reacción\(\ce{Al(OH)3}\) también actúa como
- Base Brønsted, ya que un ion H + se transfiere al ligando OH -
- Arrhenius base, ya que el ion H + se consume de la solución, disminuyendo [H +]
- Ácido de Lewis en su centro Al 3 +, ya que se forman enlaces metal-ligando Al-O
Las sustancias que experimentan rápidamente reacciones ácido-base de Lewis se llaman nucleófilos y electrófilos.
Dos factores gobiernan el curso de las reacciones químicas: la termodinámica y la cinética. La termodinámica determina qué posibles destino de la reacción puede tener lugar, mientras que la cinética determina cuál de esos posibles destino se llevará a cabo rápidamente bajo un conjunto particular de condiciones de reacción. Debido a esto, puede ser útil distinguir los ácidos y bases de Lewis que tienden a reaccionar rápidamente entre sí de aquellos que lo hacen más lentamente. Por esta razón, los químicos sintéticos utilizan los términos electrófilo y nucleófilo para referirse a ácidos y bases de Lewis que reaccionan rápidamente:
- electrófilo - Se dice que los ácidos de Lewis que reaccionan rápidamente con una base de Lewis dada o clase de bases de Lewis son buenos electrófilos
- nucleófilo - Se dice que las bases de Lewis que reaccionan rápidamente con un ácido de Lewis dado o una clase de ácidos de Lewis son buenos nucleófilos
El concepto electrófilo-nucleófilo a veces se conoce como el concepto ácido-base de Ingold Robinson después de dos químicos orgánicos que hicieron mucho para ilustrar la utilidad de pensar en las reacciones ácido-base de Lewis en términos cinéticos.
Varias distinciones que deben tenerse en cuenta al usar el concepto electrófilo-nucleófilo/INGOD-Robinson para pensar en la reactividad química:
1. El hecho de que un ácido o base de Lewis determinado pueda reaccionar rápidamente depende de las condiciones de reacción y del sustrato (sustancia con la que está reaccionando). Esto quiere decir que en principio, los términos nucleófilo y electrófilo no deben utilizarse sin calificar adecuadamente hacia qué actúan las sustancias como nucleófilo o electrófilo y bajo qué condiciones. Desafortunadamente esto rara vez se hace. En tales casos, las condiciones y el sustrato deben inferirse del contexto. Por ejemplo, cuando aprendiste que el ion cloruro es un buen nucleófilo al estudiar química orgánica, lo que se quiso decir es que el cloruro es un buen nucleófilo hacia los átomos de carbono electrófilos en las moléculas orgánicas.
2. La fuerza ácida y base y la electrofilicidad-nucleofilia no son exactamente lo mismo. En muchos contextos donde los ácidos y bases de Lewis se clasifican como sustancias electrofílicas y nucleofílicas, es común referirse también a las sustancias como buenos ácidos o bases en función de su acidez y basicidad de Brønsted. En estos contextos, los términos ácido y base típicamente se refieren a la propensión termodinámica de una sustancia a dar y aceptar iones de hidrógeno, mientras que los términos nucleófilo y electrófilo se refieren a la propensión cinética de una sustancia a reaccionar con ácidos y bases de Lewis basados en carbono, respectivamente.
Una sustancia puede ser tanto un buen nucleófilo como una base fuerte de Brønsted. Por ejemplo, los reactivos de carbanión de alquillitio y los hidruros de metales alcalinos son bases fuertes y buenos nucleófilos hacia átomos de carbono electrófilos en solventes orgánicos a temperaturas moderadas. No obstante, no siempre es así. En tales condiciones el ion yoduro\(I^-\),, es un buen nucleófilo hacia los átomos de carbono electrófilos pero es una base pobre de Brønsted (es el conjugado del ácido fuerte HI). De hecho, para los iones haluro el orden de basicidad de Brønsted es el opuesto al orden de nucleofilia hacia el carbono electrófilo:
base Brønsted más fuerte:\(F^-\),\(Cl^-\),\(Br^-\),\(I^-\): base Brønsted más débil
mejor nucleófilo:\(I^-\)\(Br^-\),\(Cl^-\),,\(F^-\): nucleófilo más pobre
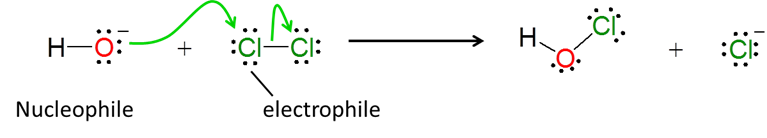
3. Aunque el concepto nucleófilo-electrófilo se usa con mayor frecuencia para describir reacciones orgánicas, también es útil para describir reacciones inorgánicas. Por ejemplo, la formación de ion hipoclorito en agua de cloro posiblemente implica el ataque nucleófilo de hidróxido sobre un átomo de cloro electrófilo en un proceso de tipo S N 2:
 \[ \nonumber \]
\[ \nonumber \]
El concepto ácido-base de Usanovich abarca una gama más amplia de reacciones que el concepto ácido-base de Lewis, pero quizás sea demasiado general para servir como marco conveniente para comprender la química de las reacciones. El concepto ácido-base de Usanovich fue desarrollado por el químico ruso Mikhail Usanovich y amplía aún más la definición del concepto ácido-base de Lewis de ácidos y bases como donantes y aceptores de pares de electrones. Dentro de la definición de Usanovich:
- Los ácidos son cualquier cosa que acepta electrones, aumenta las concentraciones de cationes, disminuye las concentraciones de aniones o reacciona con bases
- Las bases son cualquier cosa que dona electrones, aumenta las concentraciones de aniones, disminuye las concentraciones de cationes o reacciona con ácidos
Estas definiciones esencialmente expanden la definición de Lewis al eliminar el requisito de que los electrones donados o aceptados sean un par y prácticamente significan que las reacciones ácido-base de Usanovich incluyen reacciones ácido-base de Lewis más reacciones de oxidación-reducción. En otras palabras:
- Los ácidos de Usanovich son ácidos de Lewis más oxidantes
- Las bases de Usanovich son bases Lewis más reductores
Bajo esta definición\(BF_3\),\(Fe^{3+}\), y\([Fe(CN)_6]^{3-}\) todos actúan como ácidos, y\(:NH_3\)\(CN^-\), y Zn son todas bases:
\[\underset{\textcolor{red}{acid}}{BF_3} + \underset{\textcolor{blue}{base}}{NH_3} → F_3B-NH_3 \nonumber \]
\[\underset{\textcolor{red}{acid}}{Fe^{3+}} + 6 \underset{\textcolor{blue}{base}}{CN:^-} → [Fe(CN)_6]^{3-} \nonumber \]
\[2\underset{\textcolor{red}{acid}}{[Fe(CN)_6]^{3-}} + \underset{\textcolor{blue}{base}}{Zn} → 2[Fe(CN)_6]^{3-} + Zn^{2+} \nonumber \]
Sin embargo, observe que si bien es fácil pensar en cómo cualquier ácido podría reaccionar indistintamente con una base dada (y viceversa), bajo los otros conceptos ácido-base los químicos han encontrado más difícil pensar en reacciones entre oxidantes/reductores y ácidos y bases de Lewis. Por ejemplo, es difícil pensar en cómo podría ocurrir una reacción entre\(BF_3\) y Zn metal. ¿Dos Zn donarían un par de electrones a la\(BF_3\)? Por esta razón, a la mayoría de los químicos les resulta más conveniente pensar en las reacciones ácido-base y redox de Lewis bajo categorías separadas en lugar de unirlas bajo la definición de Usanovich.
\[2\underset{\textcolor{red}{oxidant}}{[Fe(CN)_6]^{3-}} + \underset{\textcolor{blue}{reductant}}{Zn} → 2[Fe(CN)_6]^{3-} + Zn^{2+} \nonumber \]
Nuevamente, puede ser útil recordar el dictum de Huheey de que decidir entre conceptos ácido-base no es cuestión de qué concepto es el más correcto sino de cuál es más conveniente para una aplicación determinada.

