6.4.2: Siendo iguales todas las demás cosas, los grupos extractores de electrones tienden a hacer que los ácidos de Lewis sean más fuertes y las bases más débiles, mientras que los grupos donantes de electrones tienden a hacer las bases de Lewis más fuertes
- Page ID
- 81280
Los electrones donados de una base de Lewis a un ácido de Lewis en una reacción ácido-base de Lewis son donados y aceptados en centros atómicos particulares. Por ejemplo, la formación de un aducto entre amoníaco y BF 3 implica la donación del par solitario en el átomo de nitrógeno amoniacal al sitio ácido de Lewis en BF 3.
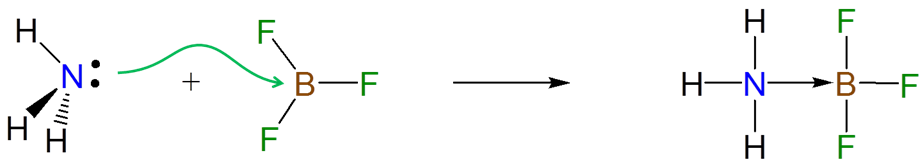
Debido a que las reacciones ácido-base de Lewis implican la donación y aceptación de electrones en sitios particulares, los grupos sustituyentes que alteran la densidad de electrones en un sitio mediante la donación o extracción inductiva de la densidad electrónica afectarán las propiedades ácido-base de Lewis de ese sitio. Por ejemplo, las afinidades BF 3 de las piridinas 4-sustituidas aumentan ligeramente a medida que el sustituyente en el anillo aromático cambia de Me donador de electrones a CF 3 aceptor de electrones.
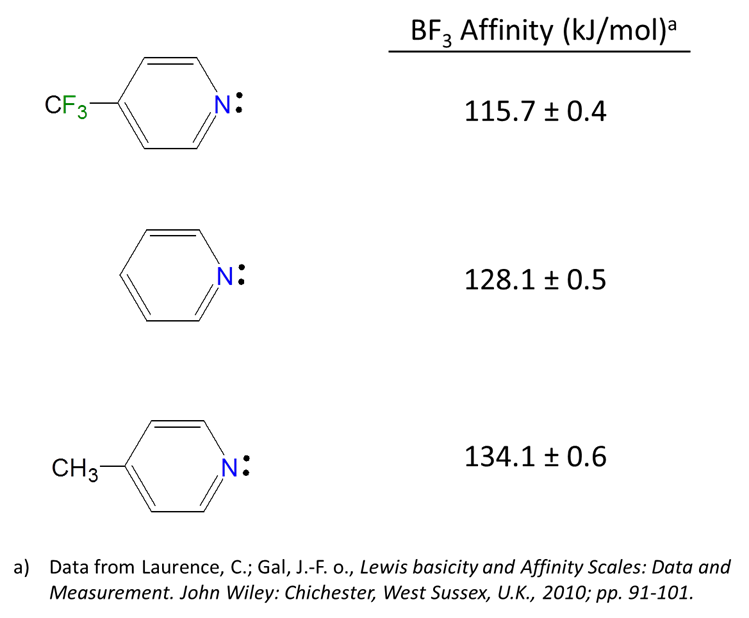
Los efectos inductivos de los sustituyentes son mucho como se podría predecir. Dado que las bases Lewis donan pares de electrones y los ácidos de Lewis los aceptan:
- Los sustituyentes aceptores de electrones tienden a disminuir la basicidad de Lewis de los sitios básicos, mientras que los sustituyentes donadores de electrones aumentan la basicidad de Lewis del sitio haciéndolos más ricos en electrones.
- Los sustituyentes aceptores de electrones aumentan la acidez de Lewis de los sitios ácidos al hacer que esos sitios sean más deficientes en electrones, mientras que los sustituyentes donadores de electrones tienden a disminuir la acidez de Lewis al hacer que los sitios sean
Sin embargo, puede ser difícil predecir tendencias basadas en sustituyentes en la acidez y basicidad de Lewis solo por efectos inductivos. Esto se debe a que los efectos inductivos son modestos y a menudo existen en competencia con otros efectos sustituyentes, como
- Efectos estéricos, discutidos en la sección 6.4.7
- Efectos de dureza, discutidos en la sección 6.6
- \(\pi\)-efectos de donación y aceptación, que pueden aumentar o disminuir la densidad de electrones en un sitio dado, así como crear una barrera energética para cualquier distorsión estructural que pueda ocurrir en la formación del aducto.
Al igual que con los efectos de inducción\(\sigma\) basados, la\(\pi\) donación tiende a aumentar la basicidad de Lewis y disminuir la acidez de Lewis, mientras que la\(\pi\) abstinencia tiende a disminuir la basicidad de Lewis y aumentar la acidez Sin embargo, se debe tener cuidado al evaluar el efecto de los efectos\(\pi\) de la donación en la acidez y basicidad de Lewis. Por ejemplo, algunos libros de texto afirman que la acidez de Lewis de los trihaluros de boro está dominada por la reducción de la acidez del boro a través\(\pi\) de la donación de los sustituyentes haluro:
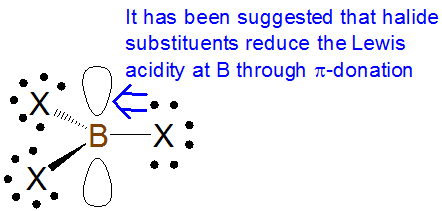
Según esta explicación, el alcance de esta\(\pi\) donación disminuye en el grupo halógeno a medida que disminuye la distancia de enlace boro-halógeno. Esto es consistente con la tendencia observada en la acidez de Lewis de los trihaluros de boro hacia la mayoría de las bases, lo que va en contra de lo sugerido por los efectos inductivos solos:
BI 3 > BBr 3 > BCl 3 >> BF 3
Sin embargo, el trabajo computacional sugiere que esta explicación es incorrecta, ya que
- los efectos del tamaño atómico son importantes principalmente para los sustituyentes en los que el átomo conectado está en la fila 3+ o superior;
- los efectos de tamaño atómico implican principalmente cambios en la extensión de\(\sigma\) -superposición. En otras palabras, los halógenos más grandes son menos capaces de reducir la deficiencia de electrones en el centro del boro a través de\(\sigma\) interacciones, mientras que\(\pi\) las interacciones juegan poco o ningún papel.

Referencias:
1. Plumley, J. A.; Evanseck, J. D., Tendencias periódicas e índice de acidez de boro Lewis. La Revista de Química Física A 2009, 113 (20), 5985-5992.
2. Jupp, A. R.; Johnstone, T. C.; Stephan, D. W., Mejorando el Índice Global de Electrofilicidad (GEI) como Medida de la Acidez de Lewis. Química Inorgánica 2018, 57 (23), 14764-14771.
La no reactividad de las bases conjugadas de los superácidos de Brønsted hacia los iones de hidrógeno a menudo se refleja en la no reactividad hacia otros ácidos de Lewis o electrófilos, sobre todo los metales. Esto hace que estas sustancias sean útiles como iones inertes o no coordinantes, aunque como todas son reactivas hacia centros adecuadamente electrófilos, quizás se entiendan mejor como débilmente coordinantes.
Una serie de aniones no coordinantes se utilizan comúnmente en aplicaciones sintéticas y de otro tipo. La base conjugada del ácido perclórico, el perclorato, fue un anión inerte no coordinante común en la química clásica de coordinación y continúa siendo ampliamente utilizada en electroquímica. Por el contrario, las bases conjugadas de ácido tríflico, ácido hexafluorobórico y ácido tetrafluorobórico se utilizan ahora más comúnmente como contraiones para aislar cationes reactivos.
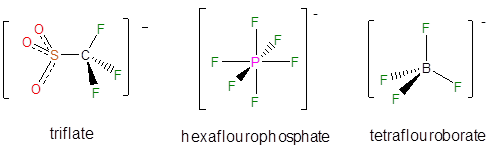
Los aniones de no coordinación aún menos reactivos incluyen derivados de tetrafenilborato, particularmente aquellos con sustituyentes aceptores de electrones.
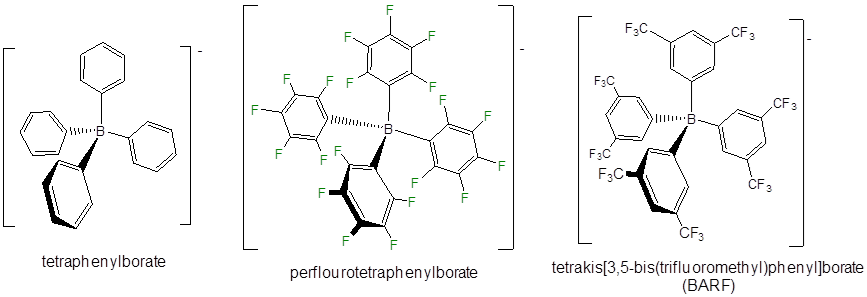
Otras clases de iones no coordinantes incluyen grupos de fluoroantimoniatos, derivados del anión carborano (\(CB_{11}H_{11}^-\)) y tetraalcóxidos de aluminio fluorado.
Referencias
Engesser, T. A.; Lichtenthaler, M. R.; Schleep, M.; Krossing, I., Cationes de bloque p reactivos estabilizados por aniones débilmente coordinantes. Chemical Society opiniones 2016, 45 (4), 789-899.

