6.4.3: Los espectros electrónicos de los complejos de transferencia de carga ilustran el impacto de las interacciones orbitales fronterizas en la estructura electrónica de los aductos ácido-base de Lewis
- Page ID
- 81290
Cuando se forma un aducto ácido-base de Lewis, la densidad electrónica y la carga negativa se transfieren de la base de Lewis al ácido.
La formación de un complejo Lewis-ácido base implica la transferencia de densidad electrónica de la base al ácido.
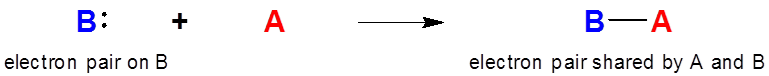 \[ \nonumber \]
\[ \nonumber \]
 \[ \nonumber \]
\[ \nonumber \]
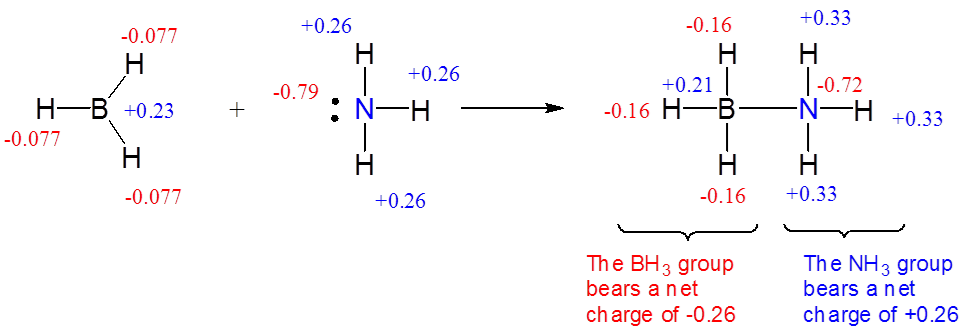
Los aductos ácido-base de Lewis débilmente unidos en los que la carga se transfiere de forma incompleta se denominan complejos de transferencia de carga.
En muchos complejos ácido-base de Lewis débilmente unidos, la transferencia de la densidad electrónica y, en consecuencia, la carga del grupo base al grupo ácido es solo parcial:
\[A~+~B~\rightleftharpoons~A^{\delta-}B^{\delta+} \nonumber \]
Dichos aductos ácido-base de Lewis se denominan comúnmente complejos de transferencia de carga (complejos CT) o complejos donador-aceptor (complejos DA). En estos
- la base se llama el donante (D) ya que es un donador neto de electrones y, en consecuencia, su carga negativa
- el ácido se llama el aceptor (A) ya que es un aceptor neto de electrones y, en consecuencia, su carga negativa
Una clase particularmente bien conocida de complejos de transferencia de carga son los complejos de transferencia de carga de yodo. En los complejos de transferencia de carga de yodo el\(I_2\) actúa como un ácido de Lewis. Esto es posible ya que el yodo es un elemento Row 3+ y por lo tanto es capaz de formar complejos hipervalentes al reaccionar con una base de Lewis. Por ejemplo,\(I_2\) reacciona con\(I^-\) para dar el ion triyoduro.
 \[ \nonumber \]
\[ \nonumber \]
El triyoduro es bien conocido por la química introductoria por el color azul brillante que aparece cuando el triyoduro se compleja con almidón para dar el complejo almidón-yoduro azul oscuro.
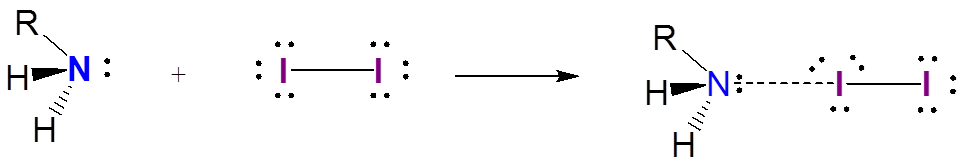
A diferencia del anión triyoduro estable, los complejos de transferencia de carga de yodo solo están débilmente asociados. Los complejos entre yodo y aminas son un ejemplo bien conocido:
 \[ \nonumber \]
\[ \nonumber \]
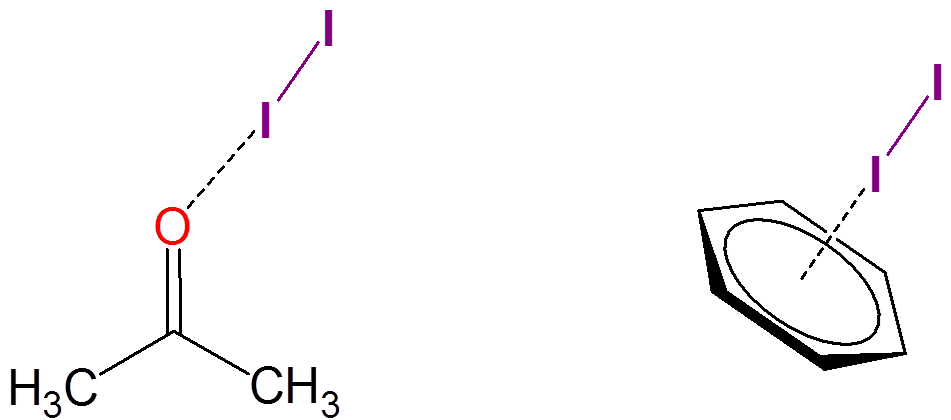
El yodo también forma complejos de transferencia de carga débilmente asociados con muchos solventes. Por ejemplo, el yodo puede asociarse débilmente tanto con acetona como con benceno:
Vale la pena señalar de pasada que se han desarrollado varios sistemas complejos de transferencia de carga orgánica en los que los donantes y aceptores de electrones orgánicos se asocian débilmente entre sí. Estos son de considerable interés para su uso en aplicaciones de electrónica molecular, y como resultado, se han desarrollado una gran variedad de donantes y aceptores de electrones orgánicos. Un ejemplo de un aceptor de electrones orgánico es el tetracianoetileno (TCNE):
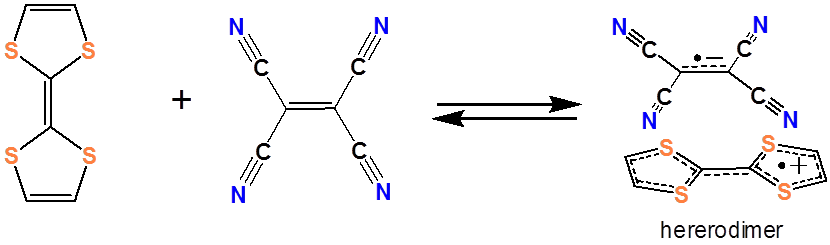
y un ejemplo de aceptor de electrones orgánico es el tetratiofulvaleno (TTF).
Juntos forman un complejo de transferencia de cargos:
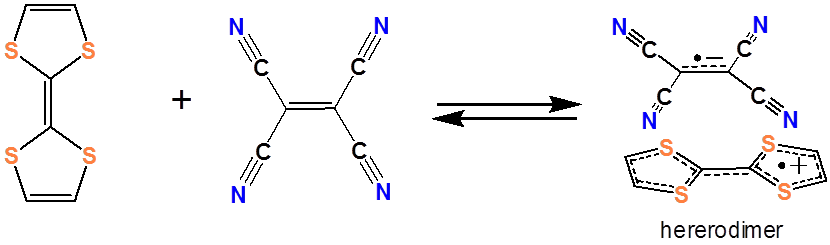
Se han investigado sistemas similares de transferencia de carga orgánica para su uso en células fotovoltaicas orgánicas. Existe un interés considerable en desarrollar tales dispositivos fotovoltaicos orgánicos debido a la facilidad con que los materiales orgánicos pueden fabricarse a partir de soluciones y suspensiones orgánicas.
Los complejos de transferencia de carga exhiben transiciones de transferencia de carga en las que la absorción desencadena la transferencia de un electrón desde el donante al aceptor.
Cuando el yodo se disuelve en soluciones de disolventes donantes, el llamativo color púrpura del yodo molecular se reemplaza por un color amarillo-marrón. Esto se debe a que los complejos de transferencia de carga como los formados por\(I_2\) pueden absorber la luz de formas que ni el donante ni el aceptor pueden por sí solos. Específicamente, los complejos de transferencia de carga exhiben bandas de transferencia de carga (bandas CT) en sus espectros de absorción. En la transición de transferencia de carga, la transferencia parcial inicial de carga desde la base de Lewis donadora al ácido aceptor de Lewis en el complejo de transferencia de carga es empujada aún más por fotoexcitación.
\[D^{\delta+}-A^{\delta-}~\overset{h\nu_{CT}}{~\longrightarrow}~D^+-A^- \nonumber \]
La naturaleza de estas transiciones de transferencia de carga se ve a partir de la descripción orbital de la unión para complejos de transferencia de carga de yodo. Cuando se forma un complejo Donor-I 2, la formación de orbitales de enlace y antienlace Donor-I 2 da como resultado un cambio en la\(I2 \sigma \rightarrow \sigma*\) transición a mayor energía, ya que se forma una nueva banda de transferencia de carga, asociada con la excitación de un electrón de la amina-I en gran parte centrada en amina 2\(\sigma \) orbital a la\(\sigma *\) orbital en gran parte I 2 -centrada amina-I 2.
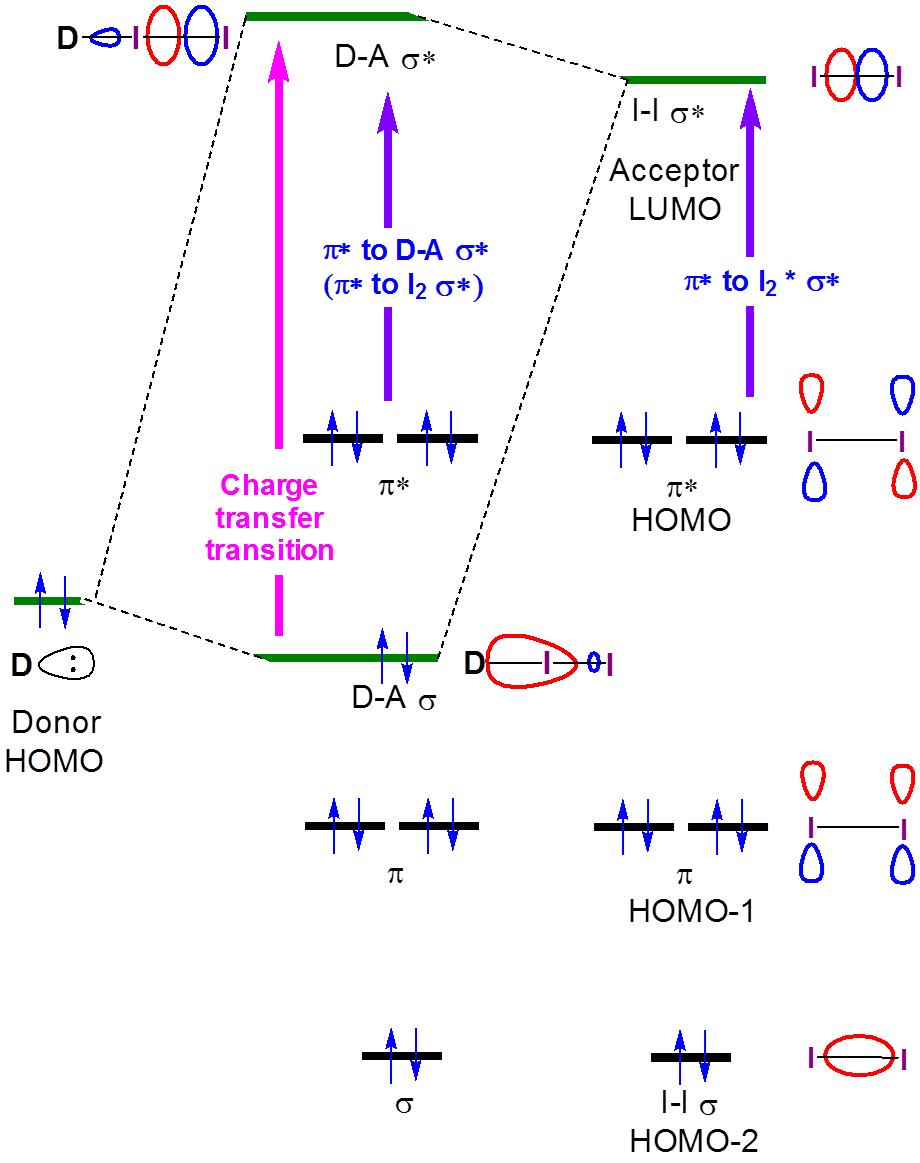
Las soluciones de I 2 como mezclas con bases de Lewis como aminas y en disolventes donadores tienen claramente bandas de transferencia de carga en sus espectros de absorción. Varios de estos espectros se dan en la Figura 6.4.2.3.
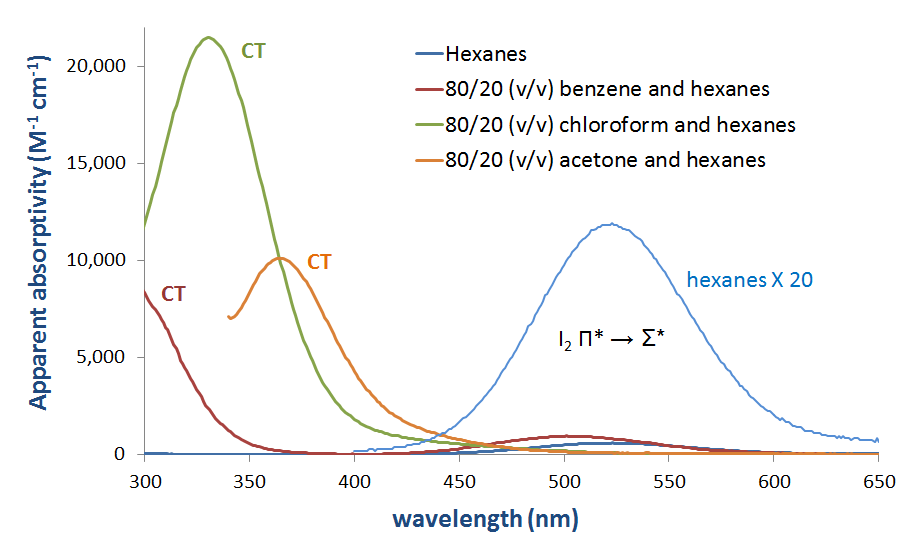
En principio, las energías tanto de la transferencia de carga como de las\(I_2~\pi *~\rightarrow ~D-A~ \sigma *\) transiciones aumentan con la fuerza del donante, como se muestra en la Figura 6.4.2.4.
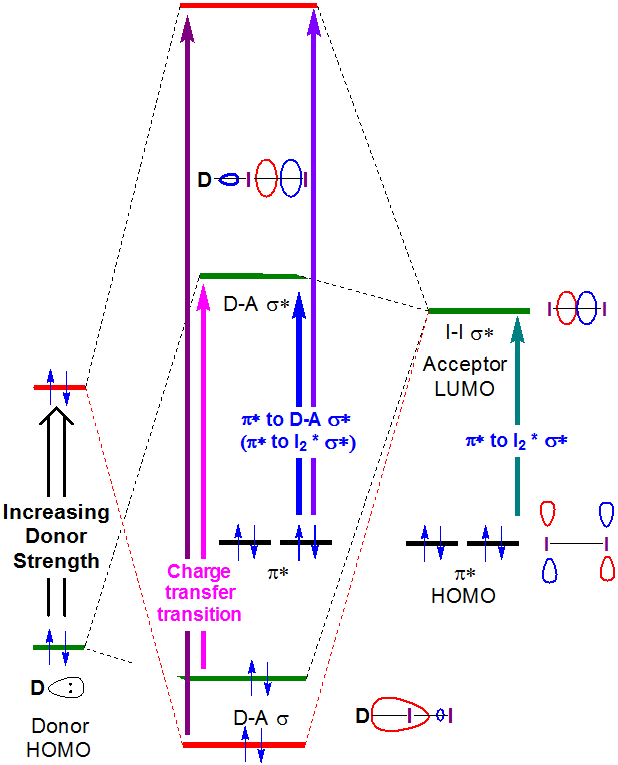
Como se puede ver en la Figura 6.4.2, se podría esperar que la energía de la banda de transferencia de carga aumente a medida que el HOMO donante aumente en energía para acercarse en energía al LUMO aceptor. Si bien se debe tener cuidado al interpretar los espectros de fase de solución de I 2, esta expectativa se ve corroborada por un análisis superficial y cualitativo de los espectros en la Figura 6.4.2.3. La energía de transición CT se desplaza hacia longitudes de onda más bajas (y por lo tanto mayor energía) a medida que la energía orbital atómica ocupada más alta para el átomo donante aumenta al pasar de acetona (oxígeno, -15.85 eV) a cloroformo (cloro, -13.67eV) y finalmente benceno (carbono, -10.66 eV) . **
Las transiciones de transferencia de carga son responsables del color intenso de muchos complejos de metales de transición. En estos casos, sin embargo, la débil interacción ácido-base de Lewis implica la donación incompleta de electrones y la aceptación en un\(p \pi -d \pi\) (o\(p\pi-d\pi*\)) -enlace entre un metal y un ligando. Las bandas de transferencia de carga en los espectros de absorción de estos complejos implican la transferencia de electrones entre el metal y el ligando. En particular,
- Las bandas de transferencia de carga de metal a ligando (MLCT o CTTL) implican la transferencia de un electrón de un orbital d de metal lleno o parcialmente relleno a un orbital de\(\pi*\) tipo ligando.

- Las bandas de transferencia de carga de ligando a metal (LMCT o CTTM) implican la transferencia de un electrón de un orbital de ligando lleno o parcialmente lleno a un orbital d metálico.

- Se pueden observar bandas de transferencia de carga de metal a metal en algunos complejos bimetálicos. Sin embargo, estos generalmente se consideran solo como una transferencia de electrones en lugar de como un cambio en el estado de una interacción ácido-base de Lewis.
Debido a que las bandas de transferencia de carga de metal-ligando implican transferencia de electrones intermolecular entre el metal y el ligando para generar un estado redox de alta energía, el estado excitado por TC es tanto un mejor oxidante como reductor que el estado fundamental. En consecuencia, se han realizado intensas investigaciones sobre el desarrollo de complejos metálicos cuyos estados excitados por transferencia de carga son poderosos oxidantes y reductores con la expectativa de que puedan impulsar la oxidación fotocatalítica y reducción de sustratos.
* La absortividad aparente de I 2 en hexanos se calculó a partir del espectro de absorción de 215 µM I 2 en hexanos. Todas las demás absorbilidades aparentes se calcularon a partir de espectros de absorción de soluciones que fueron 44 µM en I 2.
** Las posiciones de banda no son las energías de banda CT, y las energías HOMO dadas son niveles de energía atómica y no necesariamente corresponden al HOMO del donante en solución. Debido a esta y otras simplificaciones, este análisis no pretende sustituir a un riguroso análisis computacional de los factores que dan lugar a las posiciones de la banda CT.
Referencias
- Meyerstein, D.; Treinin, A., Complejos de transferencia de carga de yodo y aniones inorgánicos en solución. Transacciones de la Sociedad Faraday 1963, 59 (0), 1114-1120.
- Baskar, A. J. A.; Rajpurohit, A. S.; Panholandés, M.; Jaccobb, M.; RoopSingH, D.; Kannappan, V., Análisis experimental y teórico del efecto sustituyente sobre los complejos de transferencia de carga de yodo y algunos alquilbencenos en solución de n-hexano a 303K. Recopilaciones de Datos Químicos 2017, 7-8, 80-92.

