6.4.8: La química de pares de Lewis frustrados utiliza sitios ácidos y bases de Lewis dentro de una molécula que están restringidos estéricamente para formar un aducto entre sí.
- Page ID
- 81291
En ciertos casos cuando un aducto ácido-base de Lewis es estéricamente impedido de formar cuantitativamente un aducto (y tal vez incluso cuando son tan capaces), el ácido de Lewis y la base de Lewis pueden actuar juntos para escindir heterolíticamente enlaces químicos. En tales casos se dice que el par de electrones que de otro modo serían donados por la base es un par de Lewis frustrado (FLP) y al realizar la escisión heterolítica se dice que el ácido y la base de Lewis exhiben una química frustrada de pares de Lewis.
El fosfinoborano de Stephan ilustra cómo funciona la química FLP. Escinde reversiblemente el dihidrógeno para dar una especie zwitteriónica que contiene enlaces hidruro de elementos ácidos y básicos.
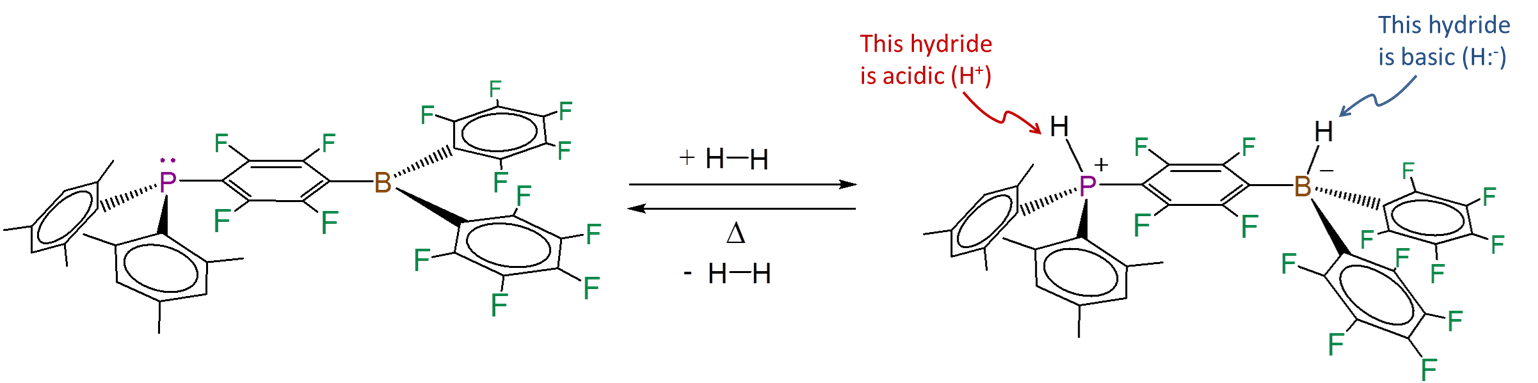
Tenga en cuenta que el ácido y la base de Lewis no necesitan ser parte de la misma molécula. El hidrógeno también se escinde heterolíticamente por mezclas de triarilfosfinasestéricamente gravadas y triarilboranos. Esta vez la reacción da iones fosfonio e hidroborato:
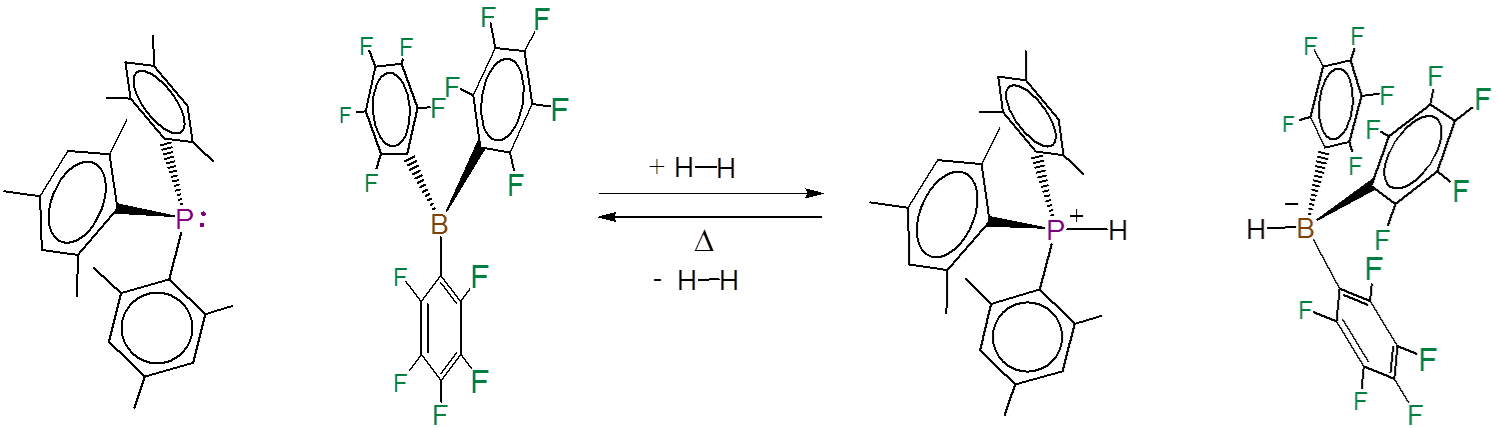
Dada la descripción de los sistemas FLP como aductos ácido-base frustrados de Lewis, es natural pensar que la escisión de sustratos como H 2 implica un ataque nucleofílico por la base de Lewis mientras que el ácido de Lewis actúa como un electrófilo en un mecanismo de escisión heterolítica.
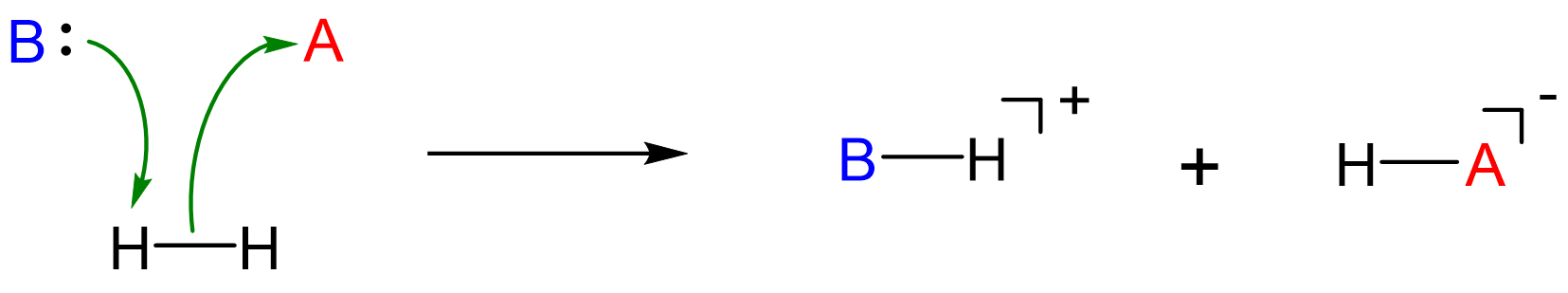
Sin embargo, solo algunos sistemas FLP escinden sustratos a través de este mecanismo. En otros, el mecanismo implica la escisión homolítica por un intermedio dirradical.
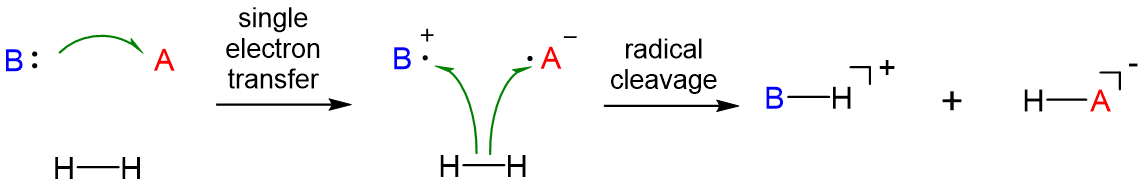
En cualquier caso, cuando sustratos similares\(\ce{H2}\) son escindidos por FLP, generalmente se separan en fragmentos más reactivos (por ejemplo, en el caso de\(\ce{H2}\),\(\ce{H^{+}}\) y\(\ce{H^{-}}\)). Debido a esto, se dice que los sustratos se activan para sufrir más reacciones. Debido a que los sistemas FLP pueden escindir y activar sustratos, existe un interés considerable en el desarrollo de sistemas FLP que puedan facilitar reacciones de interés económico o ambiental. Hasta ahora se han desarrollado sistemas FLP que pueden catalizar diversas hidrogenaciones y activar numerosos sustratos, incluyendo\(\ce{CO}\),\(\ce{SO2}\), y\(\ce{N2}\).
Referencias
- Stephan, D. W., Los pares de Lewis frustrados: del concepto a la catálisis. Cuentas de Investigación Química 2015, 48 (2), 306-316.
- Fontaine, F.-G.; Stephan D. W., Sobre el concepto de parejas frustradas Lewis. Transacciones Filosóficas de la Real Sociedad A: Ciencias Matemáticas, Físicas e Ingenierías 2017, 375 (2101), 20170004.
- Jupp, A. R.; Stephan, D. W., Nuevas direcciones para la química de pares frustrados de Lewis. Tendencias en Química 2019, 1 (1), 35-48.

