6.6.2: Las preferencias Duro-Duro y Suave-Suave pueden explicarse y cuantificarse en términos de estabilización electrostática y covalente y electrónica sobre la estabilidad de aductos ácido-base de Lewis
- Page ID
- 81298
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)El principio de base de ácido blando duro es una herramienta conceptual para pensar en patrones de reactividad ácido-base de Lewis
La explicación de las tendencias en la distribución de metales, la solubilidad de la sal haluro y los patrones de coordinación metálicos preferidos se basa en la observación de Arland, Chatt y Davies de que los ácidos y bases de Lewis podrían clasificarse en dos grupos en función de su propensión a formar compuestos estables entre sí (por ejemplo, los ácidos de una clase tienden a formar aductos más estables con bases en la misma clase que con bases en la otra). 1 Arland, Chatt y Davies denominaron algo aburridamente a estos grupos clase a y clase b pero hoy en día son conocidos por el nombre de Ralph Pearson para ellos. Pearson llamó a los ácidos de clase a y bases duros y ácidos de clase b y bases blandas. Estos términos reflejan cuán “suaves” son las nubes de electrones de estas sustancias hacia la distorsión o, en otras palabras, su polarizabilidad (Figura\(\PageIndex{1}\)). Pearson se refiere a ácidos y bases que son relativamente polarizables blandos y aquellos que son difíciles de polarizar duros.
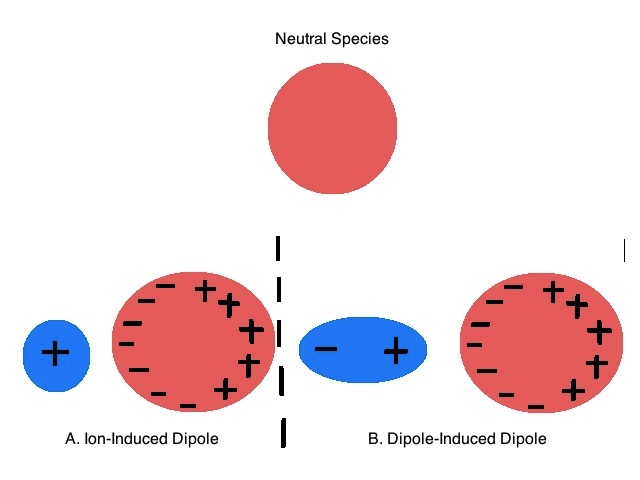
Reconocer ácidos y bases duros y blandos
Los ácidos duros y bases vienen en dos variedades:
- sitios ácidos duros y bases que poseen pocos electrones de valencia y para los que la polarización implica, por lo tanto, distorsionar los electrones centrales, los cuales son difíciles de distorsionar porque están cerca del núcleo y experimentan una carga nuclear alta. Los ejemplos más comunes de tales sustancias son los ácidos duros ácidos de Lewis hacia la izquierda de la tabla periódica.
- sitios ácidos duros y bases con una alta densidad de carga (altamente cargados en relación con el tamaño) y/o que son deficientes en electrones. En estos casos, la polarización implica distorsionar electrones que ya experimentan fuertes interacciones electrostáticas sin blindaje.
Los ácidos blandos y bases también vienen en dos variedades
- ácidos blandos y bases que poseen muchos electrones de valencia y, por lo tanto, se polarizan más fácilmente. En consecuencia, siendo iguales todas las demás cosas, es más probable que los ácidos blandos y las bases se encuentren hacia la mitad o a la derecha de la tabla periódica.
- ácidos blandos y bases con poca densidad de carga y/o que son relativamente ricos en electrones.
Tenga en cuenta que la clasificación duro-blanda no debe pensarse como si todos los ácidos y bases duros fueran igualmente duros y todos los ácidos blandos y bases igualmente blandos. Hay una graduación en dureza y suavidad y una serie de ácidos y bases intermedios que no encajan perfectamente en ninguna de las categorías. Con esta advertencia en mente, a continuación se dan ácidos representativos duros, blandos y limítrofes. Observe cómo ilustran las tendencias que acabamos de esbozar.
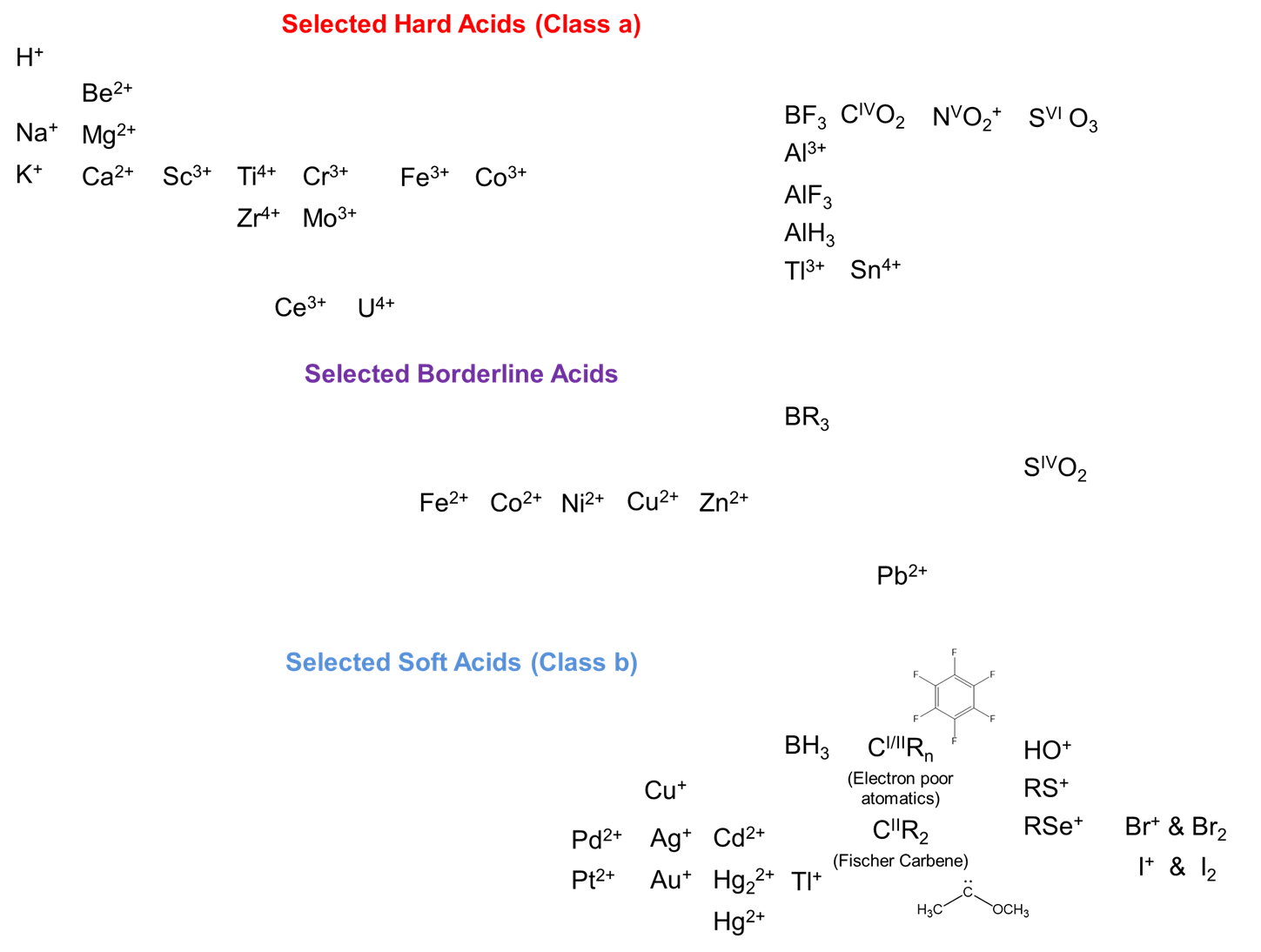
Como era de esperar, los ácidos duros tienden a encontrarse hacia el lado izquierdo de la tabla periódica e implican mayores estados de oxidación y/o sustituyentes donadores de electrones, mientras que los ácidos blandos son más comunes a la derecha de la tabla periódica e involucran estados de oxidación más bajos y/o sustituyentes donadores de electrones.
A continuación se dan bases ilustrativas duras, blandas y limítrofes. Nuevamente, observe cómo estas sustancias ilustran las tendencias generales.
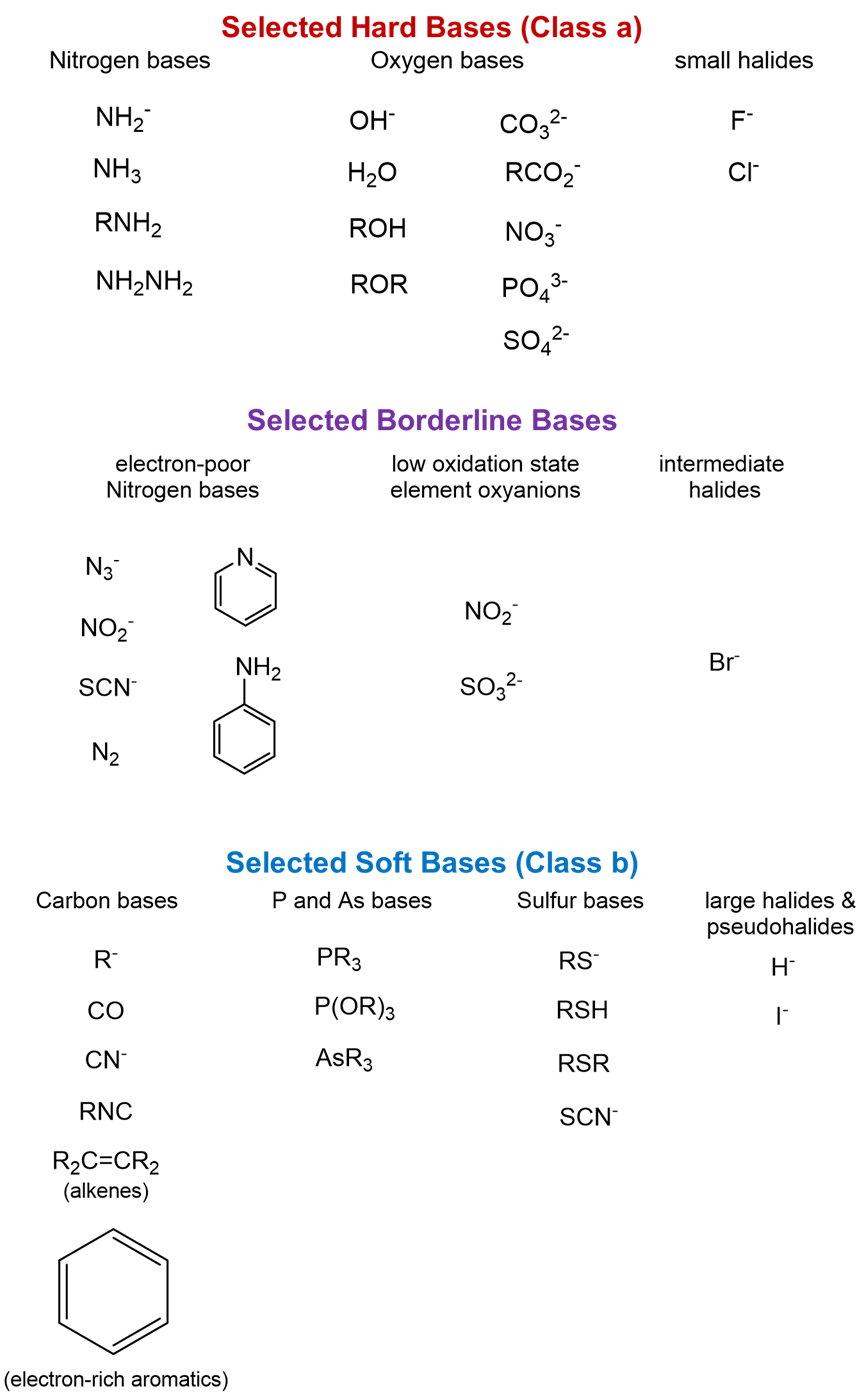
Estimación cualitativa de la dureza relativa y suavidad de ácidos y bases de Lewis
Como se puede ver en los ejemplos anteriores, los ácidos duros son relativamente pobres en electrones y las bases duras ricas en electrones, ya que tienen comparativamente
- orbitales fronterizos pequeños, que reflejan sus tamaños relativamente pequeños de átomos/iones/fragmentos
- estados de oxidación altos (para ácidos) o bajos (para bases) en el átomo base, reflejados en una gran carga formal positiva (para ácidos) o carga formal negativa (para bases)
- baja polarizabilidad, debido a la pérdida o ganancia de números sustanciales de electrones, o la localización de
- carga positiva en un elemento electropositivo o un átomo que lleva sustituyentes aceptores de electrones
- carga negativa en un elemento electronegativo o un átomo que porta sustituyentes donadores de electrones
A diferencia de los ácidos duros y bases, los ácidos blandos son relativamente ricos en electrones y las bases blandas son más grandes y más pobres en electrones, ya que tienen comparativamente
- orbitales fronterizos grandes, que reflejan sus tamaños relativamente grandes de átomos/iones/fragmentos
- estados de oxidación bajos, a menudo dando como resultado cargas atómicas pequeñas o inexistentes
- alta polarizabilidad, como podría esperarse de especies en las que las repulsiones electrón-electrón son menores y los electrones están dispersos en un gran volumen. A veces esto está indicado por
- carga positiva en un elemento electronegativo o un átomo que porta sustituyentes donadores de electrones
- carga negativa en un elemento electropositivo o un átomo que lleva sustituyentes aceptores de electrones
Clasificar los ácidos o bases en cada conjunto en orden creciente de dureza esperada.
- Cr 2 + y Cr 3 +
- H +, Cs + y Tl +
- SCN - (actuando como base en N) y SCN - (actuando como base en S)
- AlF 3, AlH 3, AlMe 3
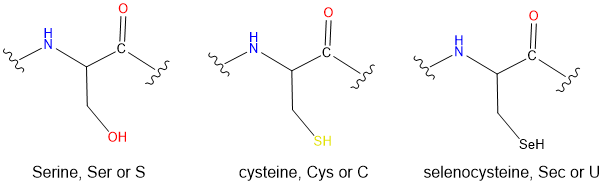
- Las cadenas laterales de los siguientes aminoácidos proteinogénicos
- Contestar
-
(a) Cr 2 + < Cr 3 + Todas las demás cosas siendo iguales, la dureza aumenta con el estado de oxidación.
(b) Tl + < Cs + < H + El orden refleja el tamaño más grande de Cs + y Tl+ en relación con H + (que no posee electrones que puedan polarizarse de todos modos) y que Tl+ todavía posee dos electrones de valencia mientras que Cs + no posee ninguno.
(c) SCN - (actuando como base en S) < SCN - (actuando como base en N). El orden refleja la mayor electronegatividad de N que S y N posee una carga formal más negativa de -1.
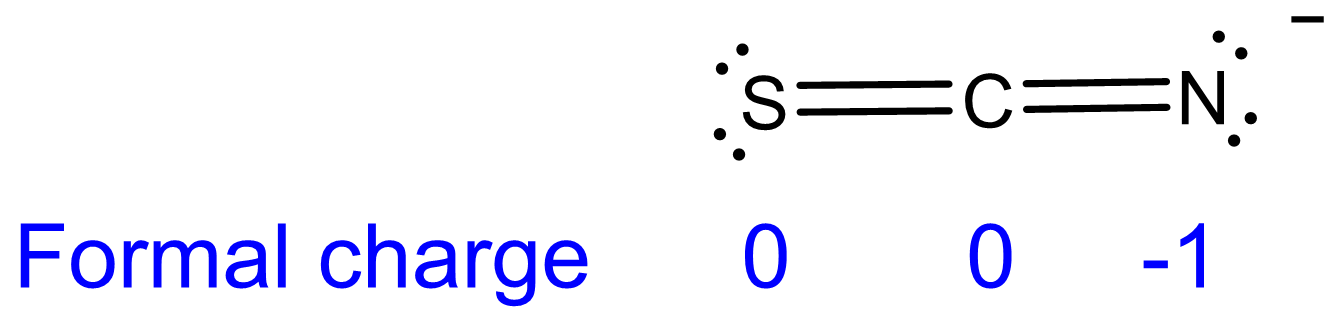
d) AlH 3 < AlMe 3 < AlF 3. La dureza aumenta a medida que los sustituyentes en el centro de Al ácido de Lewis se vuelven menos donadores de electrones y más extractores de electrones (y, por cierto, bases más duras) a medida que su electronegatividad aumenta en el orden H - < CH 3 - < F -. Obsérvese que el orden de la capacidad donadora de electrones para H - y CH 3 - es el opuesto observado para los carbocationes, para los cuales la hiperconjugación juega un papel más importante.
(e) Sec < Cys < Ser. La dureza aumenta a medida que aumenta la electronegatividad del calcógeno base Lewis al pasar de un selenol a un tiol a un alcohol.
El principio ácido-base duro-blando (principio HSAB)
El principio ácido-base Hard-Soft (Principio HSAB) explica los patrones en la reactividad ácido-base de Lewis en términos de una reacción similar con preferencia similar. Tanto termodinámica como cinéticamente, los ácidos duros prefieren bases duras y bases blandas de ácidos blandos. Específicamente,
- Termodinámicamente, los ácidos duros forman complejos ácido-base más fuertes con bases duras mientras que los ácidos blandos forman complejos más fuertes con bases blandas.
- Cinéticamente, los ácidos duros/electrófilos reaccionan más rápidamente con bases duras/nucleófilos mientras que los ácidos blandos/electrófilos reaccionan más rápidamente con bases blandas/neucleófilos.
Las aplicaciones del principio HSAB incluyen
1. Predecir el equilibrio o velocidad de la metátesis ácido-base de Lewis y las reacciones de desplazamiento. En una reacción de metátesis ácido-base de Lewis, los ácidos y bases intercambian socios\[\ce{A1:B1 + A2:B2 <=>[k_1, K_{eq}] A1:B2 + A2:B1} \nonumber \]
Por ejemplo, la posición de equilibrio de la reacción de metátesis entre\(\ce{TlF}\) y\(\ce{K2S}\) favorece a los productos:
\[\ce{2TlF + H2S <=>> Tl2S + 2KF} \nonumber \]
consistente con las preferencias duro-duro y suave-blando del HSAB.
 \[ \nonumber \]
\[ \nonumber \]
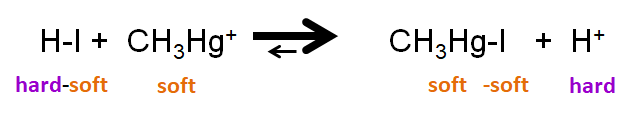
El principio HSAB también permite predecir la posición de las reacciones de desplazamiento, en las que un ácido o base de Lewis forma un aducto usando una base o ácido de un complejo ácido-base de Lewis existente. En estas reacciones, el desplazamiento de ácido o base del complejo reactivo puede considerarse como una especie de reacción de metátesis, una en la que en el ácido o base no unido cambia de lugar con otra en el complejo. Por ejemplo, la reacción entre\(\ce{HI}\) y catión metilmercurio
\[\ce{HI + HgSCH3^{+} <=> CH3SHgI + H^{+}} \nonumber \]
implica el desplazamiento de un yoduro de\(\ce{HI}\) dar\(\ce{CH3HgI}\). La posición del equilibrio favorece\(\ce{CH3HgI}\) ya que ambos\(\ce{CH3Hg^{+}}\) y\(\ce{I^{-}}\) son blandos, mientras que\(\ce{H^{+}}\) es un ácido duro.
 \[ \nonumber \]
\[ \nonumber \]
Predecir la posición de equilibrio para la siguiente reacción.
\[\ce{Fe2O3 + 3Ag2S <=> Fe2S3 + 3Ag2O} \nonumber \]
- Contestar
-
El equilibrio favorecerá a los reactivos (K<1) ya que las interacciones duro-duro y blando-blando en los reactivos son más estables que las interacciones duro-blandas en los productos.

Predecir si\(K\) para los siguientes equilibrios serán <>1<1, ~1, or >.
- \(\ce{2HF + (CH_3Hg)_2S ⇌ 2CH_3HgF + H_2S}\)
- \(\ce{Ag(NH_3)_2^+ + 2PH_3 ⇌ Ag(PH_3)_2^+ + 2NH_3}\)
- \(\ce{Ag(PH_3)_2^+ + 2H_3B-SH_2 ⇌ 2H_3B-PH_3 + Ag(SH_2)_2^{+}}\)
- \(\ce{H_3B-NH_3 + F_3B-SH_2 ⇌ H_3B-SH_2 + F_3B-NH_3}\)
- Contestar
-
a. K< < 1 ya que los aductos reaccionantes son duros, duros y blandos, mientras que los productos implican interacciones duro-blando.
b. K>>1 ya que el complejo reactivo, diamina plata (I), es un complejo de una base dura, NH 3, con el ácido blando, Ag +, mientras que el producto es un complejo del mismo ácido blando con la base blanda fosfina.
c. K~1 ya que todos los aductos entre los reactivos y productos involucran ácidos blandos y bases.
d. K>>1 ya que BH 3 es un ácido más blando que BF 3, por lo que formará un complejo más fuerte con la base más blanda H 2 S mientras que el BF 3 más duro forma un complejo más fuerte con la base más dura NH 3.
2. Predecir las fuerzas relativas de un conjunto dado de ácidos o bases de Lewis hacia un sustrato particular. Consideremos, por ejemplo, las resistencias relativas de un BH 3, BMe 3 y BF 3 hacia los hidruros del grupo 15 como NH 3, PH 3 y Ash 3. De los boranos enumerados, el ácido más duro BF 3 es el ácido más fuerte hacia la base dura NH 3 mientras que BH 3 es el más fuerte hacia Ash 3. †
¿Qué ácido formará el complejo más estable con\(\ce{CO}\):\(\ce{BH3}\),\(\ce{BF3}\), o\(\ce{BMe3}\)?
- Contestar
-
\(\ce{BH3}\). Dado que\(\ce{CO}\) forma complejos principalmente a través de su par solitario de carbono, es una base blanda y así formará el complejo más fuerte con el ácido de Lewis más suave.
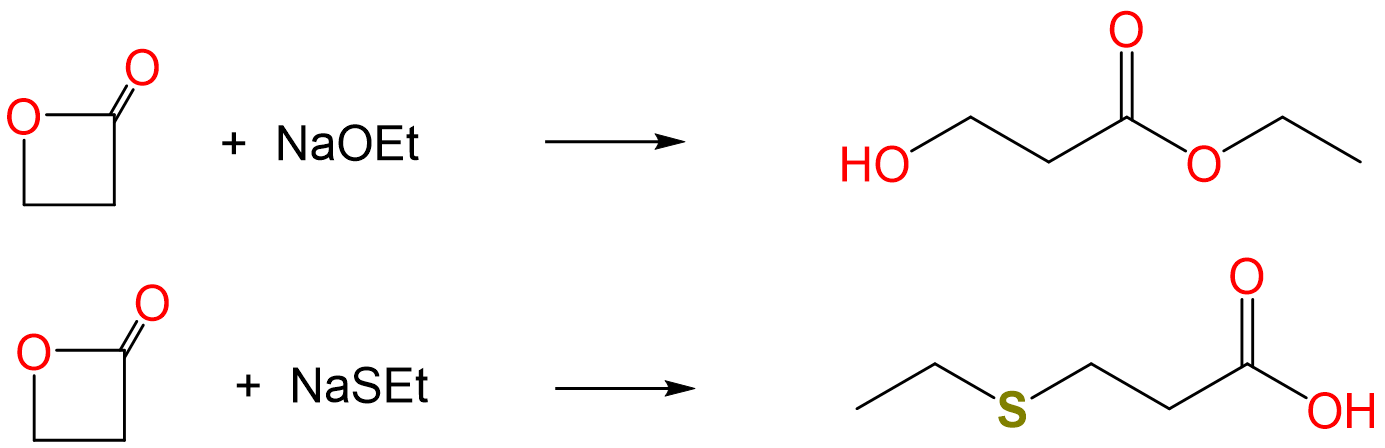
Cuando las lactonas reaccionan con nucleófilos, pueden sufrir reacciones de apertura del anillo para dar un alcohol o un ácido carboxílico, como se muestra para la propiolactona a continuación:
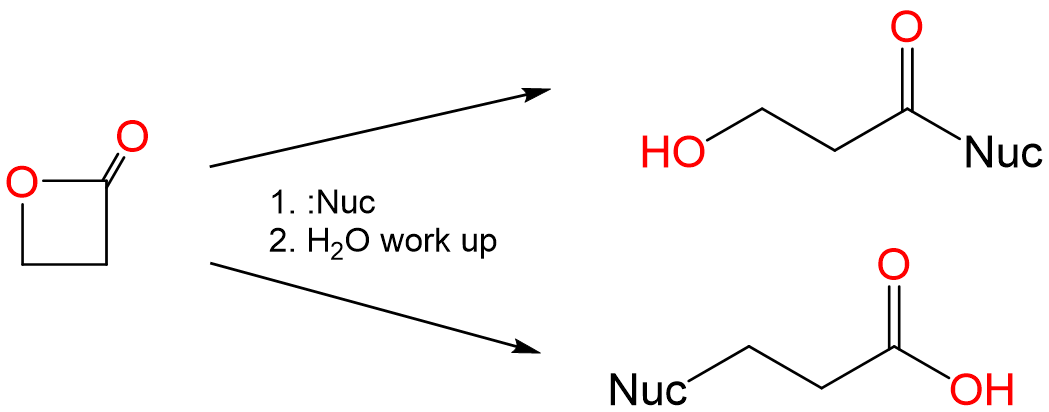
En la reacción anterior, los alcóxidos estéricamente no impedidos dan un producto y los tioalcóxidos estéricamente sin impedimentos el otro. Explicar por qué es así y predecir los productos de la reacción entre propiolactona y las sales sódicas de etóxido y tioetóxido.
- Contestar
-
Los dos productos de reacción corresponden al ataque nucleofílico en los dos centros de carbono electrófilos de las lactonas. Específicamente, el ácido se produce por ataque en el centro C I más blando del CH 2 directamente unido al éster oxígeno y al alcohol por ataque nucleofílico en el centro C III más duro del éster carbonilo.
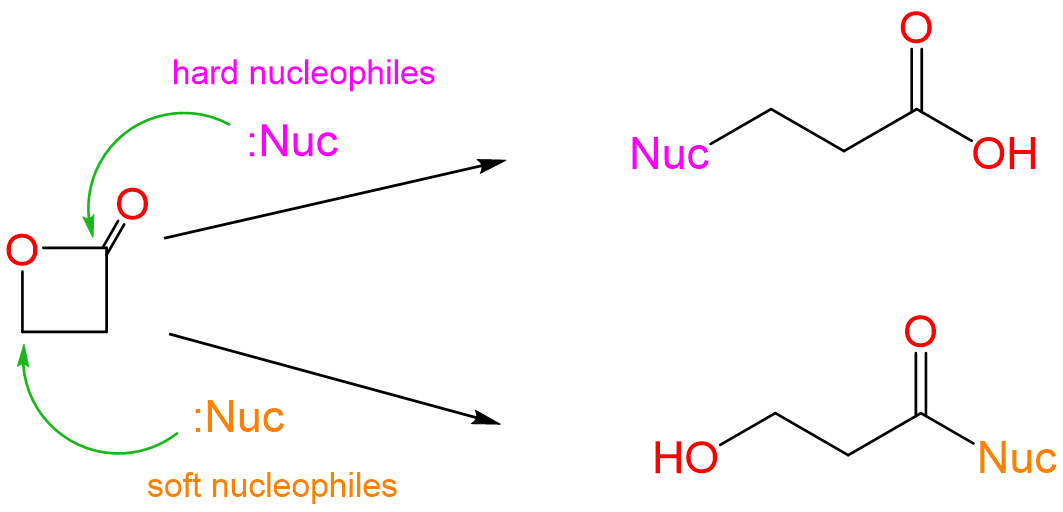
En consecuencia, es razonable esperar que el etóxido de base más dura ataque nucleofílicamente al carbono carbonílico más duro mientras que el tioetóxido más blando atacará al carbono de metileno más blando.
La interpretación teórica del principio ácido-base duro-blando es que las preferencias duro-duro reflejan una estabilización electrostática superior, mientras que las preferencias suave-suaves reflejan una estabilización covalente superior.
Las preferencias duro-duro y suave-blando en las interacciones ácido-base de Lewis reflejan que
- El par solitario de una base dura está fuertemente estabilizado electrostáticamente por un ácido duro.
- El par solitario de una base blanda se estabiliza fuertemente formando un enlace covalente con un ácido blando.
- El par solitario de una base dura o blanda se estabiliza comparativamente débilmente por un ácido opuesto a él en dureza o suavidad ya que la estabilización general electrostática y covalente del aducto es comparativamente débil.
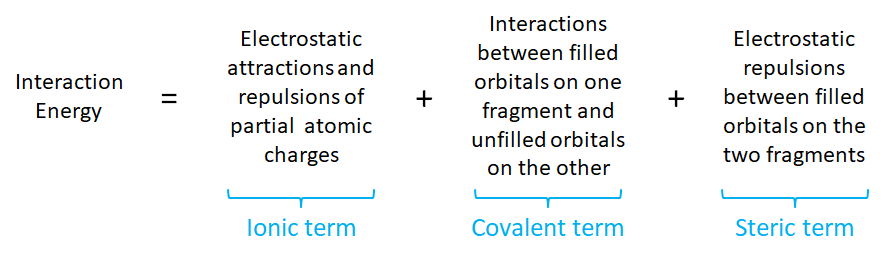
Para ver por qué este es el caso es útil dividir las contribuciones a la energía de interacción entre un ácido y una base de la siguiente manera:
 \[ \nonumber \]
\[ \nonumber \]
De las tres contribuciones a la energía de interacción, solo los términos iónico y covalente se relacionan directamente con la dureza del ácido y la base que interactúan. Un enfoque para pensar cómo la dureza influye en las contribuciones iónicas y covalentes es considerar los orbitales fronterizos involucrados en la interacción ácido-base. Esto se hace a veces mediante el uso de la ecuación de Salem-Klopman, 1, * aunque en el tratamiento que sigue se empleará un enfoque más cualitativo.
Tanto los ácidos duros como las bases tendrán niveles de HOMO de energía comparativamente bajos y niveles de LUMO de alta energía, con una brecha HOMO-LUMO correspondientemente alta. En contraste, los ácidos y bases blandos tendrán niveles de HOMO comparativamente altos de energía y niveles de LUMO de baja energía, dando una brecha HOMO-LUMO comparativamente menor.
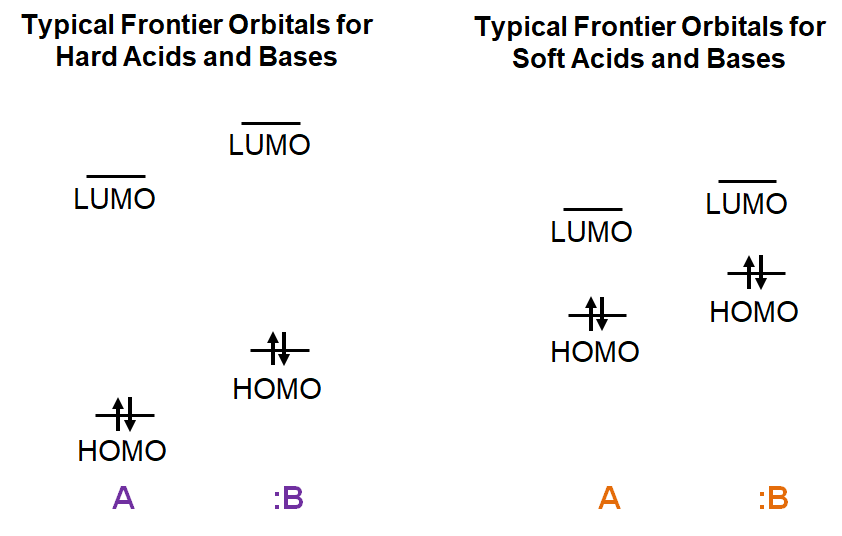
Ante esto, considere las interacciones orbitales fronterizas involucradas en la formación de un complejo ácido-base para los posibles casos, como se ilustra esquemáticamente a continuación.
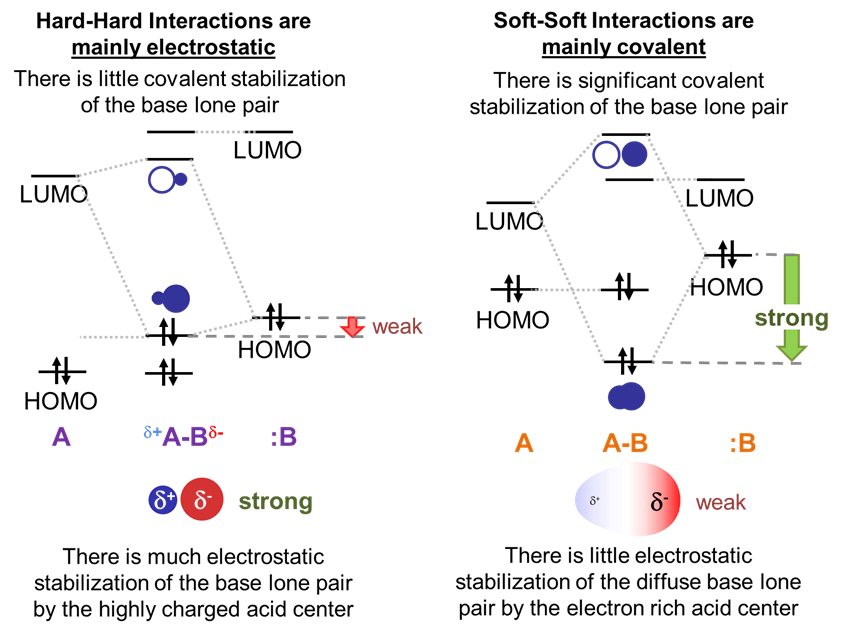
La gran brecha de energía entre los pares solitarios HOMO altamente estabilizados de las bases duras y el LUMO de alta energía de los ácidos duros asegura que en los aductos de bases duras ácido-duras la interacción estabilizadora dominante implicará atracción electrostática entre el par solitario de bases y el centro ácido de Lewis electropositivo . Afortunadamente, dado que las nubes de electrones en bases duras son relativamente densas y ricas en electrones, mientras que los ácidos de Lewis duros son muy cargados y pequeños, estas interacciones electrostáticas son fuertes.
En contraste, en los aductos de ácido blando-base blanda, la interacción estabilizante dominante será covalente. Esto se debe a que el pequeño espacio de energía entre una base blanda HOMO y un LUMO ácido blando permite la formación de un orbital de enlace bien estabilizado con una densidad electrónica significativa entre el ácido y la base.
Las interacciones de los orbitales entre ácidos duros y bases blandas y ácidos blandos y bases duras son intermedias entre los casos de bases duras ácido-duras y bases blandas.
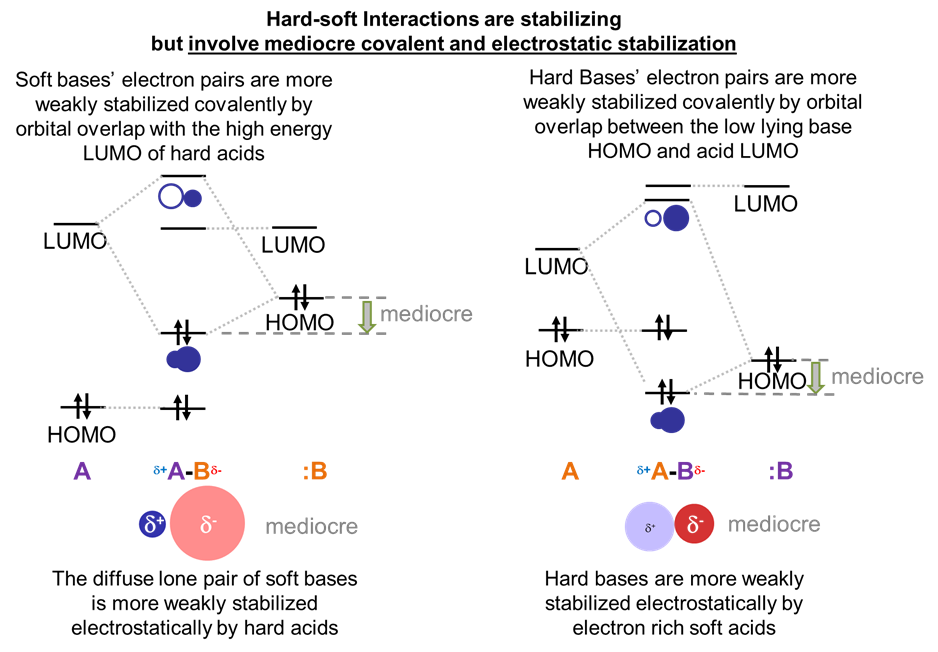
Esto significa que los aductos son estables en relación con el ácido y la base libres, pero no tan bien estabilizados como en el caso del ácido duro y la base dura. En el caso de ácidos duros y bases blandas, los ácidos duros son menos capaces de estabilizar electrostáticamente el par de electrones relativamente difuso de las bases blandas y no hay tanta estabilización covalente como en aductos de ácidos blandos y bases debido a la alta energía del ácido duro.
Referencias
1. Ahrland, S.; Chatt, J.; Davies, N. R., Las afinidades relativas de los átomos de ligando para moléculas aceptoras e iones. Reseñas Trimestrales, Chemical Society 1958, 12 (3), 265-276.
2. Pearson, R. G., Ácidos y Bases Duros y Blandos. Revista de la Sociedad Americana de Química 1963, 85 (22), 3533-3539.
3. Fleming, I., Orbitales moleculares y reacciones químicas orgánicas. Ed de referencia; Wiley: Hoboken, N.J., 2010.
Notas
* A pesar de la fecundidad de esta observación, en general es importante reducir el potencial de sesgo del observador comprobando observaciones como estas contra compuestos reportados en la literatura química y bases de datos como la Estructura de Cristal Inorgánico y las Bases de Datos Cristalográficas de Cambridge.
** Éstas son muy solubles en agua, hasta el punto en que algunas soluciones son quizás mejor descritas como soluciones de agua en el haluro.
† Esto se puede predecir con base en la dureza relativa de BF 3, BR 3 y BH 3 en la lista de ácidos duros y blandos. Sin embargo, para aquellos de ustedes que pueden estar confundidos en cuanto a por qué H es considerado un mejor donante de electrones con el propósito de ablandar un centro ácido de Lewis mientras que los grupos alquilo son mejores donantes de electrones con el propósito de estabilizar los carbocationes en la química orgánica, el efecto dominante es la menor electronegatividad de H relativo al carbono (en CH 3). El efecto de la donación de electrones debido a la hiperconjugación no es tan grande para bases termodinámicamente estables como BX 3/BR 3.
†† Para más información sobre la ecuación de Salem-Klopman ver Fleming, I., Orbitales moleculares y reacciones químicas orgánicas. Ed de referencia; Wiley: Hoboken, N.J., 2010; pp. 138-143.

