6.6.1: Las medidas cuantitativas de dureza, suavidad e interacciones ácido-base desde una perspectiva de principio ácido-base blanda dura implican energías orbitales y/o distribución de la unión ácido-base en términos de factores electrostáticos y covalentes
( \newcommand{\kernel}{\mathrm{null}\,}\)
La dureza absoluta Pearson es una métrica útil de dureza basada en energías orbitales
El reconocimiento de que los ácidos duros y bases poseen una gran brecha HOMO-LUMO sugiere que el tamaño del hueco en sí podría servir como un índice útil de dureza. La base de esta idea se puede encontrar considerando la definición de dureza absoluta de Pearson, η. 1 La dureza absoluta de Pearson, η, es la mitad de la segunda derivada de la energía de una especie con respecto a los cambios en el número total de electrones,Ne−.
Pearson’s absolute hardness=η=12d2EdN2e−
(in eV)
y, dado que la dureza y suavidad de ácidos y bases están inversamente relacionadas, la suavidad absoluta de Pearson, σ, es solo la inversa de la dureza.
Pearson’s softness=1η
De estos, la dureza absoluta de Pearson está relacionada con la definición Mulliken de electronegatividad como la primera derivada de la energía de una especie con respecto a los cambios en el número total de electrones.
Mulliken electronegativity=χ=dEdNe−
(in eV)
Operacionalmente, tanto la dureza Pearson como la electronegatividad de Mulliken se aproximan en términos de las energías asociadas con cambios unitarios en el número de electrones, es decir, en términos de energías de ionización y electronegatividades. Específicamente,
Pearson’s absolute hardness=η≈IE–EA2
Mulliken electronegativity=χ≈IE+EA2
dondeIE y en dondeEA estáneV.
La conexión entre la dureza/suavidad absoluta de Pearson y la brecha HOMO-LUMO se desprende entonces del teorema de Koopman, en el que la energía de ionización (IE) es justo lo contrario de la energía HOMO.
IE=−EHOMO
De manera similar, la afinidad electrónica (EA), definida como lo opuesto a la energía liberada en la absorción de un electrón, puede tomarse como una aproximación de la energía LUMO.
ELUMO≈−EA
Entonces, la dureza absoluta de Pearson es solo la mitad del tamaño de la brecha HOMO-LUMO (banda gap) en electronvoltios:
Pearson's absolute hardness=η≈ELUMO–EHOMO2
donde se dan todos los valoreseV,
y la electronegatividad de Mulliken es solo el promedio de las energías HOMO y LUMO (~energía Fermi):
Mulliken electronegativity,χ≈−ELUMO+EHOMO2
where all values are given in eV
Las relaciones entre la dureza absoluta de Pearson, la electronegatividad de Mulliken y las energías HOMO y LUMO se representan esquemáticamente para las monocaciones del grupo 1A en la Figura6.6.1.1.
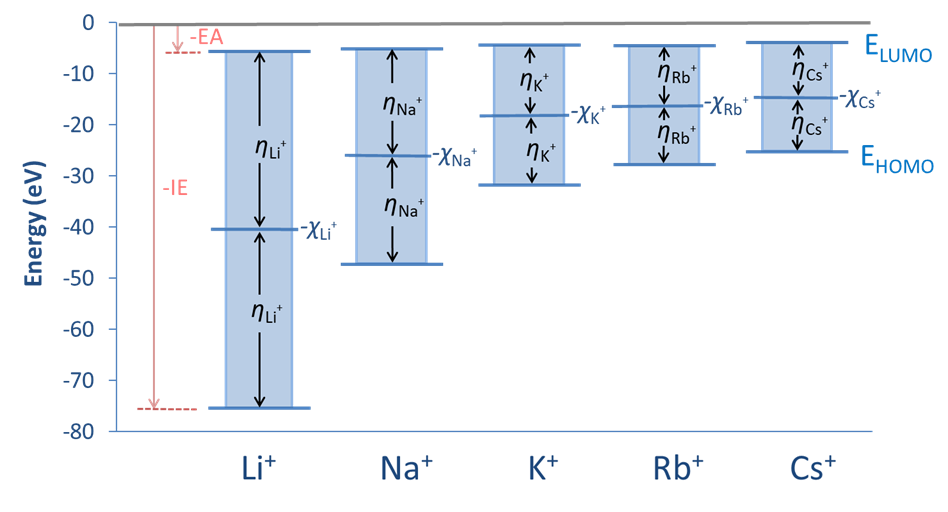
Los valores de la dureza Pearson y electronegatividad de Mulliken para varios ácidos y bases se dan en la Tabla6.6.1.1. Los valores de la tabla confirman las tendencias esperadas, mostrando un incremento en la dureza con el tamaño (abajo de un grupo), con el aumento de la carga, y a medida que aumenta la electronegatividad de los sustituyentes para una serie de iones isolobales.
| Especies | Energía de ionización, IE o I (eV) | Afinidad de electrones, EA o A (eV) | Electronegatividad Mulliken, χ (eV) | Dureza Absoluta Pearson, η (eV) |
|---|---|---|---|---|
| Ácidos seleccionados | ||||
| Monocaciones del Grupo 1A | ||||
| Li + | 75.64 | 5.39 | 40.52 | 35.12 |
| Na + | 47.29 | 5.14 | 26.21 | 21.08 |
| K + | 31.63 | 4.34 | 17.99 | 13.64 |
| Rb + | 27.28 | 4.18 | 15.77 | 11.55 |
| Cs + | 25.1 | 3.89 | 14.5 | 10.6 |
| Monocaciones del grupo 11 | ||||
| Cu + | 20.29 | 7.73 | 14.01 | 6.28 |
| Ag + | 21.49 | 7.58 | 14.53 | 6.96 |
| Au + | 20.5 | 9.23 | 14.9 | 5.6 |
| Isoelectronic Fila 3 Cationes Metálicos | ||||
| Na + | 47.29 | 5.14 | 26.21 | 21.08 |
| Mg 2 + | 80.14 | 15.04 | 47.59 | 32.55 |
| Al 3 + | 119.99 | 28.45 | 74.22 | 45.77 |
| Cambios con la carga de iones de metal de transición | ||||
| Fe 2 + | 30.65 | 16.18 | 23.42 | 7.24 |
| Fe 3 + | 54.8 | 30.65 | 42.73 | 12.08 |
| Co 2 + | 33.50 | 17.06 | 25.28 | 8.22 |
| Co 3 + | 51.3 | 22.5 | 42.4 | 8.9 |
| Trihaluros de boro | ||||
| BF 3 | 15.81 | -3.5 | 6.2 | 9.7 |
| BCl 3 | 11.60 | 0.33 | 5.97 | 5.64 |
| BBr 3 | 10.51 | 0.82 | 5.67 | 4.85 |
| CO 2 | 13.8 | -3.8 | 5.0 | 8.8 |
| CS 2 | 10.08 | 0.62 | 5.35 | 5.56 |
| Bases Seleccionadas | ||||
| Monoaniones del grupo 17 (tomados como idénticos a los valores de átomos libres; para argumentos de por qué esto es razonable ver Pearson, R. G., Inorg. Chem. 1988, 27 (4), 734-740.) | ||||
| F - | 17.42 | 3.40 | 10.41 | 7.01 |
| Cl - | 13.01 | 3.62 | 8.31 | 4.70 |
| Br - | 11.84 | 3.36 | 7.60 | 4.24 |
| I - | 10.45 | 3.06 | 6.76 | 3.70 |
| Grupo 15 hidruros | ||||
| NH 3 | 10.7 | -5.6 | 2.6 | 8.2 |
| PH 3 | 10.0 | -1.9 | 4.1 | 6.0 |
| Trimetilpíctidos | ||||
| NMe 3 | 7.8 | -4.8 | 1.5 | 6.3 |
| PMe 3 | 8.6 | -3.1 | 2.8 | 5.9 |
| ASMe 3 | 8.7 | -2.7 | 3.0 | 5.7 |
| Grupo 16 hidruros | ||||
| H 2 O | 12.6 | -6.4 | 3.1 | 9.5 |
| H 2 S | 10.5 | -2.1 | 4.2 | 6.2 |
| Trihaluros de fósforo | ||||
| PF 3 | 12.3 | -1.0 | 5.7 | 6.7 |
| PC1 3 | 10.2 | 0.8 | 5.5 | 4.7 |
| PBr 3 | 9.9 | 1.6 | 5.6 | 4.2 |
Los parámetros ácido-base Drago-Wayland permiten estimar las contribuciones electrostáticas y covalentes a la entalpía de formación de un aducto ácido-base de Lewis.
Aunque los valores de dureza Pearson son una métrica útil de dureza de ácidos y bases, no se pueden usar fácilmente para estimar la energía de interacción ácido-base de Lewis. Este no es el caso del modelo EC desarrollado por Drago y Wayland. 3 En el Modelo EC de Drago y Wayland, la entalpía de formación de un aducto ácido-base, AB,
A+B⇌AB ΔHAB adduct
a partir del ácido (A) y la base (B) se puede calcular como la suma de productos de factores electrostáticos (E) y covalentes (C) que reflejan la propensión del ácido y la base a participar en fuertes interacciones electrostáticas y covalentes entre sí:
−ΔHAB adduct=EAEB+CACB
donde E A y C A son los parámetros electrostáticos y covalentes para el ácido y E B y C B los parámetros electrostáticos y covalentes para la base dados en unidades de kcal ½ mol -½. Los parámetros E y C para ácidos y bases seleccionados se dan en la Tabla6.6.1.2.
| Especies | E (kcal ½ mol -½) | C (kcal ½ mol -½) | W (kcal mol -1) | C/E |
|---|---|---|---|---|
| Ácidos | ||||
| I 2 | 0.5 † | 2 † | 0 | 4 |
| iCL | 2.92 | 1.66 | 0 | 0.57 |
| H 2 O | 1.31 | 0.78 | 0 | 0.59 |
| SO 2 | 0.51 | 1.56 | 0 | 3.1 |
| HCCl 3 (cloroformo) | 1.56 | 0.44 | 0 | 0.28 |
| (CH 3) 3 COH | 1.07 | 0.69 | 0 | 0.65 |
| (CF 3) 3 COH | 3.06 | 1.88 | -0.87 | 0.61 |
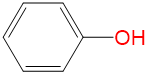 |
2.27 | 1.07 | 0 | 0.47 |
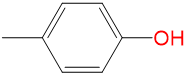 |
2.23 | 1.03 | 0 | 0.46 |
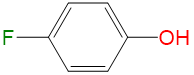 |
2.30 | 1.11 | 0 | 0.48 |
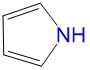 |
1.38 | 0.68 | 0 | 0.49 |
| BF 3 | 1.62 | 9.88 | 6.10 | |
| B (CH 3) 3 | 2.90 | 3.60 | 0 | 1.2 |
| Al (CH 3) 3 | 8.66 | 3.68 | 0 | 0.43 |
| Ga (C 2 H 5) 3 | 6.95 | 1.48 | 0 | 0.21 |
| En (CH 3) 3 | 6.60 | 2.15 | 0 | 0.33 |
| Zn [N (Si (CH 3) 3)] 2 | 2.75 | 2.32 | 0 | 0.84 |
| Cd [N (Si (CH 3) 3)] 2 | 2.50 | 1.83 | 0 | 0.73 |
| Bases | ||||
| NH 3 | 2.31 | 2.04 | 0.88 | |
| CH 3 NH 2 | 2.16 | 3.13 | 1.4 | |
| (CH 3) 2 NH | 1.80 | 4.21 | 2.3 | |
| (CH 3) 3 N | 1.21 | 5.61 | 4.6 | |
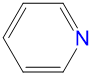 |
1.78 | 3.54 | 2.0 | |
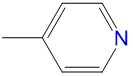 |
1.81 | 3.73 | 2.0 | |
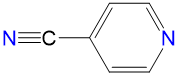 |
1.53 | 2.94 | 1.9 | |
| CH 3 CN | 1.64 | 0.71 | 0.43 | |
| CLch 2 CN | 1.67 | 0.33 | 0.20 | |
| CH 3 C (O) CH 3 | 1.74 | 1.26 | 0.72 | |
| (C 2 H 5) 2 O | 1.80 | 1.63 | 0.91 | |
 |
1.64 | 2.18 | 1.3 | |
 (EtOAc) (EtOAc) |
1.63 | 0.95 | 0.58 | |
 |
2.35 † | 1.31 | 0.56 | |
| (CH 3) 2 S | 0.25 | 3.75 | 15 | |
| (CH 3 CH 2) 2 S | 0.24 | 3.92 † | 15 | |
 |
0.26 | 4.07 | 16 | |
| (CH 3) 2 Se | 0.05 | 4.24 | 83 | |
| (CH 3) 2 SO | 2.4 | 1.47 | 0.61 | |
| (CH 3) 3 P | 0.25 | 5.81 | 24 | |
| (CH 3 O) 3 P | 0.13 | 4.83 | 37 | |
| (C 6 H 5) 3 PO | 2.59 | 1.67 | 0.64 | |
| (C 6 H 5) 3 PS | 0.35 | 3.65 | 10 | |
| C 6 H 6 | 0.70 | 0.45 | 0.64 | |
† Estos valores se fijaron para parametrizar el resto de los parámetros E y C.
Las tendencias en los valores relativos de C y E para los ácidos y bases en la Tabla6.6.1.2 son muy aproximadamente consistentes con las tendencias en dureza y suavidad señaladas anteriormente. Sin embargo, los parámetros sugieren que algunas tendencias en la dureza reflejan cambios en la capacidad de las especies para participar en interacciones iónicas, mientras que otras reflejan cambios en la capacidad de la especie para participar en interacciones covalentes fuertes. Por ejemplo, C B para los dimetilcalcogenidos aumenta de manera constante de 1.5 a 4.25 kcal ½ mol -½ al pasar de Me 2 O a Me 2 Se mientras que E B disminuye de 1.68 a 0.05 kcal ½ mol -½, lo que sugiere que electrostática y los factores covalentes están involucrados en una disminución de la dureza de las bases en el grupo 16. Sin embargo, en el caso de las fosfinas y aminas parece que los factores electrostáticos son los principales responsables de la disminución de la dureza del grupo 15. Al pasar de Me 3 N a Me 3 P, C B solo aumenta ligeramente de 5.61 a 5.81 kcal ½ mol -½ mientras que E B disminuye de 1.21 a 0.25 kcal ½ mol -½ - es decir, al 20% del Me 3 N valor.
Sin embargo, algunas especies tienden a tener valores muy altos tanto para E como para C, lo que refleja su capacidad para participar en fuertes interacciones electrostáticas y covalentes, mientras que otras tienen valores pequeños para ambas, reflejando su estabilidad relativa como especies libres en solución.
Como se puede observar comparando los ácidos y bases que figuran en la tabla de dureza absoluta (Tabla6.6.1.1) y la tabla de parámetros EC (Tabla6.6.1.2). El modelo EC se ha aplicado principalmente a ácidos y bases organometálicos orgánicos y del grupo principal. Sin embargo, se han propuesto una variedad de extensiones que permiten su aplicabilidad más amplia.
El modelo simple de EC solo incluye consideraciones electrostáticas y covalentes y, por lo tanto, ignora la energía estérica, la energía reticular y otras contribuciones a la energía de interacción. Por lo tanto, solo es útil para analizar las energías de interacción de aductos estéricamente sin obstáculos en los que la energía de solvatación y otras contribuciones a la energía de interacción general son insignificantes. Sin embargo, perfeccionamientos adicionales del modelo intentan extender su utilidad acomodando diversos factores, como
- Cepa estérica. Específicamente, Hancock y Martell 6 introdujeron un parámetro D para dar cuenta de cualquier cepa estérica adicional introducida en la formación del aducto, * dando
−ΔHAB adduct=EAEB+CACB−DADB
- Transferencia de carga tras la formación del aducto. Como se discute en la sección 6.4.2, la formación de un complejo ácido-base de Lewis da como resultado una transferencia neta de densidad electrónica desde el donador de electrones (base) al aceptor (ácido). Drago y Wong 7 ampliaron el modelo EC para incluir esa transferencia de carga agregando lo que llamaron factores de receptancia que dan cuenta de la capacidad del ácido para recibir densidad de electrones (R A) y factores de transferencia que dan cuenta de la capacidad de la base para donar densidad electrónica (T B ), dando
−ΔHAB adduct=EAEB+CACB+RATB
Esta extensión del modelo EC se llama el modelo electrostático-covalent-transferencia o ECT. Notablemente, se ha aplicado con éxito a aductos que involucran iones, para lo cual el término R A T B puede representar hasta el 31% de la energía de interacción.
- Cualquier término de energía constante, como la energía necesaria para escindir un dímero con el fin de producir el ácido de Lewis (por ejemplo, Al 2 Cl 6 → 2AlCl 3). Drago y Vogel 4 ampliaron el modelo EC para dar cabida a estos términos de energía constante, que designaron W. El modelo resultante se denomina modelo ECW, para lo cual
-∆H_{AB~adduct} = E_AE_B + C_AC_B + W \nonumber
donde
W = W_A + W_B \nonumber
Una simple aplicación de los modelos EC y EC extendida es que permiten calcular la entalpía de formación de aductos. Estos cálculos de entalpía basados en el modelo EC son consistentes con la energía de interacción superior de las interacciones duro-duro y blando en comparación con las interacciones duro-blandas. Consideremos, por ejemplo, la transferencia de I 2 entre BF 3 e InMe 3, H 3 N-BF 3, y H 3 N-InMe 3.
H_3N-BF_3 + InMe_3 ⇌ BF_3 + H_3N-InMe_3 \nonumber
Dado que H 3 N es una base dura y BF 3 e InMe 3 son ácidos más duros y blandos, respectivamente, se espera que el equilibrio favorezca al reactivo, H 3 N-BF 3. Suponiendo que el equilbrio es impulsado entálpicamente, este análisis cualitativo es consistente con la entalpía endotérmica esperada de la reacción, como puede verse a partir de las entalpías calculadas de formación de aductos tanto para H 3 N-BF 3 como para H 3 N-Inme 3.
Para H 3 N-BF 3:
-\Delta H_{H_3N-BF_3} = E_{BF_3}E_{NH_3} + C_{BF_3}C_{NH_3} \nonumber
-\Delta H_{H_3N-BF_3} = (1.62)(2.31) + (9.88)(2.04) \nonumber
-∆H_{H_3N-BF_3} = 3.74~kcal/mol + 20.1~kcal/mol = 23.8~kcal/mol \nonumber
∆H_{H_3N-BF_3} = -23.8~kcal/mol \nonumber
Para H 3 N-inme 3:
-∆H_{H_3N-InMe_3} = E_{InMe_3}E_{NH_3} + C_{InMe_3}C_{NH_3} \nonumber
-∆H_{H_3N-InMe_3} = (6.6)(2.31) + (2.15)(2.04) \nonumber
-∆H_{H_3N-InMe_3} = 15.25~kcal/mol + 4.39~kcal/mol = 19.63~kcal/mol \nonumber
∆H_{H_3N-InMe_3} = -19.63~kcal/mol \nonumber
Por lo que H 3 N-BF 3 se ve favorecido entálpicamente por -4.2 kcal/mol [=-23.8 kcal/mol - (-19.63 kcal/mol) según la Ley de Hess].
Además de su utilidad para estimar entalpías de la formación de complejos ácido-base de Lewis, la CE y los modelos relacionados sirven como una herramienta útil para estimar la importancia relativa de los factores iónicos, covalentes y estéricos en la formación de complejos. Específicamente,
- Las contribuciones relativas de los factores iónicos y covalentes se pueden calcular directamente, a partir de los términos E y C. Esto puede proporcionar una idea de por qué algunos complejos son más estables que otros. Dichos cálculos revelan que el aducto duro duro H 3 N-BF 3 se ve favorecido sobre el aducto duro-blando H 3 N-InMe 3 debido a la fuerte interacción covalente que mantiene unido a H 3 N-BF 3. El término covalente representa 84% de la energía de la interacción H 3 N-BF 3 y se pierde en gran medida tras la formación de H 3 N-InMe 3, para lo cual aporta solo 22% de la energía de interacción. Cuando se contabiliza el término electrostático, se puede observar que la formación de H 3 N-inMe 3 a partir de H 3 N-BF 3 se ve desfavorecida, ya que resultaría en una pérdida de 15.7 kcal/mol de estabilización covalente que sería compensada incompletamente por una ganancia de 11 .5 kcal/mol de estabilización electrostática.
- El papel de otras contribuciones a la unión en un complejo ácido-base de Lewis se puede estimar a partir de la discrepancia entre las energías de estabilización calculadas experimental y el modelo EC. Esto se debe a que los parámetros EC asumen unión sigma y así cualquier desviación entre las entalpías calculadas y experimentales de formación de complejos puede atribuirse a contribuciones no sigma.
- Esto se hace explícitamente en extensiones del modelo EC. Por ejemplo, en el caso de las extensiones Hancock y Martell, ECT y ECW del modelo EC, las contribuciones de los factores estéricos, de transferencia de carga y de energía constante (como la disociación de dímeros) se calculan directamente en el modelo.
- Las comparaciones de la diferencia entre las energías calculadas usando parámetros EC ordinarios y las entalpías observadas también se han utilizado como estimación del
- Energía de deformación estérica en aductos tensos, que exhiben un calor de formación de aducto menos exotérmico del esperado
- \pi-energía de unión posterior en aductos que son capaces de tales interacciones y exhiben un calor de formación más exotérmico de lo esperado. 8-10
- Para ejemplos ver (a) Drago, R. S., La interpretación de la reactividad en sistemas químicos y biológicos con el modelo E y C. Coordination Chemistry Reviews 1980, 33 (3), 251-277; (b) Drago, R. S.; Bilgrien, C. J., Transferencia inductiva y coordinación de ligandos en sistemas unidos metal—metal. Polyhedron 1988, 7 (16), 1453-1468; (c) Drago, R. S., La cuestión de una interacción sinérgica metal-metal que conduce a .pi. -estabilización de la unión posterior en aductos de tetrabutirato de dirhodio. Química Inorgánica 1982, 21 (4), 1697-1698.
- El papel de las contribuciones electrostáticas, covalentes y otras al comportamiento espectroscópico de los complejos ácido-base de Lewis se puede evaluar de manera similar usando versiones especializadas del modelo ECW o ECT que permiten el cálculo de cambios en los parámetros espectroscópicos tras la formación del aducto, por ejemplo, OH frecuencias de estiramiento. Los detalles están fuera del alcance de este texto pero pueden encontrarse en la literatura original, 11 por ejemplo, Drago, R. S.; Vogel, G. C. JACS 1992, 114 (24), 9527-9532; Vogel, G. C.; Drago, R. S., J. Chem. Educ. 1996, 73 (8), 701; Drago, R. S.; Wong, N. M., J. Chem. Educ. 1996, 73 (2), 123.).
Los parámetros de suavidad de Pearson se han propuesto como medio para calcular la constante de equilibrio para la formación de un aducto ácido-base de Lewis, aunque se utilizan más comúnmente para estimar la toxicidad del metal
Pearson también propuso un parámetro de suavidad que puede ser utilizado para estimar la termodinámica de la formación del complejo ácido-base de Lewis, esta vez en forma de la constante de equilibrio para
A + B \overset{K}{⇌} AB \nonumber
para lo que Pearson propuso
logK = S_AS_B + \sigma_A \sigma_B \nonumber
donde S A y S B son parámetros ácidos y bases relacionados con la fuerza de la interacción ácido-base\sigma_A y\sigma_B son parámetros ácidos y bases relacionados con la suavidad. Este enfoque no ha encontrado una aceptación tan amplia en estudios de reactividad química como los parámetros Drago-Wayland y dureza absoluta. Sin embargo, debido a que la toxicidad de los iones metálicos a veces depende de su propensión a unirse a bases de Lewis blandas en sistemas vivos, los parámetros de suavidad que Pearson y Mawby propusieron posteriormente basándose en las energías relativas de los enlaces flúor metálico y yodo metálico 12 han sido ampliamente utilizados como herramienta para predecir la toxicidad de iones metálicos. 13
Referencias
1. Pearson, R. G., Electronegatividad absoluta y dureza absoluta de ácidos y bases de Lewis. Revista de la American Chemical Society 1985, 107 (24), 6801-6806.
2. Pearson, R. G., Electronegatividad absoluta y dureza: aplicación a la química inorgánica. Química Inorgánica 1988, 27 (4), 734-740.
3. Drago, R. S.; Wayland, B. B., Una ecuación a doble escala para correlacionar entalpías de interacciones ácido-base de Lewis. Revista de la Sociedad Americana de Química 1965, 87 (16), 3571-3577.
4. Vogel, G. C.; Drago, R. S., El Modelo ECW. Revista de Educación Química 1996, 73 (8), 701.
5. Drago, R. S. Un enfoque moderno de la química ácido-base. Revista de Educación Química 1974, 51 (5), 300
6. Hancock, R. D.; Martell, A. E., Comportamiento Ácido-Base Duro y Suave en Solución Acuosa: Los Efectos Estéricos Hacen Duros Algunos Iones Metálicos: Una Escala Cuantitativa de Dureza-Suavidad para Ácidos y Bases. Revista de Educación Química 1996, 73 (7), 654.
7. Drago, R. S.; Wong, N. M., El papel de la transferencia de densidad electrónica y la electronegatividad en la comprensión de la reactividad química y la unión. Revista de Educación Química 1996, 73 (2), 123.
8. Drago, R. S., La interpretación de la reactividad en sistemas químicos y biológicos con el modelo E y C. Coordinación Química Reseñas 1980, 33 (3), 251-277.
9. Drago, R. S.; Bilgrien, C. J., Transferencia inductiva y coordinación de ligandos en sistemas unidos metal—metal. Poliedro 1988, 7 (16), 1453-1468.
10. Drago, R. S., La cuestión de una interacción sinérgica metal-metal que conduce a .pi. -estabilización de la unión posterior en aductos de tetrabutirato de dirhodio. Química Inorgánica 1982, 21 (4), 1697-1698.
11. Drago, R. S.; Vogel, G. C., Interpretación de los cambios espectroscópicos tras la formación de aductos y su uso para determinar parámetros electrostáticos y covalentes (E y C). Revista de la American Chemical Society 1992, 114 (24), 9527-9532.
12. Pearson, R. G.; Mawby, R. J. La naturaleza de los enlaces metal-halógeno en Gutmann, V. Halogen Chemistry, vol. 3. Prensa académica: Londres, 1967, pp. 55-84.
13. Kinraide, T. B. Escalas Mejoradas para Suavidad y Toxicidad de Iones Metálicos Toxicología y Química Ambiental 2009, 28 (3), 525-533.
Notas
* Más precisamente, los parámetros D explican la diferencia en la cepa estérica en el aducto con respecto a un aducto de agua del ácido de Lewis.

