7.7.3: Entalpías de Celosía y Ciclos Haber Born
- Page ID
- 81195
La entalpía reticular es una medida de la fuerza de las fuerzas entre los iones en un sólido iónico. Cuanto mayor es la entalpía de celosía, más fuertes serán las fuerzas. Esta página presenta entalpías de celosía (energías de celosía) y ciclos Born-Haber.
Definición de entalpía de celosía
Hay dos formas diferentes de definir la entalpía de celosía que se contradicen directamente entre sí, y encontrarás ambas de uso común. De hecho, hay una manera sencilla de resolver esto, pero muchas fuentes no lo utilizan. La entalpía reticular es una medida de la fuerza de las fuerzas entre los iones en un sólido iónico. Cuanto mayor es la entalpía de celosía, más fuertes serán las fuerzas. Esas fuerzas sólo se rompen completamente cuando los iones están presentes como iones gaseosos, dispersos tan separados que hay una atracción insignificante entre ellos. Esto se puede mostrar en un sencillo diagrama de entalpía.
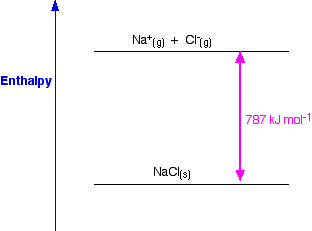
Para el cloruro de sodio, el sólido es más estable que los iones gaseosos en 787 kJ mol -1, y eso es una medida de la fuerza de las atracciones entre los iones en el sólido. Recuerde que la energía (en este caso la energía térmica) se libera cuando se hacen los enlaces, y se requiere para romper los enlaces.
Por lo que la entalpía de celosía podría describirse de cualquiera de dos maneras.
- Podría describirse como el cambio de entalpía cuando se formó 1 mol de cloruro de sodio (o lo que sea) a partir de sus iones gaseosos dispersos. En otras palabras, estás mirando una flecha hacia abajo en el diagrama.
- O bien, podría describirse como el cambio de entalpía cuando se rompe 1 mol de cloruro de sodio (o lo que sea) para formar sus iones gaseosos dispersos. En otras palabras, estás mirando una flecha hacia arriba en el diagrama.
Ambos se refieren al mismo diagrama de entalpía, pero uno lo mira desde el punto de vista de hacer la celosía, y el otro desde el punto de vista de romperlo. Desafortunadamente, ambos a menudo se describen como “entalpía de celosía”.
Definiciones
- La entalpía de disociación reticular es el cambio de entalpía necesario para convertir 1 mol de cristal sólido en sus iones gaseosos dispersos. Las entalpías de disociación de celosía son siempre positivas.
- La entalpía de formación reticular es el cambio de entalpía cuando se forma 1 mol de cristal sólido a partir de sus iones gaseosos separados. Las entalpías de formación de celosía son siempre negativas.
Se trata de una situación absurdamente confusa que se resuelve fácilmente al no usar nunca el término “entalpía de celosía” sin calificarlo.
- Deberías hablar de “entalpía de disociación de celosía” si quieres hablar de la cantidad de energía necesaria para dividir una celosía en sus iones gaseosos dispersos. Para NaCl, la entalpía de disociación reticular es +787 kJ mol -1.
- Deberías hablar de “entalpía de formación de celosía” si quieres hablar de la cantidad de energía liberada cuando se forma una celosía a partir de sus iones gaseosos dispersos. Para NaCl, la entalpía de formación reticular es -787 kJ mol -1.
Eso inmediatamente elimina cualquier posibilidad de confusión.
Factores que afectan la entalpía de celosía
Los dos factores principales que afectan a la entalpía reticular son
- Las cargas sobre los iones y
- Los radios iónicos (que afecta la distancia entre los iones).
Las cargas sobre los iones
El cloruro de sodio y el óxido de magnesio tienen exactamente las mismas disposiciones de iones en la red cristalina, pero las entalpías de la red son muy diferentes.
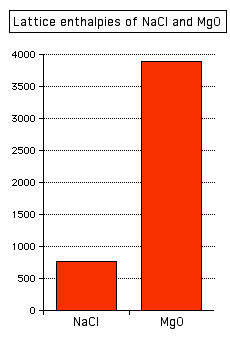
Se puede ver que la entalpía reticular del óxido de magnesio es mucho mayor que la del cloruro de sodio. Eso es porque en el óxido de magnesio, los iones 2+ están atrayendo 2- iones; en el cloruro de sodio, la atracción es solo entre 1+ y 1- iones.
El radio de los iones
La entalpía reticular del óxido de magnesio también se incrementa en relación con el cloruro de sodio porque los iones de magnesio son más pequeños que los iones de sodio, y los iones de óxido son más pequeños que los iones cloruro. Eso significa que los iones están más cerca en la celosía, y eso aumenta la fuerza de las atracciones.
Este efecto del tamaño de iones sobre la entalpía de celosía se observa claramente a medida que baja un Grupo en la Tabla Periódica. Por ejemplo, a medida que bajes por el Grupo 7 de la Tabla Periódica de flúor a yodo, esperarías que las entalpías reticulares de sus sales de sodio caigan a medida que los iones negativos se hacen más grandes, y ese es el caso:
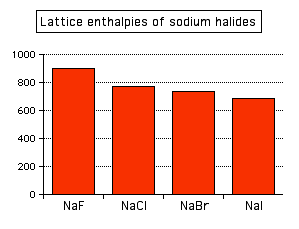
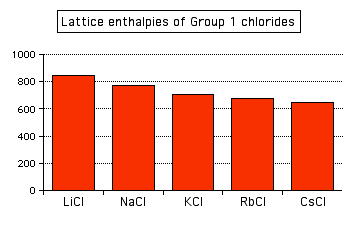
Las atracciones se rigen por las distancias entre los centros de los iones con carga opuesta, y esa distancia es obviamente mayor a medida que el ion negativo se hace más grande. Y se puede ver exactamente el mismo efecto si a medida que va bajando Grupo 1. El siguiente gráfico de barras muestra las entalpías de celosía de los cloruros del Grupo 1.
Cálculo de entalpía de celosía
Es imposible medir el cambio de entalpía partiendo de un cristal sólido y convirtiéndolo en sus iones gaseosos dispersos. Es aún más difícil imaginar cómo se podría hacer lo contrario: comenzar con iones gaseosos dispersos y medir el cambio de entalpía cuando estos se convierten en un cristal sólido. En cambio, las entalpías de celosía siempre tienen que calcularse, y hay dos formas completamente diferentes en las que esto se puede hacer.
- Se puede usar un ciclo de Ley de Hess (en este caso llamado ciclo Nacido-Haber) que implica cambios de entalpía que se pueden medir. Las entalpías de celosía calculadas de esta manera se describen como valores experimentales.
- O puedes hacer cálculos de estilo físico calculando cuánta energía se liberaría, por ejemplo, cuando los iones considerados como cargas puntuales se unen para hacer una celosía. Estos se describen como valores teóricos. De hecho, en este caso, lo que en realidad estás calculando se describen correctamente como energías de celosía.
Ciclos Nacido-Haber
Entalpías de atomización estándar
Antes de empezar a hablar de ciclos Born-Haber, necesitamos definir la entalpía de atomización,\(\Delta H^o_a\). La entalpía de atomización estándar es el cambio de entalpía cuando se forma 1 mol de átomos gaseosos a partir del elemento en su estado estándar. El cambio de entalpía de la atomización es siempre positivo. Siempre vas a tener que suministrar energía para romper un elemento en sus átomos gaseosos separados. Todas las siguientes ecuaciones representan cambios que implican entalpía de atomización:
\[ \dfrac{1}{2} Cl_2 (g) \rightarrow Cl(g) \;\;\;\; \Delta H^o_a=+122\, kJ\,mol^{-1}\]
\[ \dfrac{1}{2} Br_2 (l) \rightarrow Br(g) \;\;\;\; \Delta H^o_a=+122\, kJ\,mol^{-1}\]
\[ Na (s) \rightarrow Na(g) \;\;\;\; \Delta H^o_a=+107\, kJ\,mol^{-1}\]
Observe particularmente que el “mol -1" es por mol de átomos formados - NO por mol de elemento con el que empiezas. Muy comúnmente tendrás que escribir fracciones en el lado izquierdo de la ecuación. Hacerse esto mal es un error común.
Ejemplo\(\PageIndex{1}\): Born-Haber Cycle for \(\ce{NaCl}\)
Considere un ciclo de Born-Haber para el cloruro de sodio, y luego háblelo cuidadosamente después. Verá que arbitrariamente he decidido dibujar esto para entalpía de formación de celosía. Si quisieras dibujarlo para entalpía de disociación de celosía, la flecha roja se invertiría, apuntando hacia arriba.
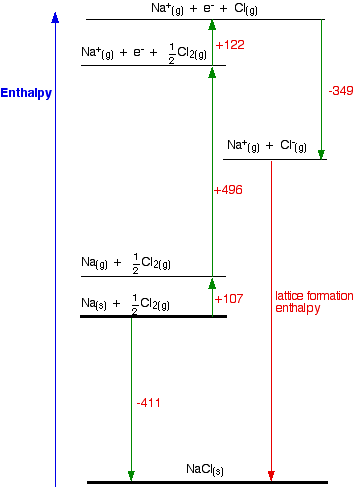
Concéntrese para empezar en la más alta de las dos líneas horizontales más gruesas. Estamos comenzando aquí con los elementos sodio y cloro en sus estados estándar. Observe que solo necesitamos medio mol de gas cloro para terminar con 1 mol de NaCl. La flecha apuntando hacia abajo de esta a la línea gruesa inferior representa el cambio de entalpía de formación de cloruro de sodio.
El ciclo Nacion-Haber imagina ahora esta formación de cloruro de sodio como ocurriendo en todo un conjunto de pequeños cambios, la mayoría de los cuales conocemos los cambios de entalpía para -excepto, por supuesto, para la entalpía de celosía que queremos calcular.
- El +107 es la entalpía de atomización del sodio. Tenemos que producir átomos gaseosos para que podamos usar la siguiente etapa del ciclo.
- El +496 es la primera energía de ionización del sodio. Recuerde que las primeras energías de ionización van de átomos gaseosos a iones positivos gaseosos de carga individual.
- El +122 es la entalpía de atomización del cloro. Nuevamente, tenemos que producir átomos gaseosos para que podamos usar la siguiente etapa en el ciclo.
- El -349 es la primera afinidad electrónica del cloro. Recuerde que las primeras afinidades electrónicas van de átomos gaseosos a iones negativos gaseosos de carga individual.
- Y finalmente, tenemos los iones gaseosos positivos y negativos que podemos convertir en el cloruro de sodio sólido usando la entalpía de formación de celosía.
Ahora podemos usar la Ley de Hess' y encontrar dos rutas diferentes alrededor del diagrama que podemos igualar. Según se dibuja, las dos rutas son obvias. El diagrama está configurado para proporcionar dos rutas diferentes entre las líneas gruesas. Entonces, del ciclo obtenemos los cálculos directamente debajo de él..
-411 = +107 + 496 + 122 - 349 + LE
LE = -411 - 107 - 496 - 122 + 349
LE = -787 kJ mol -1
¿En qué se diferenciaría esto si hubieras dibujado una entalpía de disociación de celosía en tu diagrama? Su diagrama ahora se vería así:
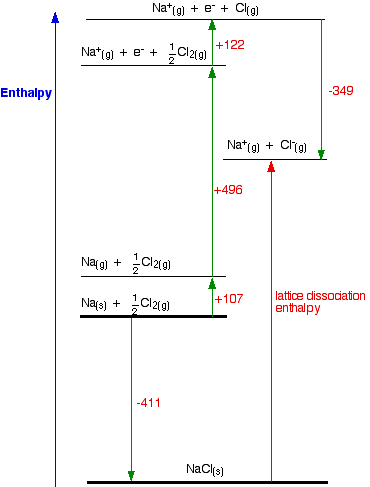
La única diferencia en el diagrama es la dirección en la que apunta la flecha de entalpía de celosía. Eso sí, por supuesto, significa que hay que encontrar dos nuevas rutas. No se puede usar el original, porque eso iría en contra del flujo de la flecha de entalpía de celosía. Esta vez ambas rutas partirían de los elementos en sus estados estándar, y terminarían en los iones gaseosos.
-411 + LE = +107 + 496 + 122 - 349
LE = +107 + 496 + 122 - 349 + 411
LE = +787 kJ mol -1
Una vez más, el ciclo ordena el signo de la entalpía de celosía.
Estimaciones Teóricas de Energías de
Supongamos que un compuesto es completamente iónico. Supongamos también que los iones son cargas puntuales, es decir, que la carga se concentra en el centro del ion. Al hacer cálculos de estilo físico, es posible calcular un valor teórico para lo que se esperaría que fuera la energía de celosía. Los cálculos de este tipo terminan con valores de energía de celosía, y no entalpía de celosía. Si sabes cómo hacerlo, entonces puedes convertir con bastante facilidad entre los dos.
Existen varias ecuaciones diferentes, de diversos grados de complicación, para calcular la energía de celosía de esta manera. Hay dos posibilidades:
- Existe un acuerdo razonable entre el valor experimental (calculado a partir de un ciclo Born-Haber) y el valor teórico. El cloruro de sodio es un caso como este -los valores teóricos y experimentales concuerdan dentro de unos pocos por ciento. Eso significa que para el cloruro de sodio, los supuestos sobre que el sólido es iónico son bastante buenos.
- Los valores experimentales y teóricos no coinciden. Un ejemplo comúnmente citado de esto es el cloruro de plata, AgCl. Dependiendo de dónde obtenga sus datos, el valor teórico para la entalpía de celosía para AgCl es de aproximadamente 50 a 150 kJ mol -1 menos que el valor que proviene de un ciclo Born-Haber. Es decir, tratar el AgCl como 100% iónico subestima bastante su entalpía reticular.
La explicación es que el cloruro de plata en realidad tiene una cantidad significativa de enlace covalente entre la plata y el cloro, debido a que no hay suficiente diferencia de electronegatividad entre los dos para permitir la transferencia completa de un electrón de la plata al cloro. Comparar valores experimentales (ciclo Born-Haber) y teóricos para entalpía reticular es una buena manera de juzgar cuán puramente iónico es un cristal.
Ejemplo\(\PageIndex{2}\): Born-Haber Cycle for \(\ce{MgCl2}\)
Se plantea la pregunta de por qué, desde el punto de vista energético, el cloruro de magnesio es MgCl 2 en lugar de MgCl o MgCl 3 (o cualquier otra fórmula que desee elegir). Resulta que MgCl 2 es la fórmula del compuesto que tiene el cambio de entalpía más negativo de formación, es decir, es el más estable en relación con los elementos magnesio y cloro.
Veamos esto en términos de ciclos de Born-Haber y contrastar el cambio de entalpía de formación para los compuestos imaginarios MgCl y MgCl 3. Eso significa que tendremos que utilizar valores teóricos de sus entalpías de celosía. No podemos usar los experimentales, porque estos compuestos obviamente no existen! Estoy tomando valores teóricos para entalpías de celosía para estos compuestos que encontré en la web. No puedo confirmarlos, pero todos los demás valores utilizados por esa fuente fueron precisos. Los valores exactos no importan demasiado de todos modos, porque los resultados son tan dramáticamente nítidos.
1. El ciclo Nacido-Haber para MgCl
Empezaremos con el compuesto MgCl, porque ese ciclo es igual que el de NaCl que ya hemos mirado.
\[ \ce{Mg(s) + 1/2 Cl_2(g) \rightarrow MgCl (s)}\]
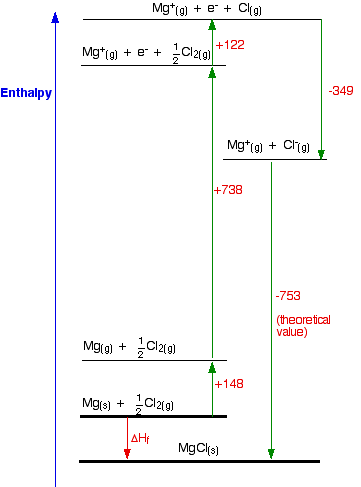
Encuentra dos rutas alrededor de esto sin ir en contra del flujo de ninguna flecha. Eso es fácil:
ΔH f = +148 + 738 + 122 - 349 - 753
ΔH f = -94 kJ mol -1
Por lo que el compuesto MgCl es definitivamente energéticamente más estable que sus elementos. He dibujado este ciclo de manera muy aproximada a escala, pero eso va a ser cada vez más difícil a medida que veamos las otras dos fórmulas posibles. Entonces voy a reescribirlo como una tabla. Se puede ver en el diagrama que el cambio de entalpía de formación se puede encontrar simplemente sumando todos los demás números en el ciclo, y podemos hacerlo igual de bien en una tabla.
| kJ | |
|---|---|
| entalpía de atomización de Mg | +148 |
| 1er IE de Mg | +738 |
| entalpía de atomización de Cl | +122 |
| afinidad electrónica de Cl | -349 |
| entalpía de celosía | -753 |
| Calculado ΔH f | -94 |
2. El ciclo Nacido-Haber para MgCl 2
La ecuación para el cambio de entalpía de formación esta vez es
\[ \ce{Mg (s) + Cl2 (g) \rightarrow MgCl2 (s)}\]
Entonces, ¿cómo cambia eso los números en el ciclo Nacido-Haber?
- Necesitas agregar en la segunda energía de ionización del magnesio, porque estás haciendo un ion 2+.
- Es necesario multiplicar la entalpía de atomización del cloro por 2, porque se necesitan 2 moles de átomos de cloro gaseoso.
- Necesitas multiplicar la afinidad electrónica del cloro por 2, porque estás haciendo 2 moles de iones cloruro.
- Obviamente necesitas un valor diferente para la entalpía de celosía.
| kJ | |
|---|---|
| entalpía de atomización de Mg | +148 |
| 1er IE de Mg | +738 |
| 2do IE de Mg | +1451 |
| entalpía de atomización de Cl (x 2) | +244 |
| afinidad electrónica de Cl (x 2) | -698 |
| entalpía de celosía | -2526 |
| Calculado ΔH f | -643 |
Puedes ver que se libera mucha más energía cuando haces MgCl 2 que cuando haces MgCl. ¿Por qué es eso? Se necesita poner más energía para ionizar el magnesio para dar un ion 2+, pero se libera mucha más energía como entalpía de celosía. Esto se debe a que hay atracciones iónicas más fuertes entre los iones 1- y 2+ iones que entre los iones 1- y 1+ en MgCl. Entonces, ¿qué pasa con MgCl 3? La energía de celosía aquí sería aún mayor.
3. El ciclo Nacido-Haber para MgCl 3
La ecuación para el cambio de entalpía de formación esta vez es
\[ \ce{Mg(s) + 3/2 Cl_2(g) \rightarrow MgCl_3 (s)}\]
Entonces, ¿cómo cambia eso los números en el ciclo Born-Haber esta vez?
- Necesitas agregar la tercera energía de ionización del magnesio, porque estás haciendo un ion 3+.
- Es necesario multiplicar la entalpía de atomización del cloro por 3, porque se necesitan 3 moles de átomos de cloro gaseoso.
- Necesitas multiplicar la afinidad electrónica del cloro por 3, porque estás haciendo 3 moles de iones cloruro.
- De nuevo necesitas un valor diferente para la entalpía de celosía.
| kJ | |
|---|---|
| entalpía de atomización de Mg | +148 |
| 1er IE de Mg | +738 |
| 2do IE de Mg | +1451 |
| 3er IE de Mg | +7733 |
| entalpía de atomización de Cl (x 3) | +366 |
| afinidad electrónica de Cl (x 3) | -1047 |
| entalpía de celosía | -5440 |
| Calculado ΔH f | +3949 |
Esta vez, el compuesto es enormemente inestable energéticamente, tanto con respecto a sus elementos, como también a otros compuestos que podrían formarse. ¡Necesitarías suministrar casi 4000 kJ para obtener 1 mol de MgCl 3 para formar!
Miren con atención la razón de esto. La entalpía reticular es la más alta para todos estos compuestos posibles, pero no es lo suficientemente alta como para suplir la muy grande tercera energía de ionización del magnesio.
¿Por qué es tan grande la tercera energía de ionización? Los dos primeros electrones que se eliminarán del magnesio provienen del nivel 3s. El tercero viene del 2p. Eso está más cerca del núcleo, y carece también de una capa de tamizado -y se necesita mucha más energía para eliminarlo. Los electrones 3s son filtrados desde el núcleo por los electrones de nivel 1 y 2 niveles. Los electrones 2p solo son cribados por el nivel 1 (más un poco de ayuda de los electrones 2s).
Conclusión
El cloruro de magnesio es MgCl 2 porque esta es la combinación de magnesio y cloro que produce el compuesto más estable energéticamente, el que tiene el cambio de entalpía más negativo de formación.
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)


