7.7.2: Energía de celosía - El ciclo Nacido-Haber
- Page ID
- 81203
Los sólidos iónicos tienden a ser compuestos muy estables. Las entalpías de formación de las moléculas iónicas no pueden explicar por sí solas esta estabilidad. Estos compuestos tienen una estabilidad adicional debido a la energía reticular de la estructura sólida. Sin embargo, la energía de la red no se puede medir directamente. El ciclo Born-Haber nos permite comprender y determinar las energías reticulares de los sólidos iónicos.
Introducción
Este módulo introducirá la idea de energía reticular, así como un proceso que nos permita calcularla: el Ciclo Nacido-Haber. Para poder utilizar el Ciclo Nacido-Haber, existen varios conceptos que debemos entender primero.
Energía de celosía
La energía de celosía es un tipo de energía potencial que puede definirse de dos maneras. En una definición, la energía reticular es la energía requerida para romper un sólido iónico y convertir sus átomos componentes en iones gaseosos. Esta definición provoca que el valor para la energía reticular sea siempre positivo, ya que esta siempre será una reacción endotérmica. La otra definición dice que la energía reticular es el proceso inverso, es decir, es la energía liberada cuando los iones gaseosos se unen para formar un sólido iónico. Como se implica en la definición, este proceso siempre será exotérmico, y así el valor para la energía reticular será negativo. Sus valores generalmente se expresan con las unidades kJ/mol.
La energía de celosía se utiliza para explicar la estabilidad de los sólidos iónicos. Algunos podrían esperar que una estructura tan ordenada sea menos estable porque la entropía del sistema sería baja. Sin embargo, la estructura cristalina permite que cada ion interactúe con múltiples iones de carga opuesta, lo que provoca un cambio altamente favorable en la entalpía del sistema. Se libera mucha energía a medida que interactúan los iones cargados opuestamente. Es esto lo que hace que los sólidos iónicos tengan puntos de fusión y ebullición tan altos. Algunos requieren temperaturas tan altas que se descomponen antes de que puedan alcanzar un punto de fusión y/o ebullición.
Ciclo Nación-Haber
Hay varios conceptos importantes a entender antes de que se pueda aplicar el Ciclo Nacido-Haber para determinar la energía reticular de un sólido iónico; energía de ionización, afinidad electrónica, energía de disociación, energía de sublimación, calor de formación y Ley de Hess.
- La energía de ionización es la energía requerida para eliminar un electrón de un átomo neutro o un ion. Este proceso siempre requiere un aporte de energía, y así siempre tendrá un valor positivo. En general, la energía de ionización aumenta a través de la tabla periódica de izquierda a derecha, y disminuye de arriba a abajo. Hay algunas excepciones, generalmente debido a la estabilidad de orbitales medio llenos y completamente llenos.
- La afinidad de electrones es la energía liberada cuando se agrega un electrón a un átomo neutro o a un ion. Por lo general, la energía liberada tendría un valor negativo, pero debido a la definición de afinidad electrónica, se escribe como un valor positivo en la mayoría de las tablas. Por lo tanto, cuando se usa en el cálculo de la energía reticular, debemos recordar restar la afinidad electrónica, no agregarla. En general, la afinidad electrónica aumenta de izquierda a derecha a través de la tabla periódica y disminuye de arriba a abajo.
- La energía de disociación es la energía requerida para descomponer un compuesto. La disociación de un compuesto es siempre un proceso endotérmico, lo que significa que siempre requerirá un aporte de energía. Por lo tanto, el cambio en la energía siempre es positivo. La magnitud de la energía de disociación depende de la electronegatividad de los átomos involucrados.
- La energía de sublimación es la energía requerida para provocar un cambio de fase de sólido a gas, evitando la fase líquida. Este es un insumo de energía, y por lo tanto tiene un valor positivo. También se puede referir como la energía de la atomización.
- El calor de la formación es el cambio en la energía al formar un compuesto a partir de sus elementos. Esto puede ser positivo o negativo, dependiendo de los átomos involucrados y de cómo interactúen.
- La Ley de Hess establece que el cambio general en la energía de un proceso puede determinarse desglosando el proceso en pasos, luego agregando los cambios en la energía de cada paso. El Ciclo Nacido-Haber es esencialmente la Ley de Hess aplicada a un sólido iónico.
Uso del ciclo Nación-Haber
Los valores utilizados en el Ciclo Nacido-Haber son todos cambios predeterminados en la entalpía para los procesos descritos en la sección anterior. La Ley de Hess nos permite sumar o restar estos valores, lo que nos permite determinar la energía reticular.
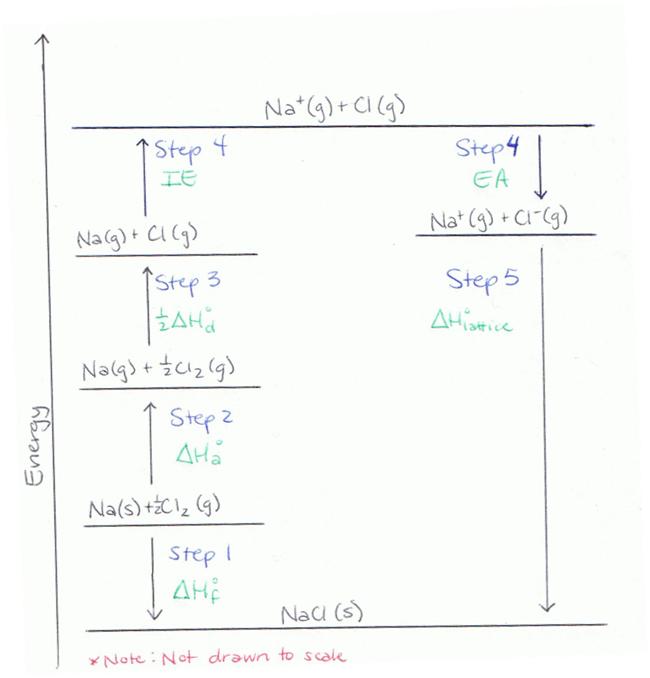
Paso 1
Determinar la energía del metal y del no metal en sus formas elementales. (Los elementos en su estado natural tienen un nivel de energía de cero.) Restar de esto el calor de formación del sólido iónico que se formaría al combinar estos elementos en la ración apropiada. Esta es la energía del sólido iónico, y se utilizará al final del proceso para determinar la energía de la red.
Paso 2
El Ciclo Nacido-Haber requiere que los elementos involucrados en la reacción estén en sus formas gaseosas. Sumar los cambios en la entalpía para convertir uno de los elementos en su estado gaseoso, y luego hacer lo mismo para el otro elemento.
Paso 3
Los metales existen en la naturaleza como átomos individuales y, por lo tanto, no es necesario agregar energía de disociación para este elemento. Sin embargo, muchos no metales existirán como especies poliatómicas. Por ejemplo, Cl existe como Cl 2 en su estado elemental. La energía requerida para cambiar Cl 2 en átomos de 2Cl debe agregarse al valor obtenido en la Etapa 2.
Paso 4
Tanto el metal como el no metálico ahora necesitan cambiarse a sus formas iónicas, ya que existirían en el sólido iónico. Para ello, se agregará la energía de ionización del metal al valor del Paso 3. A continuación, la afinidad electrónica del no metal se restará del valor anterior. Se resta porque es una liberación de energía asociada a la adición de un electrón.
*Este es un error común debido a la confusión causada por la definición de afinidad electrónica, así que ten cuidado al hacer este cálculo.
Paso 5
Ahora el metal y el no metal se combinarán para formar el sólido iónico. Esto provocará una liberación de energía, que se llama la energía de celosía. El valor para la energía de celosía es la diferencia entre el valor del Paso 1 y el valor del Paso 4.
—
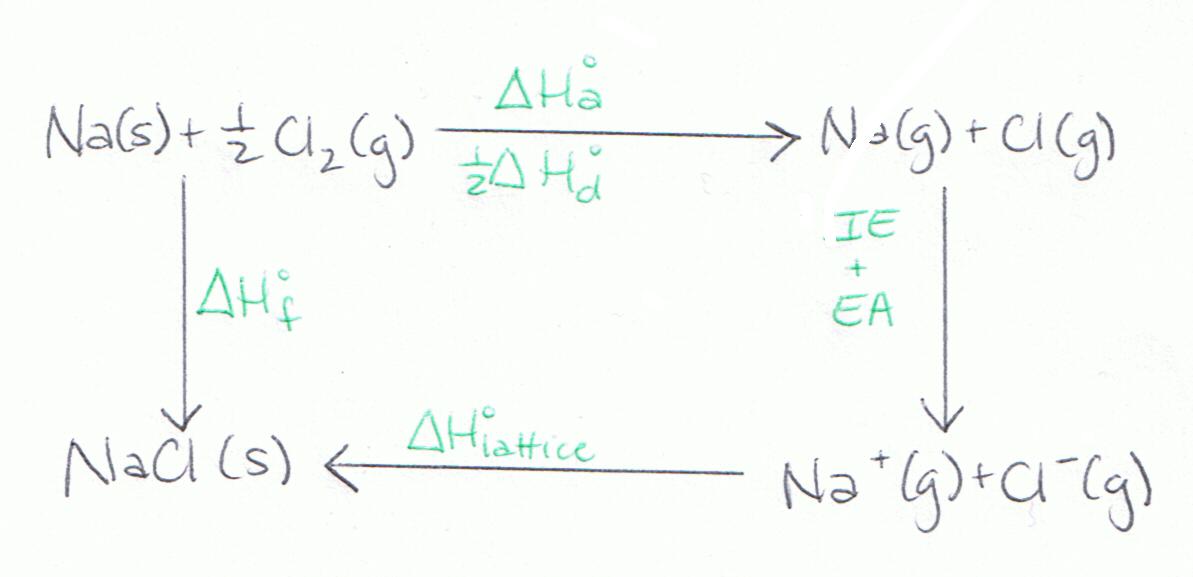
El siguiente diagrama es otra representación del Ciclo Nacido-Haber.
Ecuación
El Ciclo Nacido-Haber se puede reducir a una sola ecuación:
Calor de formación= Calor de atomización+ Energía de disociación+ (suma de energías de ionización) + (suma de afinidades de electrones) + Energía de celosía
*Nota: En esta ecuación general, se agrega la afinidad electrónica. Sin embargo, al enchufar un valor, determinar si la energía es liberada (reacción exotérmica) o absorbida (reacción endotérmica) por cada afinidad electrónica. Si se libera energía, ponga un signo negativo frente al valor; si se absorbe energía, el valor debe ser positivo.
El reordenamiento para resolver para la energía de celosía da la ecuación:
Energía de celosía= Calor de formación- Calor de atomización- Energía de disociación- (suma de energías de ionización) - (suma de afinidades de electrones)
Referencias
- Cheetham, A.K. y P. Día. Química de Estado Sólido. Oxford: Clarendon Press, 1992.
- Jenkins, H. Donald B. “La termodinámica de la relación entre la energía de celosía y la entalpía de celosía”. Revista de Educación Química. Vol. 82, P. 950-952. Coventry, West Midlands, Reino Unido: Universidad de Warwick, 2005.
- Ladd, Marcos. Estructuras Cristalinas: Celosías y Sólidos en Estereovisión. Chichester: Horwood, 1999.
- Ladd, Marcos. Adhesiones Químicas en Sólidos y Fluidos. Chichester: Horwood, 1994.
- Suzuki, Takashi. Energía libre y Partículas Autointeractuantes. Boston: Birkhauser, 2005.
Problemas
- Definir la energía reticular, la energía de ionización y la afinidad de los electrones.
- ¿Qué es la Ley de Hess'?
- Encuentra la energía de celosía de KF (s).
Nota: Los valores se pueden encontrar en tablas estándar. - Encuentra la energía reticular de MgCl 2 (s).
- ¿Cuál de las siguientes tiene la mayor energía de celosía?
- A) MgO
- B) NAc
- C) LiCl
- D) MgCl 2
- ¿Cuál de las siguientes tiene la mayor Energía de Celosía?
- NaCl
- CaCl 2
- AlCl 3
- KCl
Soluciones
- Energía reticular: La diferencia de energía entre el valor experimental esperado para la energía del sólido iónico y el valor real observado. Más específicamente, esta es la brecha de energía entre la energía de los iones gaseosos separados y la energía del sólido iónico.
Energía de ionización: El cambio de energía asociado con la eliminación de un electrón de un átomo o ion neutro.
Afinidad electrónica: La liberación de energía asociada con la adición de un electrón a un átomo o ion neutro. - La Ley de Hess establece que la energía general de una reacción puede determinarse descomponiendo el proceso en varios pasos, luego sumando los cambios en la energía de cada paso.
- Energía de celosía= [-436.68-89- (0.5*158) -418.8- (-328)] kJ/mol= -695.48 kJ/mol
- Energía de celosía= [-641.8-146-243- (737.7+1450.6) - (2*-349)] kJ/mol= -2521.1 kJ/mol
- MgO. Tiene iones con la mayor carga.
- AlCl 3. De acuerdo con las tendencias periódicas, a medida que aumenta el radio del ion, la energía de la red disminuye.
Referencias
- Ralph, William, F.Geoffrey y Jeffry. Química General. Novena ed. Nueva Jersey:Pearson Education, Inc. 2007. p500; 513-515.
- Peines, León. “Energía de celosía”. Dr. Leon L. Peines. 1999. erkki.kennesaw.edu/genchem8/ge00002.htm
- Imagen del diagrama de NaCl intro.chem.okstate.edu/1314f0... BornHaber2.GIF
- Housecroft, Catherine E. y Alan G. Sharpe. Química Inorgánica. 3ª ed. Inglaterra: Pearson Education Limited, 2008.174-175.