8.1.2: La electronegatividad aumenta y el radio disminuye hacia la parte superior izquierda de la tabla periódica, con sustituyentes extractores de electrones y con estado de oxidación
- Page ID
- 81332
Las propiedades físicas y químicas de los compuestos del grupo principal dependen en parte de la electronegatividad de los átomos involucrados.
La electronegatividad se define en cierta medida como la capacidad de los átomos para atraer electrones hacia ellos mismos en enlaces covalentes. Cuando los átomos que difieren en electronegatividad forman un enlace covalente, los electrones de enlace no se comparten por igual. En cambio, los electrones de unión son más fuertemente atraídos hacia el átomo más elctronegativo, dando como resultado un enlace polar, como se muestra en Scheme\(\PageIndex{I}\).

Debido a que la electronegatividad determina la polaridad de los enlaces y por las moléculas de extensión es uno de los determinantes clave de las propiedades químicas y físicas de los compuestos del grupo principal.
Un ejemplo clásico de la influencia de la polaridad del enlace en la reactividad involucra a los hidruros del elemento del grupo IV/14. Los hidruros de carbono como el metano y otros alcanos no reaccionan con el agua, los alcoholes y otros ácidos de Brønsted, mientras que los silanos, germanos y estannanos sí. Por ejemplo
\[ \sf{CH_4 + 4HOEt \rightarrow No~~reaction} \nonumber \]
\[ \sf{SiH_4 + 4HOEt \rightarrow Si(OEt)_4 + 4 H_2 } \nonumber \]
Esta diferencia en la reactividad refleja dos factores. El primero es cinético. La capacidad del átomo de Si más grande para añadir más fácilmente ligandos adicionales para dar un intermedio bipiramidal trigonal relativamente estable proporciona una vía de energía relativamente baja para la reacción, lo que permite que tenga lugar rápidamente.
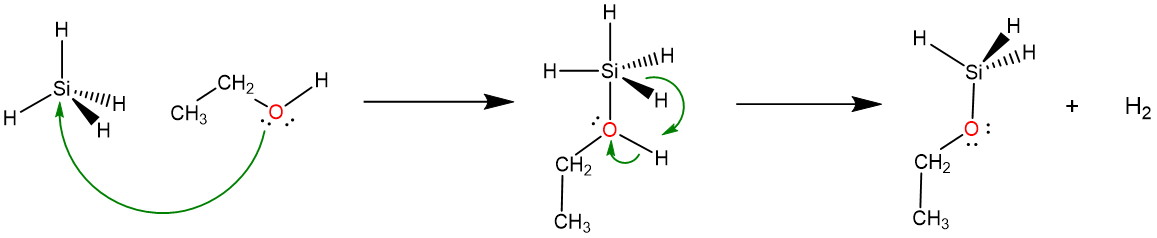 \[ \nonumber \]
\[ \nonumber \]
El segundo y mucho más importante factor que determina la diferencia de reactividad es termodinámico y tiene que ver con las polaridades de los enlaces C-H y Si-H. Estas polaridades dependen de las electronegatividades de carbono, silicio, hidrógeno y oxígeno como se representa en el Esquema\(\PageIndex{I}\). Como puede verse en la parte a del Esquema\(\PageIndex{I}\), debido a que la electronegatividad del carbono es mayor que la del H, los hidrógenos de los enlaces C-H son electrofílicos y actúan como ácidos débiles de Brønsted, volviéndolos poco reactivos hacia otros ácidos de Brønsted como los alcoholes. En contraste, como se muestra en la parte b, la electronegatividad del silicio es menor que la del H, por lo que la polarización de los enlaces Si-H facilita tanto la eliminación del Si-H\(\sf{H_2}\) y O-H como el ataque nucleofílico del etanol O en el centro de Si.
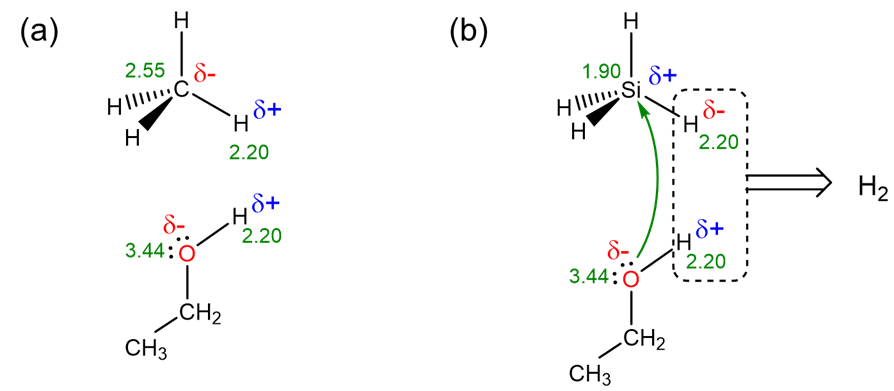
La escala Pauling es la escala más utilizada para calificar las electronegatividades.
La electronegatividad se cuantifica más comúnmente usando la escala de Pauling. La escala Pauling se basa en la observación de que los enlaces polares son generalmente más fuertes que el promedio de sus homólogos homopolares. Esto está bien ilustrado por las energías de enlace de H 2, Cl 2 y HCl dadas en la Tabla\(\PageIndex{1}\). Como puede verse en la tabla, el promedio de la energía de enlace H-H y F-F de 295.5 kJ/mol es solo 52% de la energía de enlace H-F de 567 kJ/mol.
Mesa\(\PageIndex{1}\). Energías de enlace de H 2, Cl 2 y HCl.

En este modelo mayor polaridad de enlace (mayor\( \delta^+\) y\( \delta^-\)) cuanto mayor es la “fuerza de unión excesiva”. En consecuencia, la “fuerza de unión excesiva” puede ser utilizada como una medida empírica de la diferencia entre las electronegatividades\(\chi\) de los elementos involucrados. El Pauling lo hizo usando ecuación\(\PageIndex{2}\).
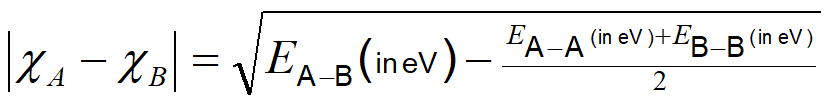 \[ \nonumber \]
\[ \nonumber \]
donde A y B son un par dado de elementos.
La ecuación sólo\(\PageIndex{2}\) puede ser utilizada para determinar diferencias en las electronegatividades. Para determinar las electronegatividades absolutas Pauling asignó la electronegatividad del elemento más electronegativo en su escala, F, un valor de 4.00, aunque para acomodar datos termoquímicos más precisos la electronegatividad de Pauling de F se ha ajustado desde entonces a 3.98. Se dan electronegatividades pauling para los elementos de la Figura\(\PageIndex{2}\).
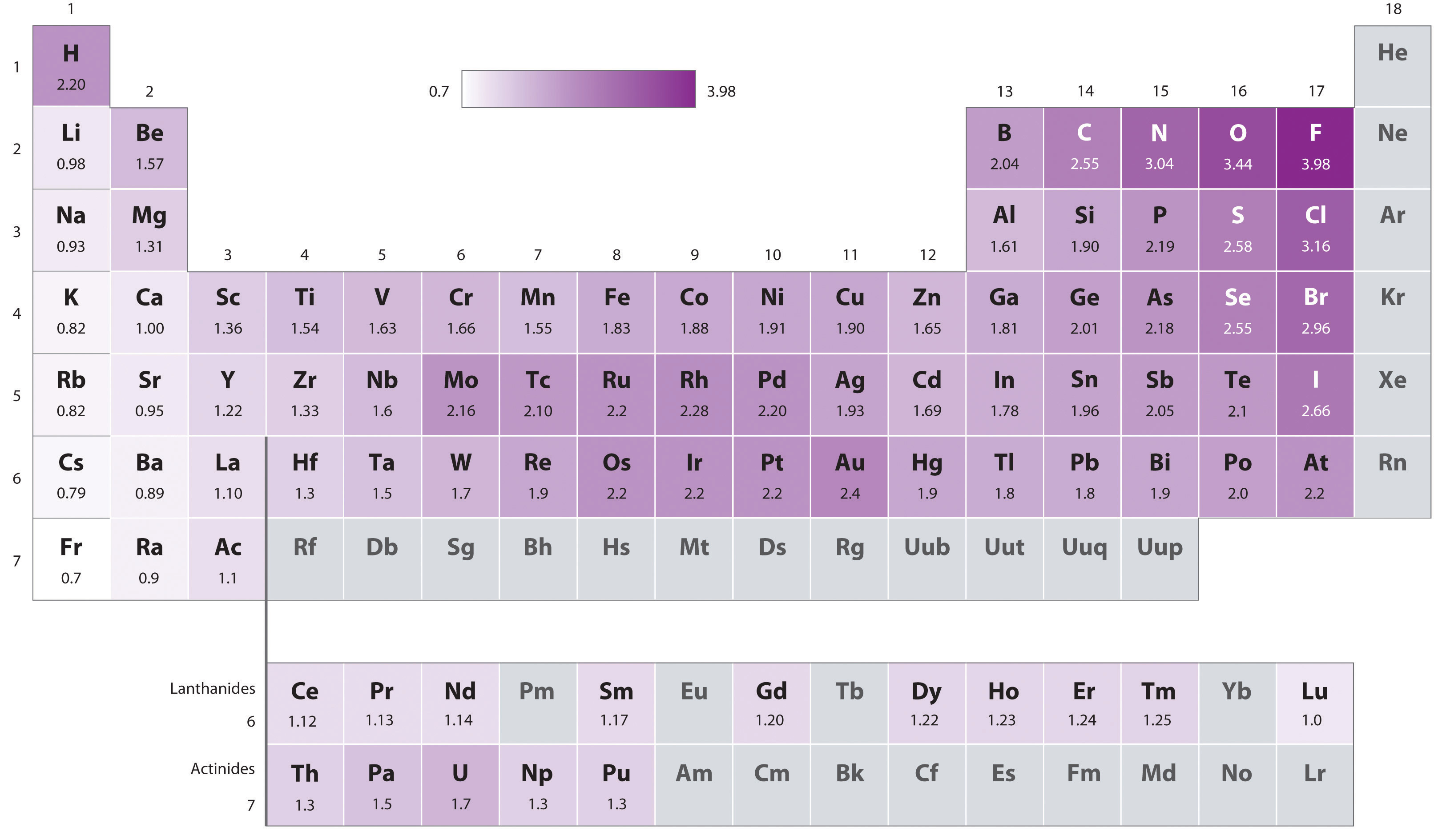
La electronegatividad generalmente aumenta a lo largo de una fila y disminuye en un grupo
Como se puede ver en los valores de electronegatividad de Pauling en la Figura\(\PageIndex{4}\), dentro del grupo principal la electronegatividad disminuye en un grupo y aumenta aproximadamente al moverse de izquierda a derecha a través de un grupo, es decir, la electronegatividad aumenta aproximadamente al moverse de la parte inferior izquierda a la superior derecha de la tabla periódica.
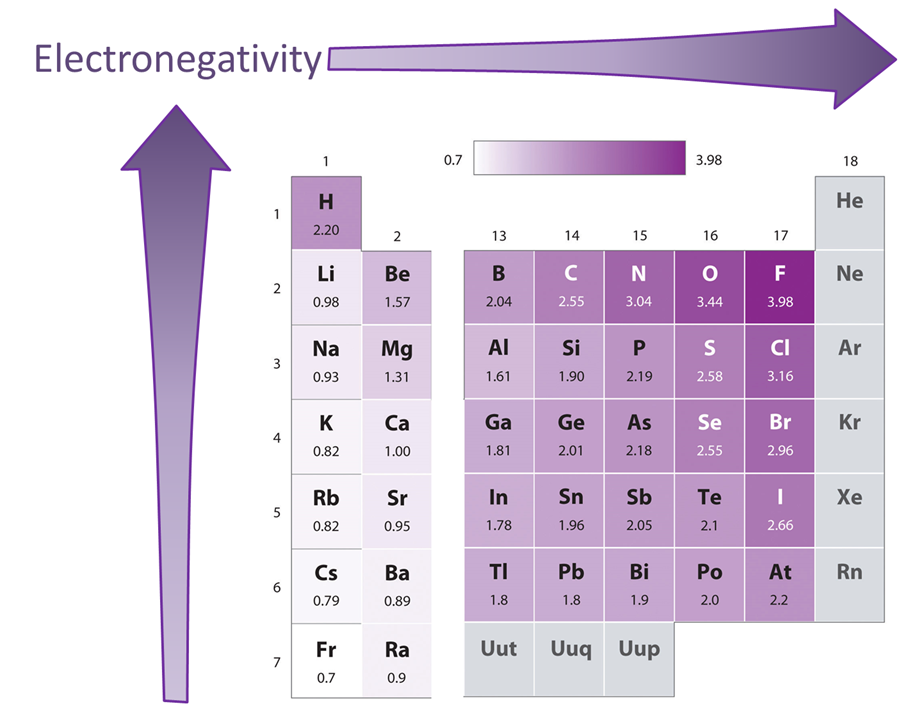
Dos factores que modifican el patrón general de electronegatividad creciente al moverse hacia la parte superior derecha de la tabla periódica.
El primero es la posición ambigua mencionada del hidrógeno. La electronegatividad del Hidrógeno sí concuerda con este patrón general si el Hidrógeno se coloca en la cabeza del grupo de metales alcalinos. Sin embargo, está sobre una unidad completa más alta que cualquier otro metal alcalino y, si se coloca en la cabeza del grupo halógeno, sería casi dos unidades más bajas que la de F.
El segundo es la reversión de la disminución esperada de la electronegatividad bajando un grupo para las parejas Al & Ga y Si & Ge. Esto se debe a que los metales posteriores a la transición tienen electronegatividades anómalas altas debido a la creciente carga nuclear efectiva asociada con el llenado del bloque d, es decir, una especie de contracción del bloque d para la electronegatividad. El efecto neto es que los elementos post transición en el bloque p tienen electronegatividades anómalas altas. En los casos de Al & Ga y Si & Ge esto da como resultado un aumento de la electronegatividad en el grupo a medida que uno se mueve de la fila 3 a la fila 4. En el caso de los demás elementos post-transición se observa en que el movimiento entre estas dos filas implica una modesta disminución de la electronegatividad.
Las tendencias de electronegatividad conducen a relaciones diagonales en las que los elementos justo a la izquierda y abajo de una columna entre sí tienen propiedades químicas similares.
El aumento de la electronegatividad a lo largo de una fila de la tabla periódica es compensado a veces por la disminución de la electronegatividad en un grupo de manera que los elementos tan diagonalmente relacionados a veces tienen electronegatividades similares. Algunos de estos elementos relacionados diagonalmente tienen propiedades físicas y químicas similares, aunque estas similitudes pueden no deberse solo al efecto de la electronegatividad. Dado que el tamaño atómico también disminuye a lo largo de una fila y aumenta un grupo, algunas similitudes reflejan los efectos de tamaño también. En todo caso, el resultado es que se reconocen relaciones diagonales de similitud química y física entre elementos diagonales entre sí en la tabla periódica. Algunas de las relaciones diagonales más prominentes dentro del grupo principal se muestran en la Figura\(\PageIndex{5}\).
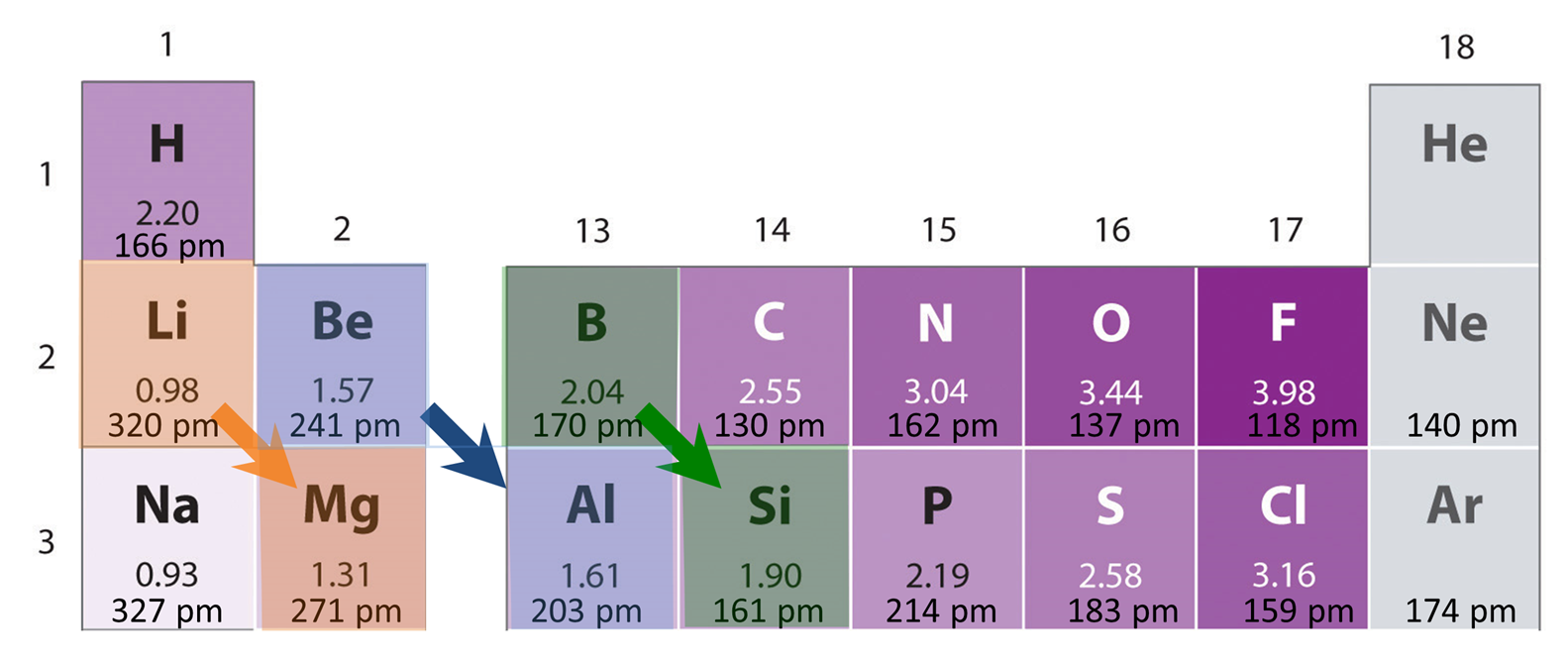
Algunas observaciones ilustran cómo funcionan estas relaciones diagonales.
- Li & Mg — El litio actúa como Mg, ya que es el único metal alcalino que forma sales estables de nitruro (Li 3 N), óxido (Li 2 O) y alquilcarbanión soluble en THF como lo hacen los metales alcalinotérreos. Esto se puede observar en los compuestos similares formados por Li y Mg mostrados en la Tabla\(\PageIndex{2}\). En contraste, los metales alcalinos más grandes forman reactivos de carbanión poliméricos insolubles, superóxidos o peróxidos y no óxidos, y nitruros extremadamente inestables.
Mesa\(\PageIndex{2}\). Compuestos similares formados por los elementos relacionados diagonalmente Li y Mg.
| Tipo de compuesto | Li | Mg |
| óxido | \(\sf{Li_2O}\) | \(\sf{MgO}\) |
| nitruro | \(\sf{Li_3N}\) | \(\sf{Mg_3N_2}\) |
| reactivo de carbanión de alquilo | alquil-litio (RLi) | Reactivo Gringard (RMg +) |
- Be & Al — En contraste con los óxidos e hidróxidos básicos de la mayoría de los metales alcalinos y el grupo más pesado 13 elementos tanto Be como Al forman óxidos e hidróxidos anfóteros (\(Table \PageIndex{3}\)). Como Be y los metales alcalinos restantes el aluminio también forma un carburo (C 4- “sal”) en lugar de un acetiluro (C 2 -) o alilido (C 3 4-).
Mesa\(\PageIndex{3}\). Comportamiento anfótero de los óxidos e hidróxidos de berilio y aluminio.
| Reacción | Be | Al |
| Hidrólisis de óxido a hidróxido | \[\sf{BeO + H_2O \rightarrow Be(OH)_2} \nonumber \] | \[\sf{Al_2O_3 + 3H_2O \rightarrow 2 Al(OH)_3} \nonumber \] |
| Hidróxido como base de Arrhenius y Brønsted |
\[\sf{Be(OH)_2 \rightarrow BeO(OH)^+ + OH^-} \nonumber \] o \[\sf{Be(OH)_2 + 2H^+ \rightarrow Be^{2+} + 2H_2O} \nonumber \] |
\[\sf{Al(OH)_3 \rightarrow 2 AlO(OH)_2^+ + OH^-} \nonumber \] o \[\sf{Al(OH)_3 + 3H^+ \rightarrow Al^{3+} + 3H_2O} \nonumber \] |
| Hidróxido como ácido de Lewis | \[\sf{Be(OH)_2 + 2OH^- \rightarrow Be(OH)_4^{2- }} \nonumber \] | \[\sf{Al(OH)_3 + OH^- \rightarrow 2 AlO(OH)_4^-} \nonumber \] |
- B & Si - Ambos elementos actúan como semiconductores, forman óxidos covalentes poliméricos complejos ácidos que contienen tetraedros EO 4 entrelazados, y sus haluros (BCl 3 y SiCl 4) actúan como haluros de ácido. En contraste, los óxidos de carbono (CO y CO 2) son monoméricos mientras que los óxidos los cogéneros más pesados de estos elementos (Al 2 O 3, Ga 2 O 3, In 2 O 3, In 2 O, Tl 2 O y GeO 2, SnO 2, PbO 2 y PbO) se consideran óxidos iónicos. Los haluros de los cogeneros más pesados de Si actúan más fácilmente como óxidos iónicos, mientras que los haluros binarios de carbono (por ejemplo, compuestos como CCl 4) generalmente no se hidrolizan fácilmente.
Las Escalas de Electronegatividad Mulliken y Allred-Rochow conectan la Electronegatividad con otras Propiedades Atómicas
Si bien la escala Pauling considera la electronegatividad en términos de unión, hay una serie de otras escalas de electronegatividad que definen la electronegatividad en función de otras propiedades atómicas. Dos de ellos serán considerados aquí: la escala Mulliken (o Mulliken-Jaffe) que define la electronegatividad en términos de afinidad electrónica y energía de ionización (y por extensión energías orbitales) y la escala Allred-Rochow considera la electronegatividad en términos de nuclear efectiva cargos.
La Escala de Electronegatividad Mulliken define la electronegatividad en términos de Afinidad Electrónica y Energía de Ionización
La definición Mulliken de electronegatividad se describió previamente en relación con la dureza absoluta y suavidad como la primera derivada de una energía de especie con respecto a los cambios en el número total de electrones,\(N_{e^-}\).
\[Mulliken~electronegativity = χ = \dfrac{d E}{dN_{e^-}} \nonumber \]
\(\sf{where~~E~~is~~in~~eV}\)
Dado que esta derivada es difícil de evaluar experimentalmente, la electronegatividad de Mulliken se aproxima típicamente como el promedio de la energía de ionización y electronegatividad de la especie.
\[Mulliken~~electronegativity = χ ≈ \dfrac{IE + EA}{2} \nonumber \]
\(\sf{where~~IE~~and~~EA~~are~~in~~eV}\)
Lo cual, si el IE es aproximado por el teorema de Koopman como lo opuesto de la energía del orbital atómico desocupado más bajo (LUAO)\(\sf{(IE = -E_{HOMO})}\) y el EA como lo opuesto de la energía liberada al absorber un electrón, puede tomarse como una aproximación de la energía LUMO.
\[E_{LUMO} ≈ -EA \nonumber \]
y la electronegatividad de Mulliken es solo el promedio de las energías HOAO y LUAO (~Energía Fermi):
\[Mulliken~electronegativity, χ ≈ -\dfrac{E_{LUAO} + E_{HOAO}}{2} \nonumber \]
\(\sf{where~~all~~values~~are~~for~~the~~gas~~phase~~atoms~~in~~units~~of~~eV}\)
La Escala de Electronegatividad Allred-Rochow define la electronegatividad en términos de la carga nuclear efectiva que experimentan los electrones de valencia.
La escala de electronegatividad Allred-Rochow intenta cuantificar la electronegatividad en términos de la fuerza electrostática que atrae los electrones de unión al centro atómico. Esto lo hace calculando la electronegatividad como la fuerza electrostática asociada.
\[ \sf{\chi_{Allred-Rochow,~raw} = - \dfrac{1}{4\pi \epsilon_0} \dfrac{e^2Z*}{r_{bond}^2}} \nonumber \]
Estos valores brutos tienen unidades de fuerza (N/electrón o dina/electrón) y no corresponden estrechamente a los valores de electronegatividad reportados en la Escala Pauling. En consecuencia, se utiliza un factor de corrección empírica para ajustar la escala para dar electronegatividades que corresponden más estrechamente a sus equivalentes Pauling.
\[ \sf{\chi_{Allred-Rochow} = 3590\dfrac{e^2Z*}{r_{bond}^2}} \nonumber \]+0.744
Las electronegatividades de Mulliken así calculadas se dan en la Tabla\(\PageIndex{4}\).
| H 2.20 |
||||||||||||||||
| Li 0.97 |
Ser 1.47 |
B 2.01 |
C 2.50 |
N 3.07 |
O 3.50 |
F 4.10 |
||||||||||
| Na 1.01 |
Mg 1.23 |
Al 1.47 |
Si 1.74 |
P 2.06 |
S 2.44 |
Cl 2.83 |
||||||||||
| K 0.91 |
Ca 1.04 |
Sc 1.20 |
Ti 1.32 |
V 1.45 |
Cr 1.56 |
Mn 1.60 |
Fe 1.64 |
Co 1.70 |
Ni 1.75 |
Cu 1.75 |
Zn 1.66 |
Ga 1.82 |
Ge 2.02 |
Como 2.20 |
Se 2.48 |
Br 2.74 |
| Rb 0.89 |
Sr 0.99 |
Y 1.11 |
Zr 1.22 |
Nb 1.23 |
Mo 1.30 |
Te 1.36 |
Ru 1.42 |
Rh 1.45 |
Pd 1.35 |
Ag 1.42 |
Cd 1.46 |
En 1.49 |
Sn 1.72 |
Sb 1.82 |
Te 2.01 |
I 2.21 |
| Cs 0.86 |
Ba 0.97 |
La 1.08 |
Hf 1.23 |
Ta 1.33 |
W 1.40 |
Re 1.46 |
Os 1.52 |
Ir 1.55 |
Pt 1.44 |
Au 1.42 |
Hg 1.44 |
Tl 1.44 |
Pb 1.55 |
Bi 1.67 |
Po 1.76 |
A 1.90 |
Estos valores se correlacionan razonablemente bien con las electronegatividades de Pauling. Una vez consecuencia de este buen acuerdo es que ambas escalas son útiles para hacer predicciones cualitativas sobre el comportamiento químico de la sustancia. Por esta razón la mayoría de los químicos siguen utilizando la báscula Pauling. En este sentido, quizás el mayor valor de la escala de electronegatividad de Mulliken y Allred-Rochow para el químico de banco radica en cómo conectan la electronegatividad con parámetros que pueden usarse para adaptar la estructura molecular y la reactividad, es decir, los efectos sustituyentes y los estados de oxidación.
La electronegatividad efectiva de un átomo varía aumenta con el estado de oxidación y en presencia de sustituyentes extractores de electrones
Una de las ventajas de los sistemas de electronegatividad Allred-Rochow y Mulliken sobre el de Pauling es que pueden considerar la electronegatividad en el contexto de compuestos, en los que los grupos donadores y retiradores de electrones modifican la capacidad de los centros atómicos para atraer electrones en un enlace. Como se consideró en el apartado de medidas de dureza, la escala Mulliken puede utilizarse para definir la electronegatividad de los centros ácidos de Lewis simplemente considerando la energía HOMO y LUMO en lugar de las energías HOAO y LUAO.
\[Mulliken~electronegativity~of~Lewis~acid, χ ≈ -\dfrac{E_{LUAO} + E_{HOAO}}{2} \nonumber \]
\(\sf{where~~all~~values~~are~~in~~units~~of~~eV}\)
La escala Allred-Rochow no suele aplicarse directamente a las moléculas. Sin embargo, su modelo de electronegatividad como medida de la fuerza electrostática experimentada por los electrones de valencia puede aplicarse a átomos en moléculas., específicamente al explicar la influencia de los sustituyentes donadores y retiradores de electrones sobre la carga nuclear efectiva que experimenta un electrón. Esto no suele hacerse de ninguna manera rigurosa y en el contexto de un curso típico de química inorgánica avanzada la influencia de los grupos sustituyentes en la electronegatividad de un átomo puede estimarse de una de dos maneras
1. El concepto de electronegatividad de grupo puede ser utilizado para estimar cuantitativamente la electronegatividad de un átomo o grupo funcional. Un grupo electronegatividad es la electronegatividad de un átomo que ha sido modificado uniéndolo a uno o más sustituyentes. Estos sustituyentes modifican la electronegatividad de la base del átomo en una cantidad igual a sus constantes de sustituyentes determinadas empíricamente para que se pueda calcular la electronegatividad del grupo, (\ chi_\ sf {grupo}\). 1
\[ \chi_\sf{group} = \chi_\sf{base} + \sigma_\sf{substituent} \nonumber \]
donde\( \chi_\sf{base}\) y\(\sigma_\sf{substituent}\) son la electronegatividad base del grupo y la constante del sustituyente, respectivamente. Debido a que la constante de los sustituyentes debe conocerse para calcular las electronegatividades del grupo, el concepto de electronegatividad del grupo se ha aplicado principalmente a los compuestos orgánicos.
2. El efecto de los sustituyentes sobre la electronegatividad puede ser racionalizado cualitativamente en términos de efectos inductivos y estado de oxidación. En este sistema
- Los grupos donadores de electrones disminuyen Z* y consecuentemente la electronegatividad efectiva de un centro; por el contrario, al aumentar la Z* experimentada por los electrones de valencia de un átomo, los grupos extractores de electrones aumentan su electronegatividad efectiva.
- cuando se oxida un centro atómico, Z* y su electronegatividad efectiva aumenta mientras que cuando se reduce Z* y su electronegatividad efectiva disminuye. Este efecto se manifiesta comúnmente como un incremento en la acidez de las unidades E-OH polarizadas a medida que aumenta el estado de oxidación del elemento central (E), como se ilustra para los oxiácidos inorgánicos en la Tabla\(\PageIndex{4}\).
Mesa\(\PageIndex{4}\). \(pK_a\)vales para oxiácidos seleccionados que ilustran el aumento de la acidez de Brønsted con estado de oxidación del átomo central. 2
| Ácido | Estado de oxidación del átomo central | \(pK_a\)(\(pK_{a1}\)a menos que se indique lo contrario) |
| H 2 SO 3 | S IV | 1.9 |
| H 2 SO 4 | S VI | <0 |
| HNO 2 | N III | 3.1 |
| HNO 3 | N V | <0 |
| H 3 PO 3 | P III | 3.1 |
| H 3 PO 4 | P V | 1.3 |
| HClO | Cl I | 7.40 |
| HClO 2 | Cl III | 1.94 |
| HClO 3 | Cl V | -2.7 (predicho) |
| HClO 4 | Cl VII | ~ -15 3 |
Referencias
1. Davis, M. A., Electronegatividad grupal y constantes de sustituyentes polares. La Revista de Química Orgánica 1967, 32 (4), 1161-1163.
2. Todos\(pK_a\) los valores con excepción del de HClO 4 y HClO 3 se toman de Perrin, D. D., Ionization Constants of Inorganic Acids and Bases in Aqueful Solution, Segunda Edición, Pergamon, Oxford, 1982.
3. El\(pK_a\) valor de HClO 4 se toma de Trummal, A.; Lipping, L.; Kaljurand, I.; Koppel, I. A.; Leito, I., Acidez de ácidos fuertes en agua y dimetilsulfóxido. La Revista de Química Física A 2016, 120 (20), 3663-3669.
Colaboradores y Atribuciones
Stephen M. Conakes, Westmont College
Todos los dibujos de líneas de esta página son de Stephen Conakes y tienen licencia bajo una Licencia Creative Commons Atribución 4.0 Internacional.
En la medida en que sea posible hacerlo, todas las cifras modificadas en esta página hechas por Stephen Conakes están bajo una Licencia Creative Commons Atribución 4.0 Internacional.

