8.1.3: La energía de ionización aumenta aproximadamente hacia la parte superior izquierda de la tabla periódica, pero también está influenciada por la energía orbital y los efectos de energía de emparejamiento
- Page ID
- 81344
Al igual que con la electronegatividad, la elenergía de ioniación de los elementos del grupo principal (Figura\(\PageIndex{1}\)) disminuye en un grupo y aumenta de izquierda a derecha a través de la tabla periódica.

Como puede verse en la Figura, la energía de\(\PageIndex{1}\) ionización no aumenta de manera constante de izquierda a derecha a través de un grupo. En cambio hay dos discontinuidades. Estas discontinuidades se resumen en la Figura\(\PageIndex{2}\).
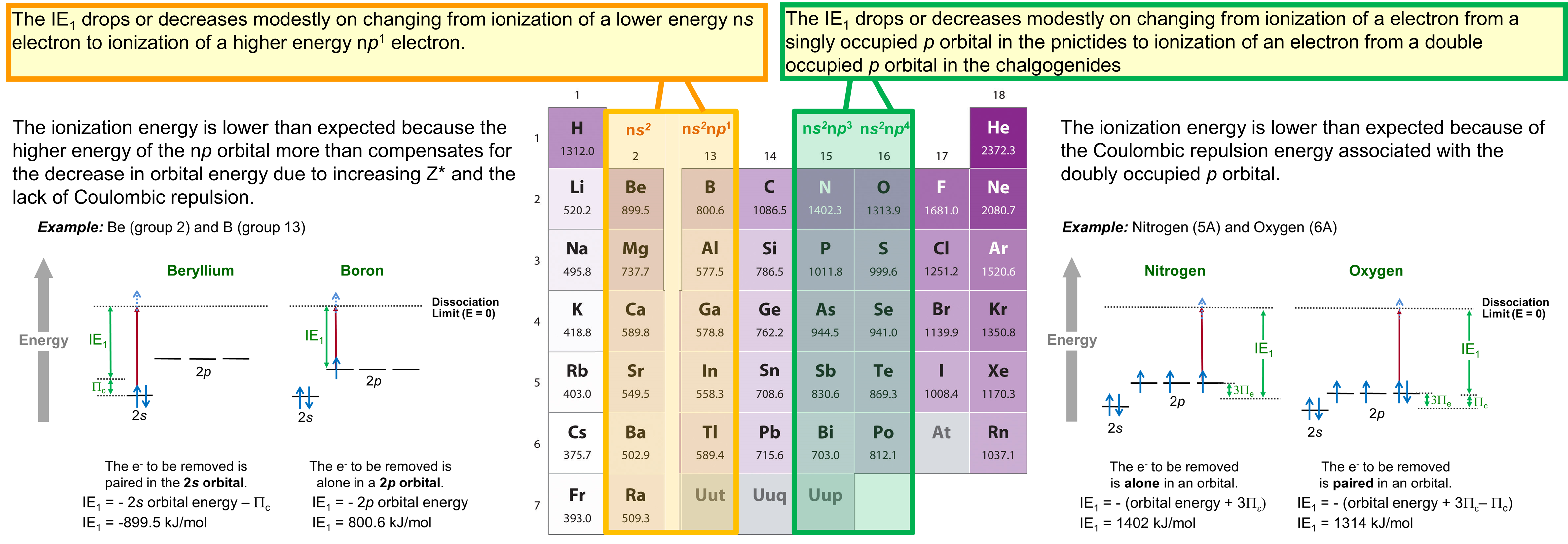
Brevemente, las dos discontinuidades son las siguientes:
- Hay una disminución o escaso incremento en la energía de ionización que se produce al pasar de los metales alcalinotérreos al grupo del boro, lo cual es causado por el cambio en la órbita ocupada más alta de una subcapa de energía menor n s a una subcapa de energía mayor n p.
- Hay una disminución o incremento anómalo modesto en la energía de ionización al pasar de los pnictidos a los calcoenidos causado por la presencia de repulsión coulómbica en la configuración calcogenuro n p 4 que no está presente en la configuración pnictida n p 3.
Estas discontinuidades ilustran cómo se deben considerar los efectos de la energía orbital y la configuración electrónica al considerar la reactividad de los elementos.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

