8.1.4: Como puede verse al considerar los diagramas redox de los elementos, los elementos del grupo principal (aparte de los gases nobles) generalmente son más oxidantes hacia la parte superior izquierda de la tabla periódica y más reductores hacia la parte inferior derecha de la tabla periódica
- Page ID
- 81351
Ya se ha discutido la existencia de relaciones diagonales entre los elementos de la tabla periódica y las propiedades únicas de los elementos de la primera y segunda fila. Así, antes de comenzar un estudio de la química descriptiva de los elementos solo queda describir las tendencias generales asociadas a las propiedades redox de los elementos y presentar varias herramientas conceptuales y gráficas que permitan captar rápidamente las características generales de la química redox de cada elemento. Éstos son el tema de la presente sección.
Los elementos a la izquierda de la tabla periódica tienden a actuar como reductores; los de la derecha como oxidantes
La capacidad de los elementos para actuar como oxidantes y reductores generalmente se describe citando los potenciales de reducción asociados con las reacciones que experimentan en solución. Así, antes de considerar las tendencias en las propiedades redox de los elementos principales del grupo, esta sección comenzará señalando cómo funcionan los potenciales redox y qué representan.
Los potenciales de reducción estándar de sustancias describen la propensión termodinámica de una sustancia a sufrir reducción.
Los potenciales redox representan el potencial termodinámico para que la sustancia sufra reducción en relación con el electrodo de hidrógeno estándar ideal (SHE).
\[2H^+(aq) + 2e^- \rightarrow H_2(g) ~~~~ E^{\circ} = 0.00V \nonumber \]
La capacidad de una sustancia para actuar como oxidante o reductor se describe por el potencial de reducción estándar relevante. Estos corresponden a reacciones de la forma
\[ \sf{\underset{reductant}{{substance}_{ox}(solv)} ~~+~~} ne^- \rightarrow \underset{oxidant}{{substance}_{red}(solv)} \nonumber \]
Hay tres cosas a tener en cuenta sobre estos potenciales de reducción estándar.
1. Los potenciales de reducción estándar siempre corresponden a la reducción de un oxidante para dar un reductor. En consecuencia,
- Los oxidantes termodinámicamente mejores tienen más potenciales de reducción estándar positivos
- Los reductores termodinámicamente mejores corresponden a los productos de reacciones de reducción estándar con potenciales de reducción estándar más negativos (Figura\ {\ PageIndex {1}\).
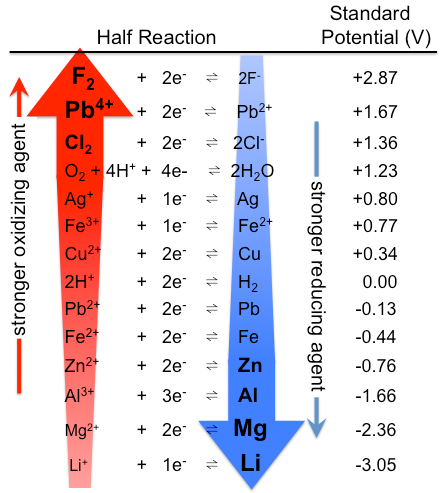
2. Dado que los potenciales de reducción\(\Delta G^{\circ} = -nFE^{\circ}\) estándar son una medida de la espontaneidad termodinámica de una reducción relativa a la oxidación de H 2 (g). Como tales potenciales de reducción son útiles para determinar si una reacción puede ocurrir pero no son útiles para determinar si una reacción realmente ocurrirá bajo un conjunto dado de condiciones. También se debe considerar la cinética de la reducción. Por ejemplo, el nitrato termodinámicamente es un poderoso oxidante en solución acuosa
\[2NO_3^-(aq) + 12H^+ + 10e^- \rightarrow N_2(g) + 6H_2O(l) ~~~~E^{\circ} = 6.229 V! \nonumber \]
Sin embargo, en solución existe una gran barrera cinética para la reducción de nitrato y generalmente funciona como un ion espectador inerte incluso cuando están presentes reductores fuertes.
3. Dado que los potenciales de reducción son cantidades termodinámicas, dependen de la estabilidad tanto de sus formas oxidadas como reducidas. Para las reacciones que involucran especies solubles en solución, estas estabilidades dependen a su vez de la energía de solvatación y de las especies en fase de solución involucradas. Por esta razón no existe tal cosa como el potencial de una sustancia dada para actuar como oxidante o reductor. Siempre deben especificarse en relación con un conjunto dado de condiciones.
La mayoría de los potenciales redox tablulados corresponden a oxidaciones y reducciones que tienen lugar en soluciones acuosas. Además, para las reacciones que implican la ganancia o pérdida de protones (u OH -) probablemente corresponden a reacciones que tienen lugar en solución 1.0 M H + (o, menos comúnmente 1.0 M OH -). Dichos potenciales pueden no corresponder estrechamente a los que tienen lugar en disolventes no acuosos o en agua a otros valores del pH. Sin embargo, con estas advertencias es posible reconocer tendencias aproximadas en las propiedades redox de los elementos.
Hay tres tendencias en las propiedades redox de los elementos
Thre propiedades redox de los elementos siguen muy aproximadamente tres tendencias generales:
1. Los gases nobles son inertes y como elementos tienden a no actuar como buenos oxidantes o reductores
De lo contrario
2. A medida que uno se mueve hacia la izquierda de la tabla periódica, los elementos tienden a actuar como buenos reductores mientras que los que están hacia la derecha tienden a actuar como oxidantes cada vez más buenos.
3. A medida que se mueve hacia abajo, un grupo de los elementos de la tabla periódica tienden a actuar como oxidantes más débiles o mejores reductores.
Estas tendencias se resumen en la Figura\(\PageIndex{2}\).
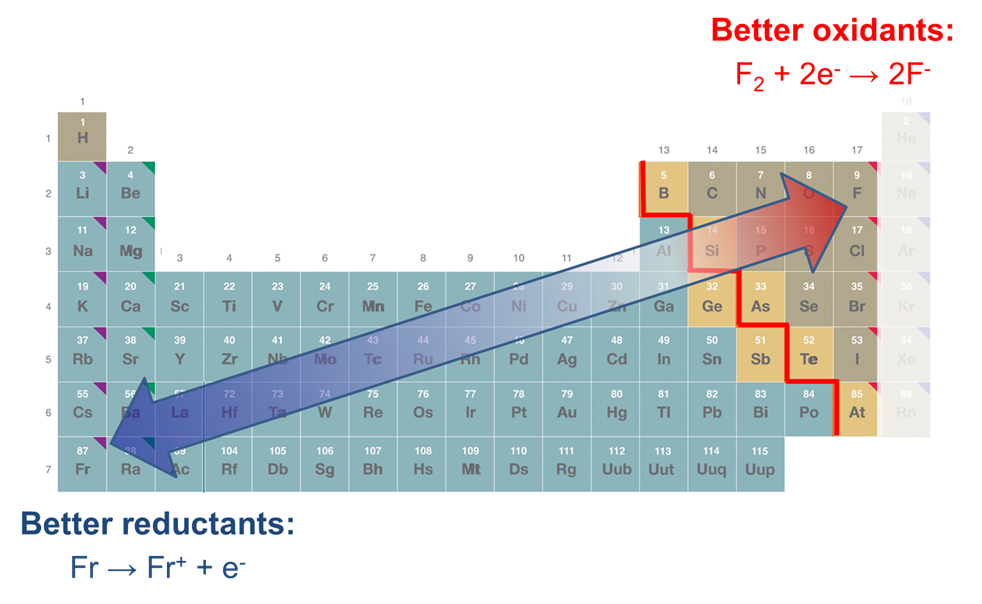
Dado que la capacidad de las sustancias para actuar como oxidantes y reductores también depende de la estabilidad de sus productos de oxidación y reducción, estas tendencias deben considerarse como, en el mejor de los casos, aproximadas. Como se puede apreciar en la Tabla\(\PageIndex{1}\), los metales alcalinos proporcionan una importante excepción a la tendencia general de que las sustancias se vuelven más reductoras hacia la parte inferior izquierda de la tabla periódica. Entre los elementos incluidos 2 Litio y no Cesio es el agente reductor más potente debido a la alta estabilidad del catión Litio en solución acuosa (energía de hidratación anómala alta). Además, de los potenciales dados en la Tabla también\(\PageIndex{1}\) se puede observar que al pasar de K + a Rb + y Cs + los potenciales de reducción no disminuyen sino que permanecen aproximadamente constantes. En este caso la disminución de la energía de ionización a lo largo de esta serie es compensada por un conjunto de factores similares. 3
Mesa\(\PageIndex{1}\). Potenciales de reducción estándar de cationes acuosos de metales alcalinos.
| Reducción | \(E^{\circ}\) |
| Li + (aq) + e-\(\rightarrow\) Li (s) | -3.040 |
| Na + (aq) + e-\(\rightarrow\) Na (s) | -2.713 |
| K + (aq) + e-\(\rightarrow\) K (s) | -2.924 |
| Rb + (aq) + e-\(\rightarrow\) Rb (s) | -2.924 |
| Cs + (aq) + e-\(\rightarrow\) Cs (s) | -2.923 |
No solo hay excepciones a las tendencias generales en las propiedades redox de los elementos libres, muchos elementos exhiben una rica e interesante química redox que implica la interconversión de múltiples especies que poseen diferentes estados de oxidación. Para darle sentido a estos será útil hacer uso de las herramientas esquemáticas y gráficas que se desarrollarán en las siguientes secciones.
Referencias y notas
A menos que se indique lo contrario todos los potenciales de reducción se toman de la referencia 1.
1. Bard, A. J.; Parsons, R.; Jordan, J. Potenciales estándar en solución acuosa. M. Dekker: Nueva York, 1985.
2. El francio no está incluido porque es un elemento inestable y no se conoce su potencial de reducción.
3. Estos factores están fuera del alcance de la presente sección pero implican cambios en la diferencia entre la energía libre de cohesión del metal y la energía libre de hidratación de su monocación.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

