8.1.4.1: Los diagramas Latimer resumen las propiedades redox de los elementos en una sola línea
- Page ID
- 81359
Los diagramas Latimer resumen amablemente la química redox de los elementos en un formato compacto
Para ver cómo funcionan los diagramas Latimer y por qué son tan útiles es útil comenzar con un ejemplo.
Una selección de las reacciones redox que se sabe que experimenta nitrógeno en ácido acuoso 1.0 M se dan en el Esquema\(\PageIndex{Ia}\).
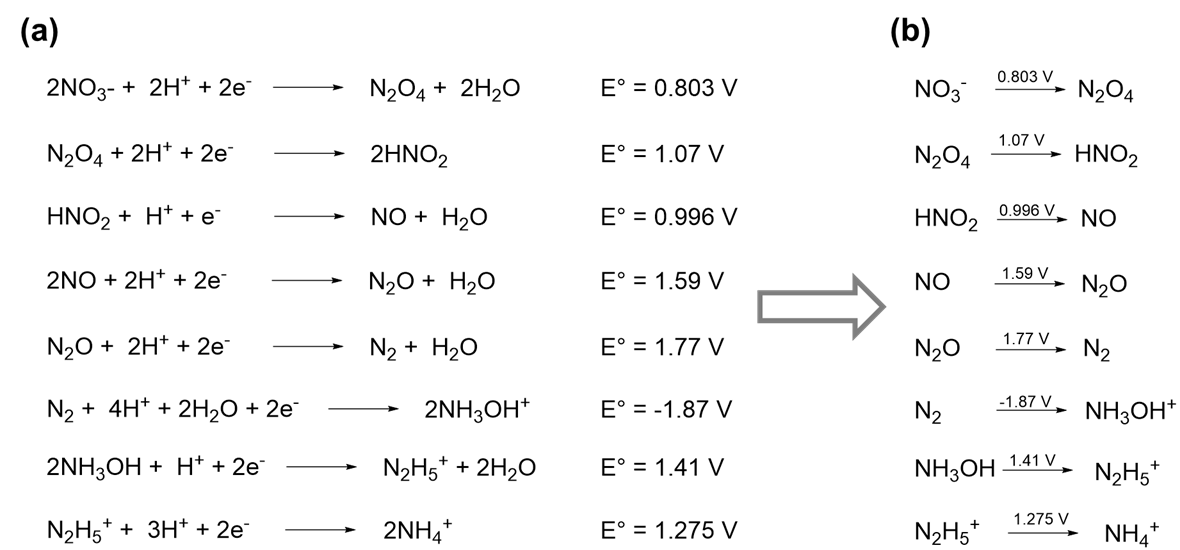
La información más importante en Scheme\(\PageIndex{Ia}\) son los potenciales redox y la identidad de cada especie que contiene nitrógeno. De hecho, si se conocen estos últimos el número de electrones-, moléculas de agua, y cualquier H + (en ácido) u OH - (en base) involucrado en la reducción se puede deducir de la estequiometría de la reacción. En consecuencia, la información en esquema\(\PageIndex{Ia}\) puede presentarse de manera más compacta dando solo las especies que contienen nitrógeno y escribiendo el potencial redox asociado para cada reacción por encima de su flecha de reacción, como se muestra en el Esquema\(\PageIndex{Ib}\). Observe que en\(\PageIndex{Ib}\) el Esquema el producto de cada media reacción es el reactivo en la siguiente. Debido a esto es posible representar la secuencia completa de reacciones redox aún más compactamente escribiendo las reacciones en una sola línea, como se muestra en el Esquema II.
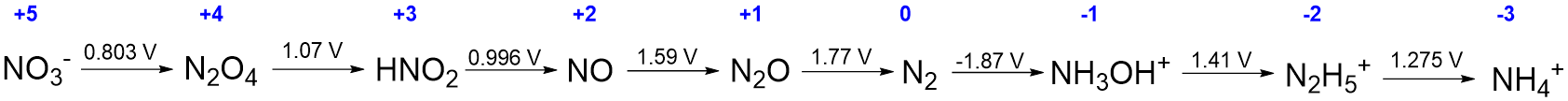
El tipo de diagrama que se muestra en Scheme\(\sf{\PageIndex{II}}\) se llama diagrama Latimer. Al interpretar diagramas Latimer puede ser útil buscar dos piezas de información.
- Se debe especificar si el diagrama corresponde a condiciones ácidas (pH 0), básicas (pH 14) u otras condiciones de solución. En los casos en que no es costumbre suponer que el diagrama se refiere al comportamiento en solución acuosa de pH 0.
- El estado de oxidación del elemento, lo que facilita el seguimiento del número de electrones involucrados en cada reducción y comparar el comportamiento redox de especies relacionadas. Los estados de oxidación se escriben comúnmente sobre cada especie química, como se hace en azul en el Esquema\(\PageIndex{II}\)
Cuando hay múltiples vías disponibles para interconvertir dos especies en un diagrama de Latimer, estas se pueden incluir agregando flechas de reacción por encima y por debajo de la línea. Esto es evidente a partir del diagrama Latimer de pH 0 completo para nitrógeno dado en el Esquema\(\PageIndex{III}\).
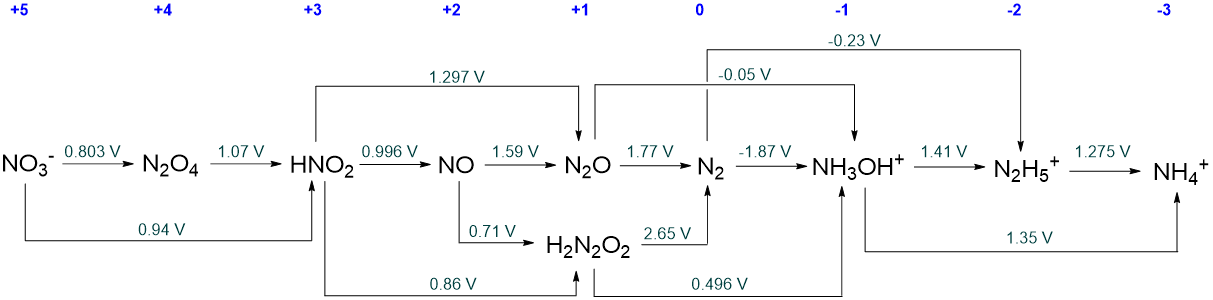
El diagrama en Scheme\(\sf{\PageIndex{III}}\) presenta un gran número de posibles interconversiones. Sin embargo, no se representa toda interconversión posible. Por ejemplo, no se presenta el potencial de reducción para la reducción de N 2 O 4 a NO. Este tipo de selectividad es común en los diagramas Latimer pero no significa necesariamente que las conversiones faltantes no sean posibles o que el potencial no se haya medido experimentalmente. Dado que\(\sf{\Delta G^{\circ} = -nFE^{\circ}}\) los potenciales en los diagramas Latimer son cantidades termodinámicas y siempre pueden calcularse a partir de parámetros termodinámicos de solución. De hecho, algunos potenciales redox reportados en diagramas Latimer solo se han determinado de esa manera. Un ejemplo es el potencial de reducción de la flourina,
\[\sf{F_2(g)~~+~~2H^+~~2e^-~\rightarrow~~2HF~~~E^{\circ}~=~3.053~V~~in~~acid}\nonumber \]
Este potencial no se ha medido experimentalmente ya que F 2 es inestable en solución acuosa, reaccionando rápidamente para dar HF y O 2.
\[\sf{2~F_2~~+~~2~H_2O~~\xrightarrow{fast}~~4~HF~+ O_2}\nonumber \]
Cuando falta un potencial en un diagrama de Latimer, siempre se puede calcular construyendo un ciclo termodinámico que involucre los potenciales conocidos y desconocidos, como se explica en Nota\(\sf{\PageIndex{1}}\) al final de esta página.
Los diagramas Latimer permiten también son útiles para comparar las propiedades redox de los elementos y determinar si una sustancia es estable a la desproporción.
Los diagramas Latimer no solo proporcionan un resumen compacto de la química redox de un elemento, sino que también son útiles para
1. Determinar si una especie es termodinámicamente inestable con respecto a la desproción.
La desproción ocurre cuando una especie reacciona consigo misma para producir dos o más productos estables. Por ejemplo, en solución básica ReO 3 puede sufrir desproción a ReO 4 - y ReO 2 ·2H 2 O.
\[\sf{2Re^{VI}O_3 + 2H_2O \rightarrow Re^{VII}O_4^- + Re^VO_2\cdot2H_2O}\nonumber \]
Al igual que con todas las reacciones redox, las reacciones de desproción se ven favorecidas termodinámicamente cuando poseen un potencial de reacción positivo. Para ver cuándo será este el caso, es útil separar la reacción de desproción en sus medias reacciones:
\[\sf{Reduction: Re^{VI}O_3 + H_2O + 2H^+ e^- \rightarrow Re^VO_2\cdot2H_2O~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~E^{\circ}=-0.446 V}\nonumber \]
\[\sf{Oxidation: Re^{VI}O_3 + H_2O \rightarrow Re^{VII}O_4^- + 2H^+ + e^-~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~E^{\circ}=+0.889 V}\nonumber \]
\[\sf{Sum: 2Re^{VI}O_3 + 2H_2O \rightarrow Re^{VII}O_4^- + Re^VO_2\cdot2H_2O~~~~~~~~E^{\circ}=-0.446 V + 0.889 V = +0.443 V}\nonumber \]
Observe que la desproción de ReO 3 en solución básica se ve favorecida porque el potencial de reacción favorable para la oxidación de ReO 3 es mayor en magnitud que el potencial de oxidación negativo para la reducción de ReO 3.
La reacción de desproporción de ReO 3 es un caso específico de un caso general. Cualquier especie que posea un potencial de reducción estándar que sea más positivo que el potencial de reducción estándar que conduzca a su formación es termodinámicamente inestable con respecto a la desproporción. Esta situación es fácil de reconocer usando un diagrama de Latimer; las especies son inestables a la desproporción si el potencial a su derecha es más positivo que el de su izquierda.
El diagrama Latimer que se ha reportado para Cr en solución acuosa de pH 14 se da a continuación. ¿Cuáles, si las hay, son inestables con respecto a la desproción?
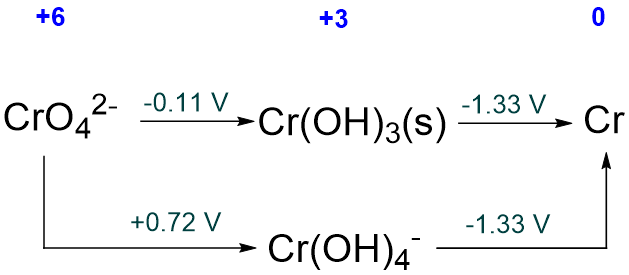
Solución
Todas las especies son estables con respecto a la desproción ya que todos los potenciales a la derecha de todos los intermedios Cr 3 + son menores que los de su izquierda.
El diagrama Latimer para Cr en solución acuosa de pH 0 se da a continuación. ¿Cuáles, si las hay, son inestables con respecto a la desproción?
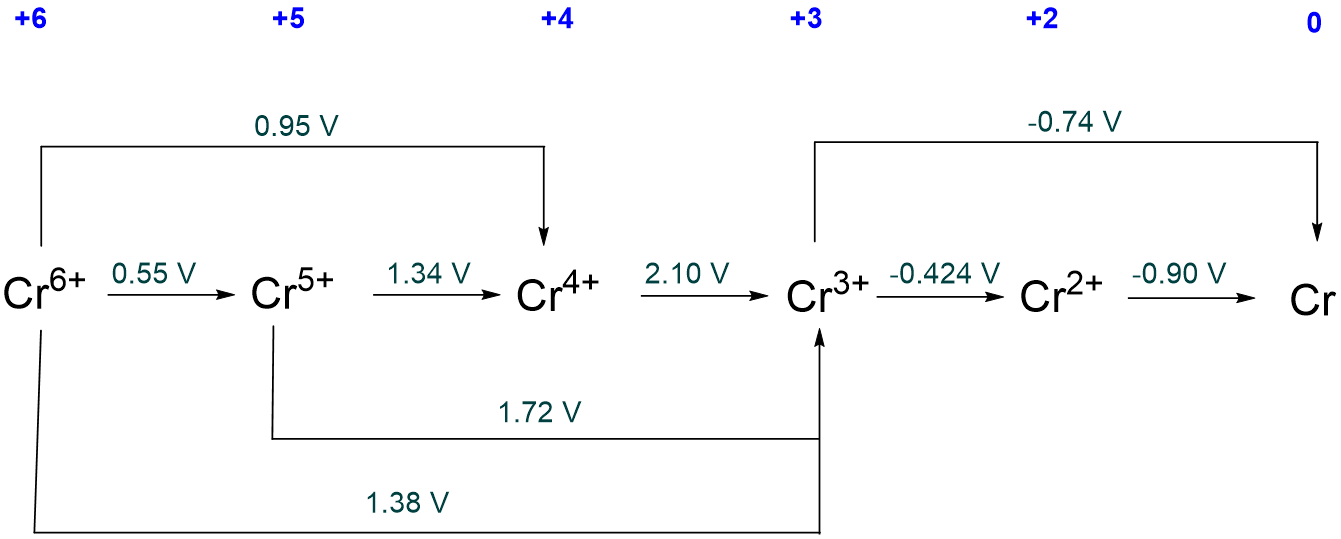
Solución
Tanto Cr 5 + como Cr 4 + son inestables hacia la desproción ya que los potenciales a su derecha (para su reducción) son mayores que los potenciales de su izquierda (para su formación por reducción).
¿Qué especies de manganeso son inestables con respecto a la desproporción en solución acuosa bajo condiciones ácidas y básicas? ¿Qué dará cada una de estas especies metaestables sobre la desproporción? Los diagramas Latimer para manganeso se dan a continuación.
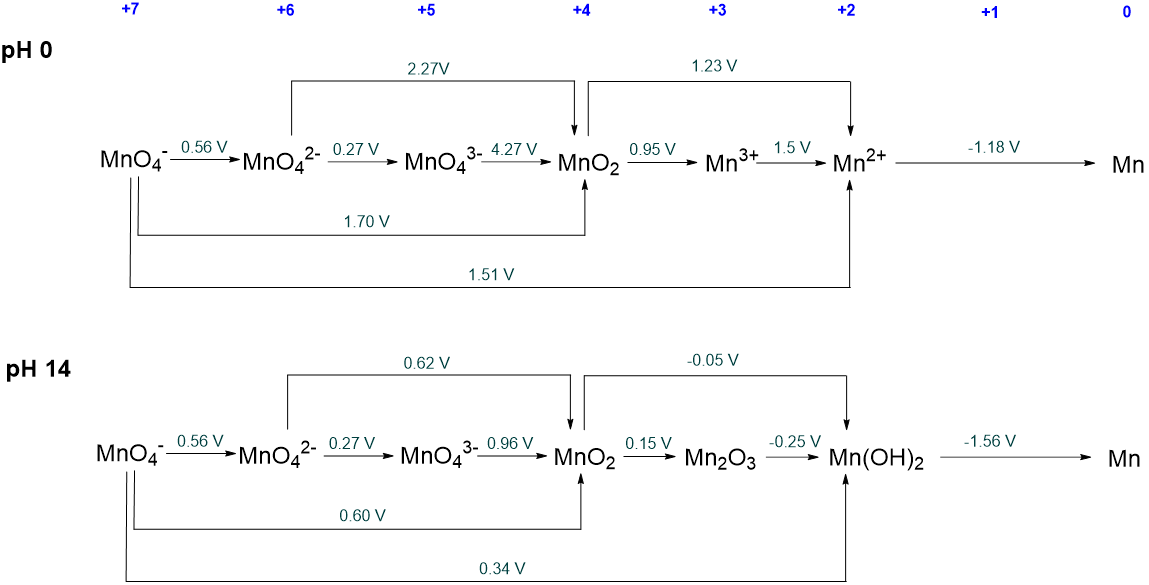
Solución
En condiciones ácidas las siguientes especies son inestables con respecto a la desproprción:
- MnO 4 2 - es inestable con respecto a la desproprtionation a MnO 4 - y MnO 2.
- MnO 4 3 - es inestable con respecto a MnO 4 2 - y MnO 2. Sin embargo, dado que MnO 4 2 - es inestable con respecto a la desproprtionation los poductos finales de la desproprtionation serán MnO 4 - y MnO 2.
- Mn 3 + es inestable hacia la desproprción a MnO 2 y Mn 2 +.
En condiciones básicas las siguientes especies son inestables con respecto a la desproprción:
- MnO 4 2 - es inestable con respecto a la desproprtionation a MnO 4 - y MnO 2.
- MnO 4 3 - es inestable con respecto a MnO 4 2 - y MnO 2. Sin embargo, dado que MnO 4 2 - es inestable con respecto a la desproprtionation los poductos finales de la desproprtionation serán MnO 4 - y MnO 2.
Observe que el estado de oxidación +3 del Mn es estable en condiciones básicas pero no ácidas.
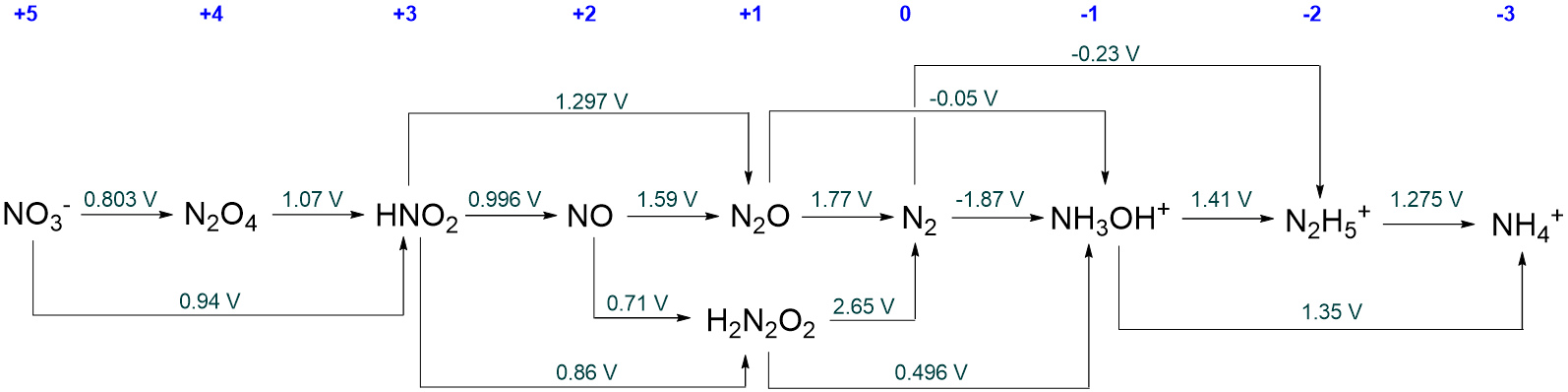
- Responder
-
Serán todas las especies intermedias para las que el potencial redox a su derecha es más positivo que el de su izquierda. Estos son N 2 O 4, HNO 2, NO, N 2 O, H 2 N 2 O 2, y NH 3 OH +.
En la medida de lo que pueda, determine a qué se despropondrá cada speices de nitrógeno metaestable a pH 0.
- Responder
-
Inicialmente las especies metaestables se despromocionarán para dar a sus vecinos inmediatos en el diagrama de Latimer.
Sin embargo, muchos de estos vecinos son metaestables en lo que respecta a la desproprtionation y por lo tanto, en última instancia, la desproprtionation solo se detendrá cuando se alcancen especies que son estables hacia la desproprtionation.
En el caso de N 2 O 4, HNO 2, NO, N 2 O, y H 2 N 2 O 2 desproprtionation finalmente dará NO 3 - y N 2.
Para NH 3 OH + desproprtionation dará N 2 y N 2 H 5 .
2. Comparar la química redox de un elemento bajo diferentes condiciones (típicamente pH 0 y pH 14). Esto está bien ilustrado por los diagramas Latimer de Chromium explorados en Ejemplos\(\PageIndex{1}\) y\(\PageIndex{2}\). Una instancia simple involucra los diagramas Latimer ácidos y básicos de mercurio mostrados en Scheme\(\PageIndex{IV}\).
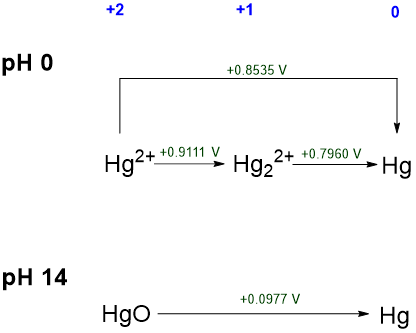
De Scheme hay\(\PageIndex{IV}\) varias cosas claras sobre la química redox del mercurio en condiciones ácidas y básicas:
- El ion mercurio (I), Hg 2 2 +, es termodinámicamente estable en condiciones ácidas, pero probablemente no sea estable en condiciones básicas. Esto se puede inferir de su ausencia en el diagrama de pH 14, lo que sugiere que no se forma fácilmente en condiciones básicas.
- El mercurio elemental es la forma termodinámicamente más estable del elemento en condiciones ácidas y básicas. Esto puede inferirse que el potencial de reducción estándar para todas las especies de mercurio +2 y +1 es positivo.
- Tanto en sus estados de oxidación +1 como +2 (iones Hg 2 + y Hg 2 2 +) el mercurio es un oxidante bastante potente en condiciones ácidas (con\(\sf{E^{\circ}}\) 0.796 - 0.9111 V). En contraste, bajo condiciones básicas la forma +2 de mercurio (HgO) es solo un oxidante débil (E^ {\ circ}\) = 0.0977 V.
- Todas las especies de mercurio representadas son termodinámicamente estables hacia la desproposición.
3. Comparando la química redox de diferentes elementos en condiciones similares. Por ejemplo, el comportamiento redox del mercurio y sus cogéneros en solución ácida se puede comparar fácilmente usando los diagramas Latimer (Esquema\(\PageIndex{V}\).
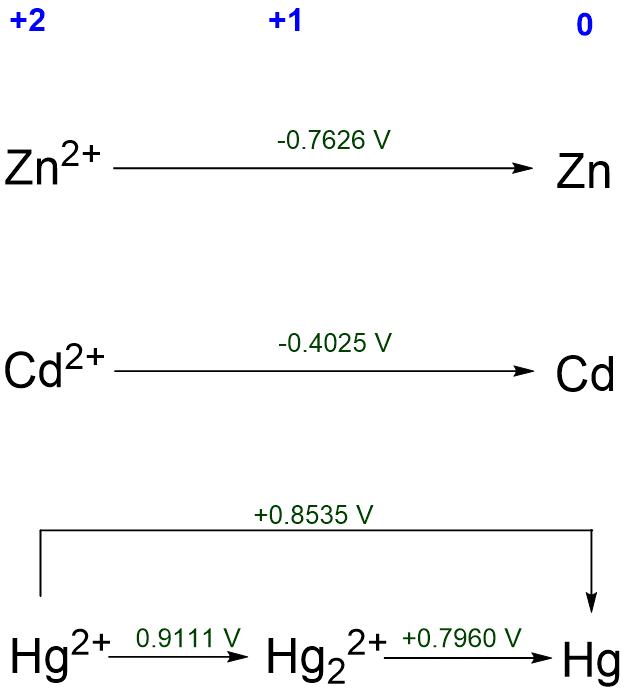
A partir del Esquema\(\PageIndex{V}\) es claro que Zn y Cd presentan un comportamiento redox similar. Ambos deben disolverse a pH 0 para dar dicados. En contraste, el mercurio elemental debe ser estable frente al ácido. El mercurio es también el único elemento del grupo 12 para el que el estado de oxidación +1 es estable.
Como indican los ejemplos anteriores, los diagramas de Latimer son resúmenes útiles de la química redox de los elementos, pero aún requiere un poco de lectura cuidadosa para usarlos para dar sentido a las tendencias en la química redox de los elementos o para rastrear los productos de desformulación de un estado redox dado. Los diagramas publicados también tienden a limitarse a describir la química redox de los elementos en condiciones de pH extremo. Afortunadamente, se han desarrollado diversas representaciones gráficas de la química redox de los elementos que son particularmente útiles para estimar la forma dominante de un elemento bajo un conjunto dado de condiciones y para dar sentido a las tendencias en la química redox de los elementos. Estos métodos gráficos se describirán en las dos secciones siguientes.
Los potenciales que no se muestran en un diagrama Latimer siempre pueden calcularse construyendo un ciclo termodinámico. Considerar la interconversión de N 2 O 4 a NO\(\sf{E^{\circ}_{IV/II}}\), cuyo valor no se da en el diagrama estándar de Latimer de Nitrógeno presentado en el Esquema\(\PageIndex{sf{II}}\). Parte de ese diagrama se reproduce como Esquema\(\PageIndex{\sf{VI}}\) a continuación.
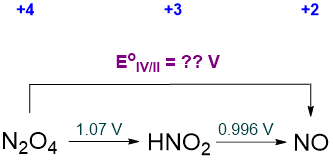
El ciclo termodinámico relevante que se puede utilizar para calcular el potencial desconocido involucra las energías libres y se representa en Scheme\(\PageIndex{\sf{VII}}\).
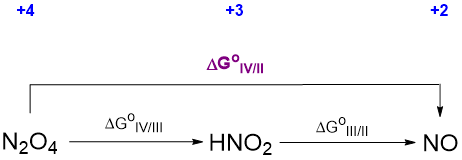
Las energías libres para cada paso de conversión en el ciclo se relacionan con el potencial correspondiente por la relación
\[\sf{\Delta G^{\circ} = nFE^{\circ}}\nonumber \]
donde n es el número de electrones involucrados en cada paso. Haciendo esta sustitución el ciclo termodinámico anterior puede convertirse al que se muestra en el Esquema\(\PageIndex{\sf{VIII}}\).
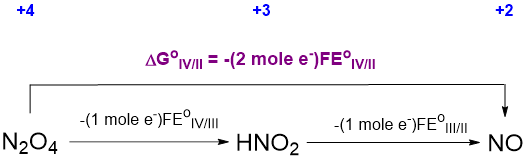
De Scheme\(\PageIndex{\sf{VIII}}\) se puede ver que
\[\sf{\Delta G^{\circ}_{IV/II}~~=~~-(2~mol~e^-)FE^{\circ}_{IV/II}~~=~~-(1~mol~e^-)FE^{\circ}_{IV/III} -(1~mol~e^-)FE^{\circ}_{III/II}}\nonumber \]
La cancelación de la constante F y la sustitución de los potenciales desconocidos con los valores en el Esquema\(\PageIndex{\sf{VI}}\) da
\[\sf{-(2~mol~e ^-)E^{\circ}_{IV/II}~~=~~-(1~mol~e^-)(1.07~V)~~-~~(1~mol~e^-)(0.996~V)}\nonumber \]
a partir del cual se\(\sf{E^{\circ}_{IV/II}}\) puede calcular, dando\(\sf{E^{\circ}_{IV/II}}\) = +1.033 V.
Referencias
1. Todos los potenciales de reducción estándar se toman de Bard, A. J.; Parsons, R.; Jordan, J. Potenciales estándar en solución acuosa. M. Dekker: Nueva York, 1985.

