8.1.4.2: Los diagramas de escarcha muestran cómo los estados redox del elemento estable son relativos al elemento libre
- Page ID
- 81372
Los diagramas de escarcha muestran cuán estables son los estados redox de un elemento en relación con el elemento libre
Los diagramas de escarcha representan cuán estables son los estados redox de un elemento en relación con el elemento libre. En un diagrama de Frost se representa un proxy para la energía libre relativa a la del elemento libre (estado de oxidación cero) como una función del estado de oxidación. Para evitar ambigüedades a veces los puntos se etiquetan con la identidad de las especies químicas involucradas.
El proxy utilizado en lugar de la energía libre es\(NE^{\circ}\), a veces expresado como\(nE^{\circ}\). En esta página se\(N\) utilizará en lugar de\(n\) para evitar confusiones con el uso común de\(n\) en química redox para denotar el número de electrones involucrados en etapas individuales de reacción de oxidación o reducción.
En los diagramas Frost\(NE^{\circ}\) se utiliza la cantidad ya que es proporcional al cambio de energía libre estándar para la conversión del elemento libre a ese estado de oxidación.
En\(NE^{\circ}\)
- \(N\)es el estado de oxidación.
- \(\sf{E^{\circ}}\)es el potencial de reducción estándar asociado con la interconversión entre el elemento libre y ese estado de oxidación.
Para una prueba que\(NE^{\circ}\) es proporcional a la energía libre del estado de oxidación de un elemento y más información sobre cómo se\(NE^{\circ}\) puede calcular consulte Nota\(\PageIndex{1}\) al final de esta página.
Los diagramas de escarcha permiten una estimación rápida de la estabilidad relativa de los estados redox de los elementos.
Debido a que los diagramas de Frost muestran directamente las estabilidades relativas de los estados de oxidación, permiten evaluar rápidamente
1. La estabilidad relativa de la oxidación de un elemento establece un conjunto dado de condiciones. Dado que\(NE^{\circ}\) es una medida de estabilidad termodinámica, cuanto menor es su valor, más estable es el estado. Además, dado que\(NE^{\circ}\) mide la estabilidad relativa al elemento libre, los valores negativos de \(NE^{\circ}\)indican que un estado es más estable que el elemento, los valores positivos indican que el estado es menos estable.
Considere el diagrama Frost para cobre a pH 0 que se muestra en la Figura\(\PageIndex{1}\).
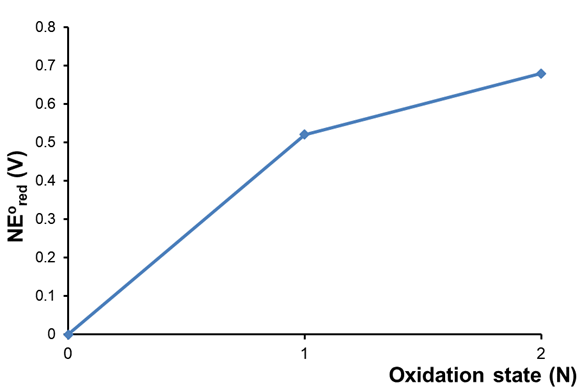
Como se puede ver en la Figura\(\sf{\PageIndex{1}}\), Cu + y Cu 2+ son ambos más altos en energía libre (\(\propto NE^{\circ}\)que Cu libre. Esto es consistente con el estado del cobre como metal noble que solo puede disolverse en ácido con la ayuda de agentes oxidantes como O 2, H 2 O 2 o NO 3 - (por ejemplo, como en HNO 3).
El diagrama de Frost ácido del níquel mostrado en la Figura\(\PageIndex{2}\) proporciona un ejemplo de un metal que se disuelve en ácido en condiciones de otro modo no oxidantes (es decir, sin la ayuda de oxidantes como O 2 o H 2 O 2).
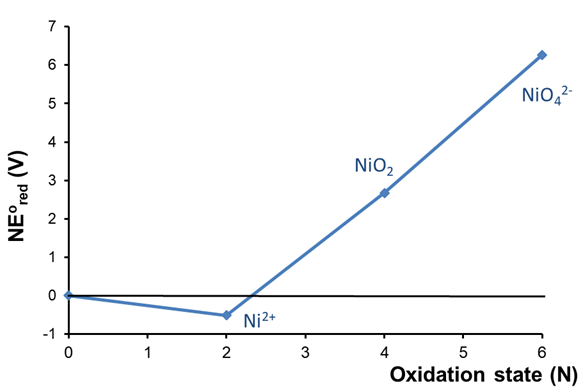
En este caso el diagrama muestra que el estado de oxidación de Ni 2+ es menor en energía libre que el elemento libre, lo que indica que el Ni se disuelve espontáneamente en ácido para dar Ni 2+. El diagrama también revela que los estados de oxidación de níquel más altos (+4 y +6) son conocidos pero inestables con respecto tanto al Ni 2+ como al níquel libre.
Considere el diagrama de Frost de Cr en ácido que se muestra en la Figura\(\PageIndex{3}\). ¿Qué se puede determinar sobre la estabilidad relativa de los estados de oxidación del cromo en ácido?
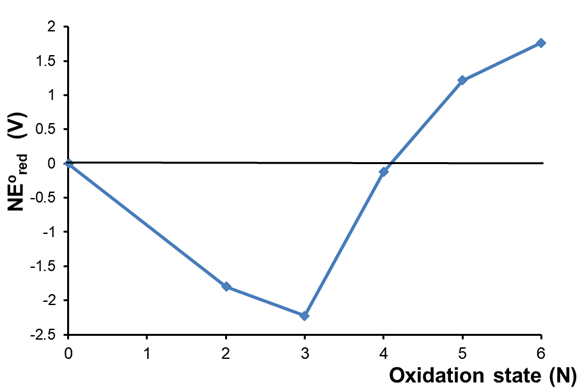
Solución
Un vistazo superficial al diagrama revela que
- El estado de oxidación +3 es el más estable ya que tiene el más bajo\(NE^{\circ}\).
- Los estados de oxidación +2, +3 y +4 son todos más estables que el elemento libre, mientras que los estados de oxidación +5 y +6 son menos estables.
- El diagrama también revela información sobre la susceptibilidad de las especies de cromo a sufrir reacciones de desproporción y conproporcionación. Para más detalles véase el ejemplo 2.
2. El comportamiento redox de un elemento bajo diferentes condiciones. Considere el diagrama de Frost de Azufre a pH 0 y 14 mostrado en la Figura\(\PageIndex{4}\).
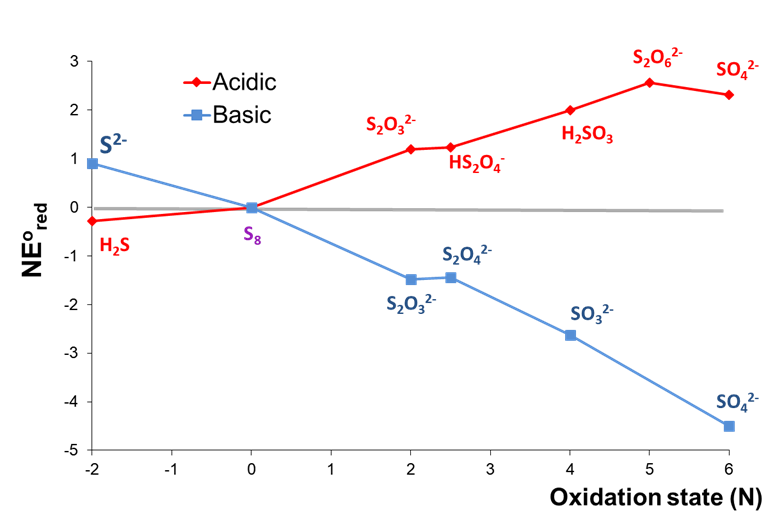
Como se puede observar en la Figura\(\PageIndex{4}\), las estabilidades relativas de los estados de oxidación de alto y bajo contenido de azufre están invertidas aproximadamente entre condiciones ácidas y básicas. En condiciones básicas, las formas oxidadas de azufre son todas más estables que el elemento libre, siendo el sulfato más estable en general. En contraste, H 2 S es la forma más estable de azufre en condiciones ácidas mientras que todas las formas oxidadas de azufre son menos estables que el elemento libre.
3. Comparación del comportamiento redox de una serie de elementos. Considere el diagrama de pH 0 Frost de los elementos del grupo 6 mostrados en la Figura\(\PageIndex{5}\)
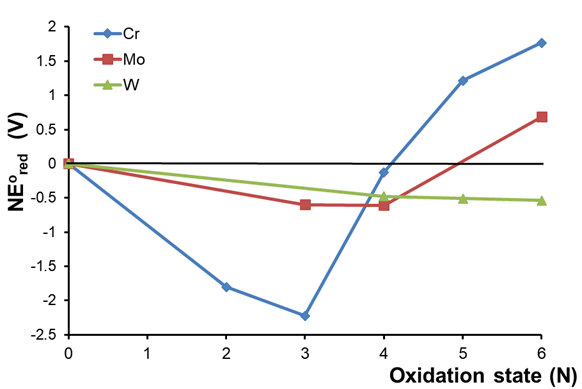
Se pueden observar varias tendencias a partir de los datos de la Figura\(\PageIndex{5}\). Primero, al bajar el grupo de Cr a W hay una preferencia creciente por estados de oxidación más altos, siendo las formas más estables Cr 4+, Mo 4+ y W 6+. En segundo lugar, la estabilización coincidentemente baja de Cr 4+ aparte, la estabilización o desestabilización de los estados de oxidación en relación con el elemento libre disminuye en un grupo - es decir, Cr 4+ es relativo a Cr más que Mo 4+ es relativo a Mo y W 6+ se estabiliza en relación con W aún menos.
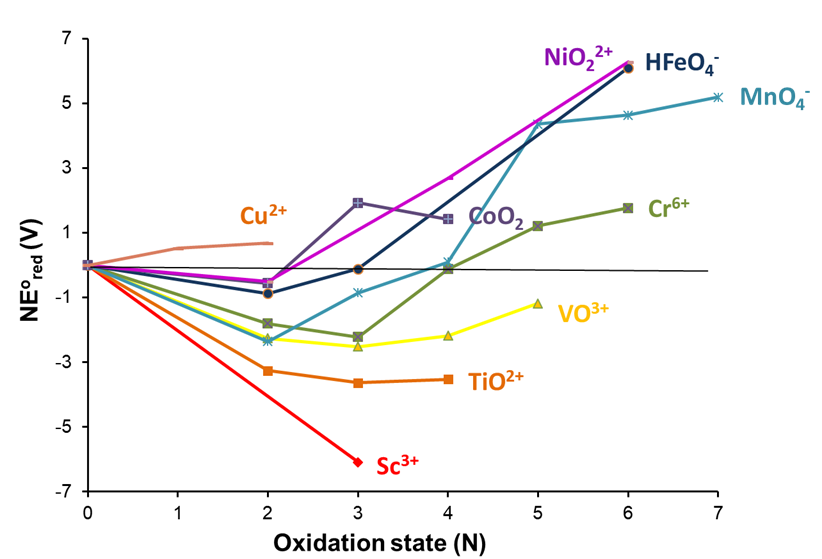
Uno de los ejemplos más llamativos de la utilidad de los diagramas de Frost para comparar el comportamiento redox empírico de una serie de elementos involucra los elementos de transición de la primera fila, el diagrama Frost pH 0 para el cual se muestra en la Figura\(\PageIndex{6}\). 2,3 Se puede observar una serie de tendencias. Por ejemplo, como en el caso de los elementos del grupo 6 se puede observar un desplazamiento en el estado de oxidación más estable, presentando Sc a Cr una preferencia por el estado de oxidación +3 y Mn a Cu el estado de oxidación +2. El diagrama también muestra que Sc a Mn pierden todos sus electrones de valencia para formar especies d 0 mientras que especies similares no se han observado para miembros posteriores de la serie (aunque se ha aislado un complejo de hierro (VII) 4 y cogeners más pesados del hierro, Ru y Os sí forman d 0 especies, RuO 4 y OSO 4).
4. Si un estado redox es inestable hacia la desproporción se puede determinar a partir de las posiciones relativas de ese estado y los estados a cada lado del mismo en el diagrama. 5 Recuerde que en desproporción una especie reacciona consigo misma para producir dos o más productos estables. Por ejemplo, el NO puede en principio sufrir desproporción en ácido acuoso para dar nitrato y N 2.
\[\sf{ 10~NO~+~2H_2O \rightarrow 3~N_2 + 4~NO_3^- + 4H^+ } \nonumber \]
Se puede usar un diagrama de Frost para determinar cuándo un estado redox es inestable con respecto a dicha desproporción porque la pendiente de una línea entre dos puntos cualesquiera es igual al potencial de reducción estándar interconvirtiendo las especies involucradas. Esto significa que si se dibuja una línea entre dos estados redox cualesquiera, entonces cualquier estado por encima de la línea será inestable hacia la desproporción a esos estados. Esto se debe a que en ese caso el potencial para la media reacción de reducción en la desproporción será más positivo que el potencial para la media reacción de oxidación, haciendo que el potencial de reacción general sea positivo y tan espontáneo. Para probar un ejemplo específico ver Ejercicio 1.
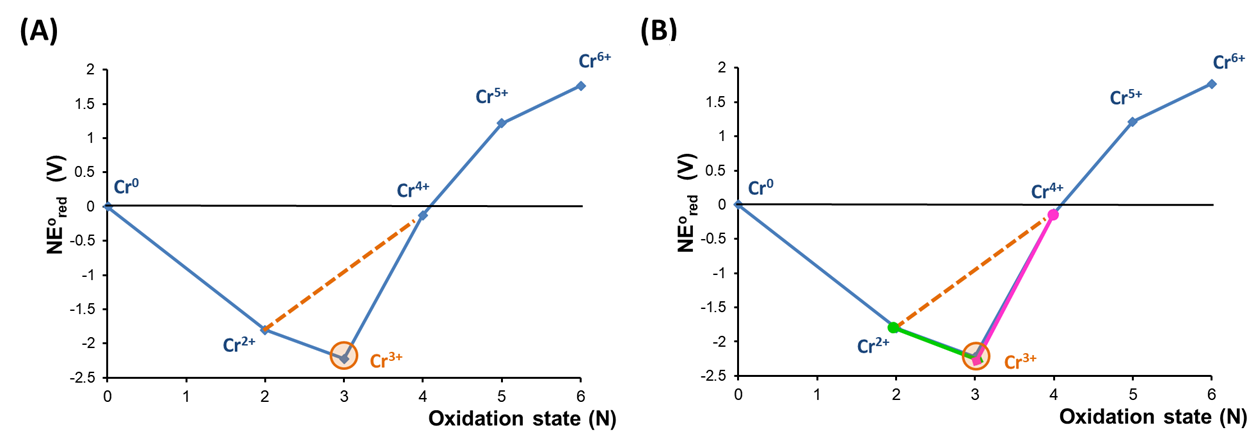
Para ver cómo se puede realizar un análisis de desproporción usando un diagrama de Frost, puede ser útil examinar el diagrama de Frost de pH 0 para Cr con más cuidado. En este caso la inestabilidad de Cr 4+ y Cr 5+ hacia la desproporción puede revelarse colocando una línea de unión trazada entre los estados Cr 3 + y Cr 6 +, como se muestra en la Figura\(\PageIndex{7a}\).
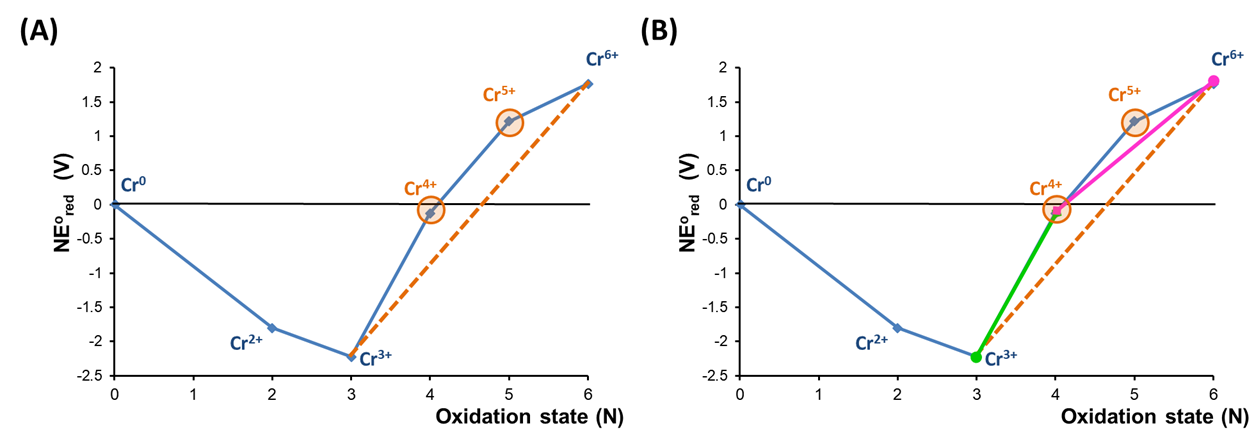
Como se muestra en la Figura\(\PageIndex{7a}\), los estados Cr 4 + y Cr 5 + son inestables hacia la desproporción porque se encuentran por encima de una línea de unión entre los estados Cr 3 + y Cr 6 +. Esto se debe a que el potencial de reducción de Cr 4 + a Cr 3+, representado por la línea de unión que conecta esas especies en la Figura,\(\PageIndex{7b}\) es mayor que el potencial de reducción de Cr 6 + a Cr 4+, como lo indica la pendiente inferior de la línea de unión que conecta Cr 6 + y Cr 4+.
A veces los estados que son inestables hacia la desproporción corresponden a puntos descendentes cóncavos en el diagrama de Frost. Sin embargo, como este no siempre es el caso, se recomienda un enfoque sistemático para encontrar estados redox metaestables. Un ejemplo de tal enfoque se da en Ejemplo\(\PageIndex{2}\).
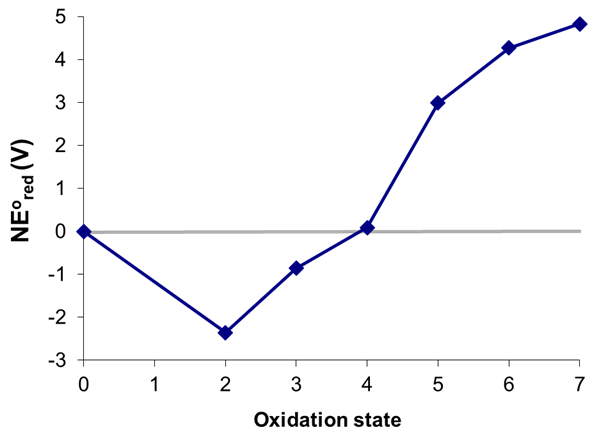
Considere el diagrama de Frost de Mn en ácido que se muestra en la Figura\(\PageIndex{8}\). ¿Cuál, si alguno de los estados de oxidación del manganeso es inestable hacia la desproprción a pH 0?
Solución
Los estados que son inestables hacia la desestructuración pueden identificarse dibujando todas las líneas de unión posibles entre estados no adyacentes que abarcan los estados de oxidación más bajo y más alto en el diagrama, que en este caso son Mn 0 y Mn 7. Las posibles permutaciones que comienzan con Mn 0 se dan a continuación
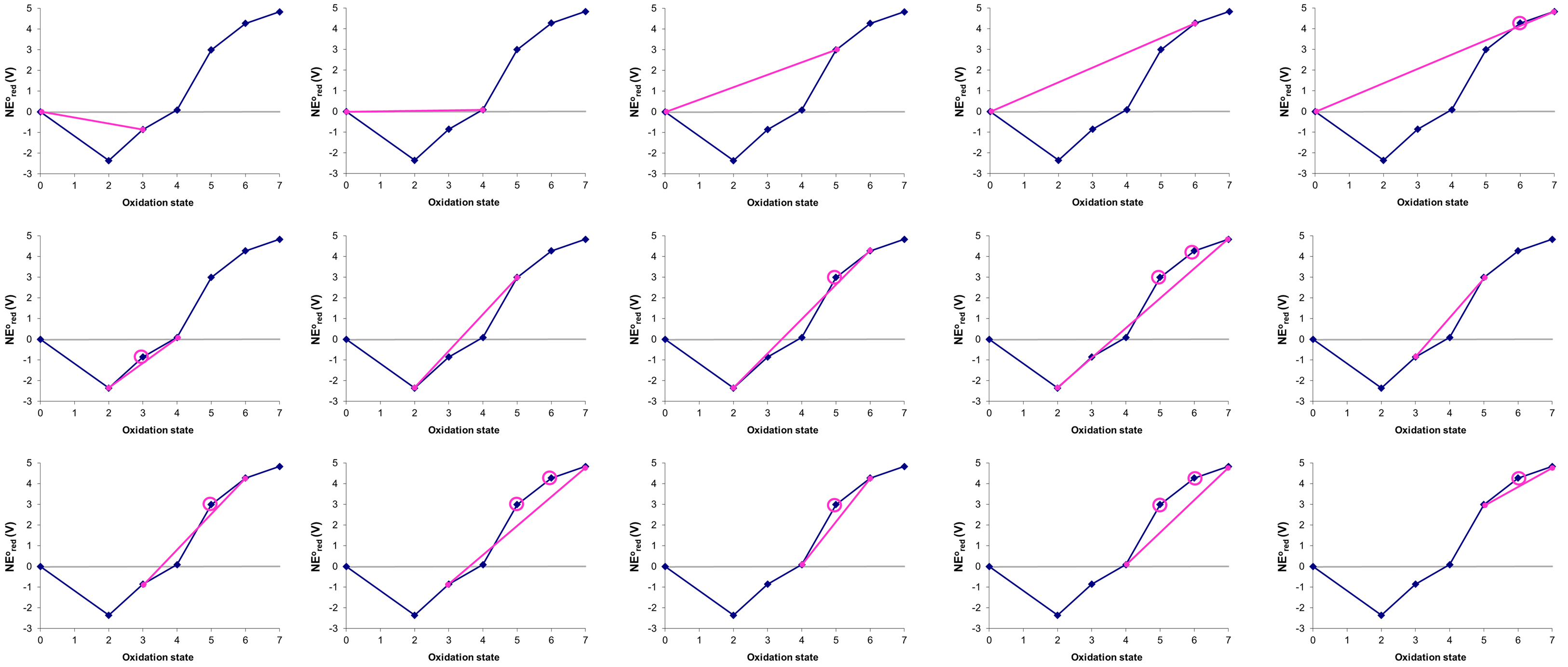
En la figura anterior los estados que son termodinámicamente inestables hacia la desproprción (rodeados) son +3, +5 y +6.
La figura anterior de Stephen Conakes está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
4. Si dos especies son inestables hacia la conproposición se puede evaluar a partir de las posiciones relativas de las dos especies y todas las especies intervinientes en el diagrama. En la conproción dos especies relacionadas reaccionan para dar un producto más estable. Por ejemplo, el NO y el ion hidrazinio pueden, en principio, sufrir conproposición en ácido acuoso para dar N 2.
\[\sf{2~NO~~+~~N_2H_5^+}~ \rightarrow \sf{2~N_2~~+~~2~H_2O~~+~~H^+ } \nonumber \]
Se puede usar un diagrama de Frost para determinar cuándo dos especies que son favorecidas termodinámicamente se someten a conproposición. Dibuja una línea entre las dos especies en el diagrama. Si hay estados por debajo de la línea entonces las dos especies son inestables hacia la formación de esos estados por conproposición. Nuevamente, puede ser útil examinar el diagrama de escarcha de condición ácida para Cr para ver cómo funciona esto. En este caso consideremos una línea de unión trazada entre los estados Cr 4 + y Cr 2+, como se muestra en la Figura\(\PageIndex{9a}\).
Como se muestra en la Figura\(\PageIndex{9a}\), una mezcla de Cr 2+ y Cr 4 + son inestables hacia la conproporción porque en el diagrama de Frost Cr 3 + se encuentra por debajo de la línea de unión entre el Cr 2+ y el Cr 4 +. Esto refleja que el potencial estándar de reducción de Cr 3+ a Cr 2+ (igual a la pendiente de la línea que conecta esos estados) es menor que el de la reducción de Cr 4+ a Cr 3+ (nuevamente, igual a la de la línea que conecta los estados), en consecuencia de los cuales el potencial de conproprción será positivo.
El análisis de un diagrama de Frost para todas las conproporciones favorables es similar al análisis utilizado para detectar especies que son inestables hacia la desproporción. Los productos de conproportonaciones termodinámicamente favorecidas son a veces puntos ascendentes cóncavos, pero como no siempre es así, se debe utilizar un enfoque sistemático. Un ejemplo se da en Ejemplo\(\PageIndex{3}\).
Considere el diagrama Frost de Mn a pH 0 en la Figura\(\PageIndex{8}\) del Ejemplo\(\PageIndex{2}\), que por conveniencia se reproduce a continuación. ¿Cuáles, si los hay, pares de especies de manganeso son inestables hacia la conproporción en estas condiciones y qué productos podrían formar?

Solución
Las posibles líneas de unión ya se identificaron en Ejercicio\(\PageIndex{2}\).
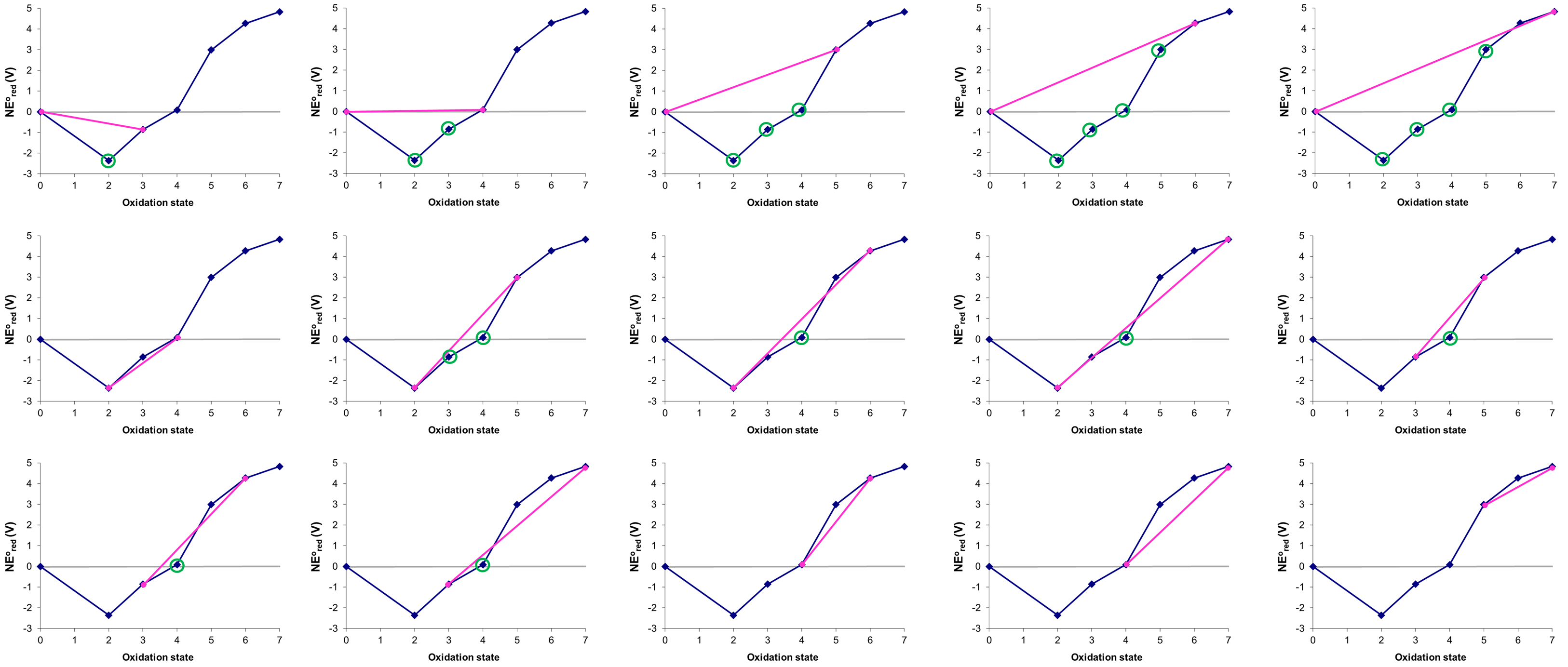
- 0 y +3\(\rightarrow\) +2
- 0 y +4\(\rightarrow\) +2 o +3
- 0 y +5\(\rightarrow\) +2 o +3 o +4
- 0 y +6\(\rightarrow\) +2 o +3 o +4 o +5
- 0 y +6\(\rightarrow\) +2 o +3 o +4 o +5
- +2 y +6\(\rightarrow\) +4
- +2 y +7\(\rightarrow\) +4
- +3 y +5\(\rightarrow\) +4
- +3 y +6\(\rightarrow\) +4
- +3 y +7\(\rightarrow\) +4
Las cifras en este problema son de Stephen Conakes y licenciadas bajo una Licencia Creative Commons Attribution 4.0 International.
Se necesita un análisis adicional para determinar el producto termodinámico de muchas reacciones de conproprción, pero afortunadamente dicho análisis no es necesario para comprender la química descriptiva de los elementos.
Esta lista de posibles reacciones de conproprción identificadas en Ejemplo\(\PageIndex{3}\) plantea varias preguntas interesantes:
1. Cuando es posible más de un producto de conproporcionación, ¿cuál (s) se formará (n)?
En este caso la respuesta es que todas las especies pueden formarse en reacciones de conproprción termodinámicamente favorecidas. Sin embargo, el sistema todavía solo posee un estado de menor energía libre. Por ejemplo, dependiendo de la estequiometría de los reactivos, los productos de menor energía que se pueden formar a partir de una mezcla de Mn 0 y Mn VII podrían ser una mezcla de Mn II y Mn IV. La identificación de este estado en un caso dado es complicada e implica minimizar la energía del sistema sujeta a las limitaciones de un balance de masa y carga. Afortunadamente tal análisis no es necesario para darle sentido a la química de los elementos.
Lo que debe tenerse en cuenta es que si un producto de conprofracción puede sufrir por sí mismo una reacción de conproporción con uno o más reactivos entonces esa reacción puede tener lugar en solución. Por ejemplo, en el caso de la conproposición entre Mn 0 y Mn IV produce Mn III entonces ese Mn III puede sufrir una reacción de conproporción adicional con Mn 0 para dar Mn II.
2. ¿Qué sucede si una especie formada por conproposición es susceptible a la desproprción?
Si las condiciones lo permiten, entonces esa especie sufrirá desprolijo. Nuevamente, medidas termodinámicas como las que se muestran en los diagramas de Frost describen lo que puede suceder, no lo que ocurrirá bajo un conjunto dado de condiciones.
Ejercicios
Utilizando el diagrama Latimer simplificado para Cr en ácido acuoso, reproducido a continuación, se valida que la desproporción de Cr 4+ a Cr 3+ y Cr 6+ es termodinámicamente espontánea.

- Contestar
-
La desproporción de Cr 4+ a Cr 3+ y Cr 6+ es la suma de dos procesos:
\[\sf{ Cr^{4+} reduction:~~~~~~~Cr^{4+} + e^- \rightarrow Cr^{3+}~~~~~~~~~~~~~~~E^{\circ}_{Cr^{4/3+}}=~2.10~V } \nonumber \]
\[\sf{ Cr^{4+} oxidation:~~~Cr^{4+} \rightarrow Cr^{6+}~+~2e^- ~~~~~~~E^{\circ}=-E^{\circ}_{Cr^{6/4+}} } \nonumber \]
\[\sf{Sum:~~3Cr^{4+} + \rightarrow Cr^{6+}~+~2Cr^{3+} ~~~~~~~~~~~~E^{\circ}_{\sf{disproprtionation}}=E^{\circ}_{Cr^{4/3+}}~~-~~E^{\circ}_{Cr^{6/4+}} } \nonumber \]
El valor de\(E^{\circ}_{Cr^{6/4+}}\) es solo la suma de los potenciales de reducción Cr 6/5+ y Cr 5/4 + (+0.55 V + 1.34 V) o +1.89 V. En consecuencia,
\[ E^{\circ}_{\sf{disproprtionation}} = E^{\circ}_{\sf{Cr^{4/3+}}}~~~~~E^{\circ}_{Cr^{6/4+}}~\sf{=~2.10~V~~-~1.89~V~~=~~+0.21~V} \nonumber \]
lo cual es espontáneo.
Utilizando el diagrama Latimer simplificado para Cr en ácido acuoso, reproducido a continuación, se valida que la conproporción de Cr 2+ y Cr 4+ y Cr 3+ es termodinámicamente espontánea.

- Contestar
-
La conproposición de Cr 2+ y Cr 4+ y Cr 3+ es la suma de dos procesos:
\[\sf{ Cr^{4+} reduction:~~~~~~~Cr^{4+} + e^- \rightarrow Cr^{3+}~~~~~~~~~~~~~~~E^{\circ}_{Cr^{4/3+}}~=~+2.10~V } \nonumber \]
\[\sf{ Cr^{2+} oxidation:~~~Cr^{2+} \rightarrow Cr^{3+}~+~e^- ~~~~~~~E^{\circ}=-E^{\circ}_{Cr^{3/2+}}~= -(-0.424~V)~=~=~+0.424~V} \nonumber \]
\[\sf{Sum:~~Cr^{2+} + Cr^{4+} \rightarrow 2Cr^{3+} ~~~~~~~~~~~~E^{\circ}_{\sf{conproprtionation}}~=~+2.10~V~~+~~0.424~V~~=~~+2.524~V} \nonumber \]
Dado que\(E^{\circ}_{\sf{conproprtionation}}\) es positivo la conproporción es espontánea.
Los diagramas de Frost para soluciones ácidas y básicas de azufre se dan a continuación.
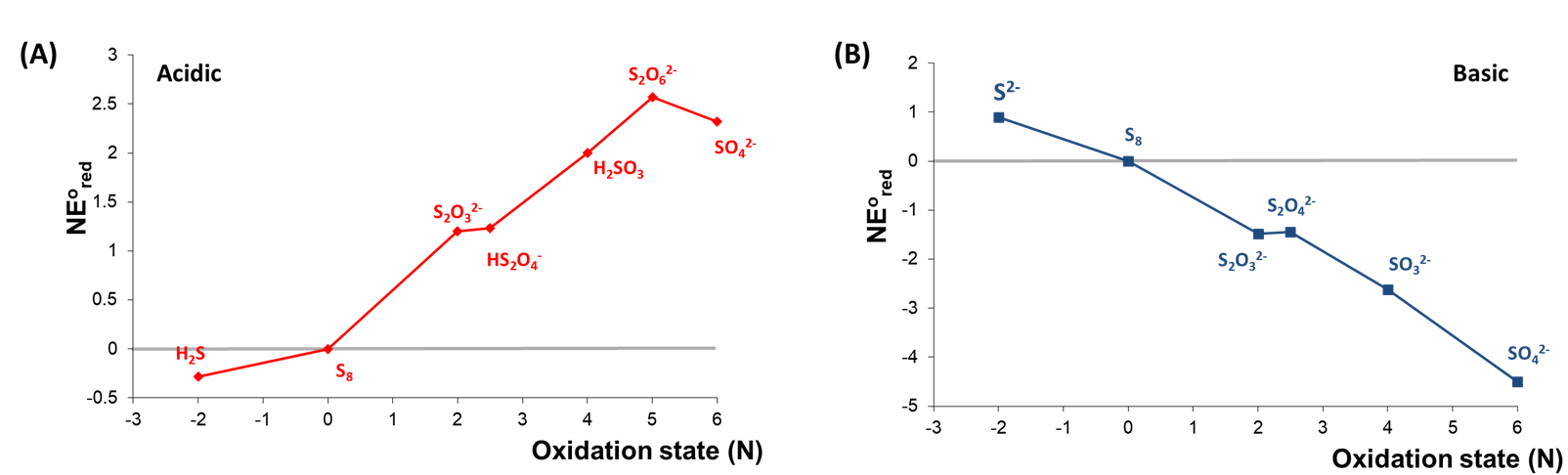
a. Identificar cualquier especie que sea inestable hacia la desproporción en condiciones ácidas o básicas.
b. Identificar cualquier especie que pueda formarse por conproporcionación en condiciones ácidas o básicas.
- Contestar
-
Las especies que son inestables hacia la desproporción y conproción se pueden identificar construyendo líneas de unión entre estados redox no adyacentes e identificando cualquiera que caiga por encima y por debajo de estas líneas. Las especies que son inestables a la desproporción quedarán por encima de una línea; las que se formarán por conproporción quedarán por debajo de una línea. Nótese que algunas especies pueden ser tanto capaces de formarse por conproporcionación como termodinámicamente susceptibles a la desproporcionación.
Las posibles líneas de unión para condiciones ácidas son las siguientes:
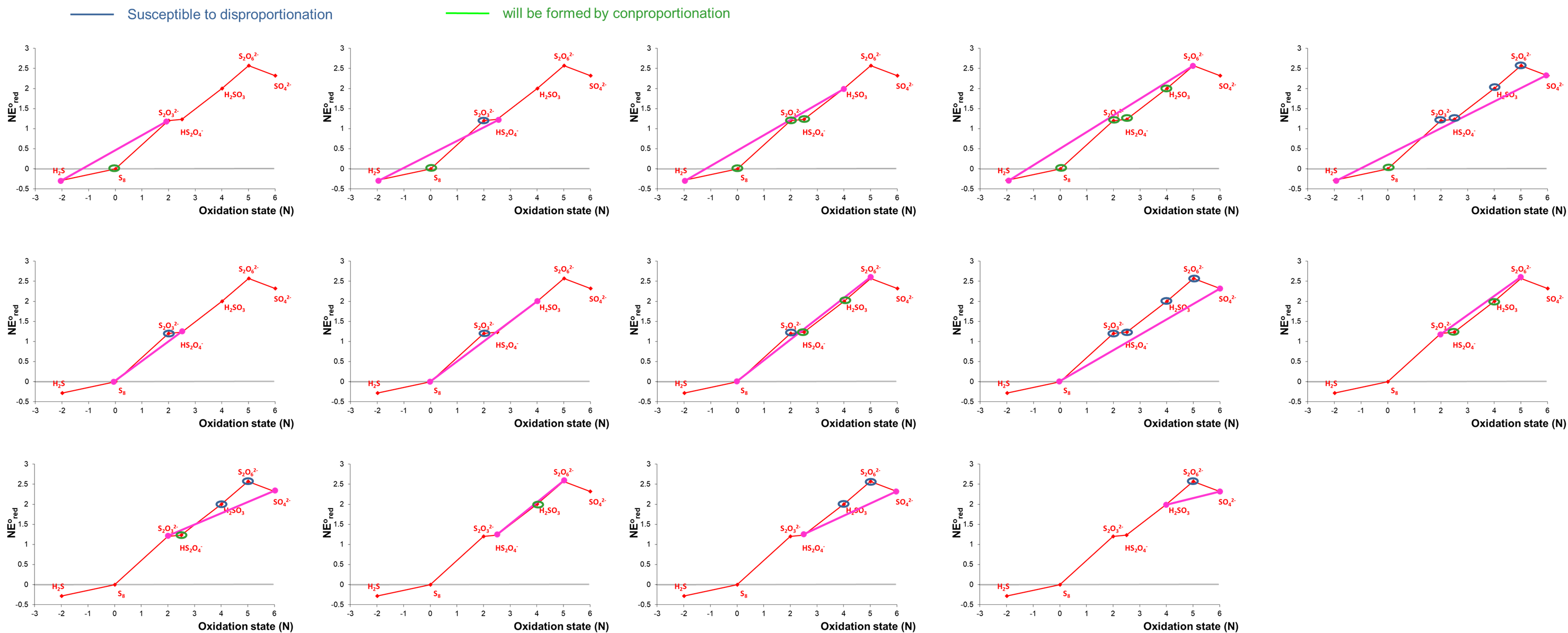
Observe que en algunos casos puede ser difícil saber si un punto se encuentra por encima o por debajo de una línea de amarre basado solo en la inspección. En estos casos se debe calcular el potencial redox relevante para determinar si se favorece termodinámicamente la desproporción o la conproporcionación o incluso si el proceso es neutro energético libre.
Las posibilidades de condiciones básicas se dejan como un ejercicio para el lector. Para verificar su trabajo se resumen a continuación las especies que son susceptibles a la desproporción y las que se pueden formar por conproporcionación.
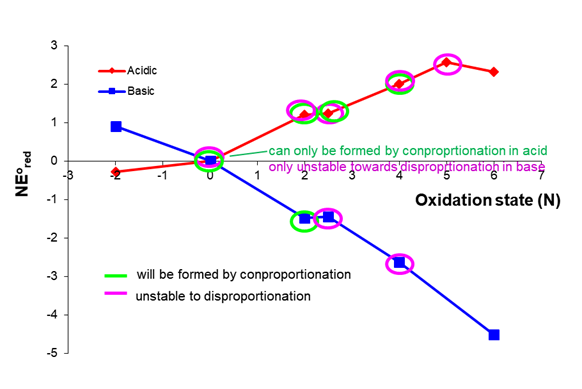
Las cifras en este problema son de Stephen Conakes y licenciadas bajo una Licencia Creative Commons Attribution 4.0 International.
Apéndice
Dado que los diagramas de Frost utilizan\(NE^{\circ}\) como proxy de energía libre de oxidación, la construcción de un diagrama de Frost es cuestión de calcular\(NE^{\circ}\) para cada estado de oxidación donde,\(E^{\circ}\) es el potencial estándar para la formación de ese estado de oxidación (O.S.) del elemento libre. Para ver por qué esta cantidad es un proxy útil para la energía libre del estado de oxidación, es útil reconocer que el estado de oxidación, N, es formalmente igual al número de electrones que se eliminan del elemento libre cuando se forma el estado de oxidación. Desde esta perspectiva, la formación de estados de oxidación negativa mediante la adición de electrones al elemento libre puede considerarse que implica la eliminación de un número negativo de electrones.
La energía libre para la formación de cada estado de oxidación se determina de la siguiente manera:
1. Para los elementos libres la energía libre de formación,\(E^{\circ}\), y consecuentemente\(NE^{\circ}\) son todos por definición cero.
2. Los estados de oxidación negativos se forman como reducción del elemento libre
\[E + ne^- \rightarrow E^{O.S.}~~~~~~~~~E^{\circ}=E^{\circ}_{red} \nonumber \]
para que
\[ \Delta G^{\circ} = -n F E^{\circ}_{red} \nonumber \]
en la que\(F\) se encuentra la constante de Faraday.
En este caso el estado de oxidación,\(N\), es igual a\(-n\) y la expresión anterior se convierte en
\[ \Delta G^{\circ}_{red} = F \times (NE^{\circ}) \nonumber \]
de donde también se puede ver por qué\(NE^{\circ}\) es un proxy útil para la energía libre. Es proporcional a\(\Delta G^{\circ}\)
\[NE^{\circ}= \dfrac{1}{F} \Delta G^{\circ}_{red} \nonumber \]
3. Los estados de oxidación positivos se forman por la oxidación del elemento
\[E \rightarrow E^{O.S.} + ne^-~~~~~~~~~E^{\circ}_{ox} = E^{\circ}=-E^{\circ}_{red} \nonumber \]
en el que n, el número de electrones,\(n\), es igual al estado de oxidación,\(N\) y
\[E^{\circ}_{ox} = E^{\circ} =-E^{\circ}_{red} \nonumber \]
Para que para estados de oxidación positivos
\( \Delta G^{\circ}_{ox} = -\Delta G^{\circ}_{red} = - (-n F E^{\circ}_{red}) = F (NE^{\circ}) \)
Esta es la misma expresión obtenida para los estados de oxidación negativos en los que\(NE^{\circ}\) es proporcional a\(\Delta G^{\circ}\).
De considerar estos casos es claro que mientras\(N\) se tome como estado de oxidación y\(E^{\circ}\) el potencial de reducción estándar asociado la cantidad\(NE^{\circ}\) es proporcional a la energía libre.
En muchos casos, los potenciales de reducción estándar relevantes no están tabulados ni listados en el diagrama Latimer del elemento. Por ejemplo, en el diagrama de Latimer ácido de Nickel no se dan los potenciales de reducción estándar para la formación de Ni elemental a partir de NiO 4 2 - o NiO 2.
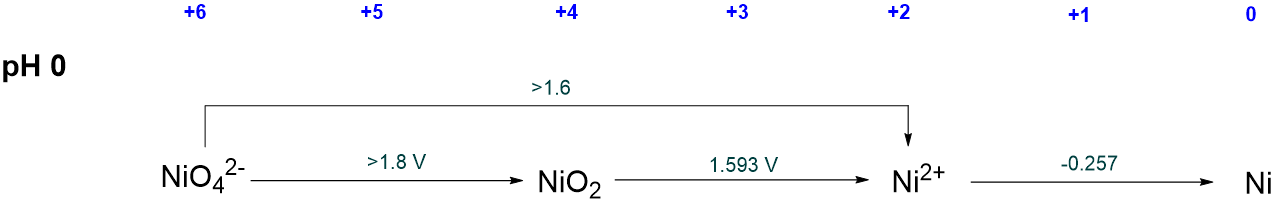
En tales casos, el potencial de reducción relevante debe calcularse tomando en cuenta el hecho de que dado que la energía libre es una función de estado, la energía libre para la formación de ese estado de oxidación es la suma de las energías libres de los pasos descritos en el diagrama de Latimer. Por ejemplo, para calcular\(NE^{\circ}\) para la formación de NiO 2 se puede utilizar la siguiente relación:
\[ \Delta G^{\circ}_{NiO_2 \rightarrow Ni} = \Delta G^{\circ}_{NiO_2 \rightarrow Ni^{2+}} + \Delta G^{\circ} _{Ni^{2+} \rightarrow Ni} \nonumber \]
Pero dado que\(\Delta G = -nF E^{\circ}\) donde\(n\) está el número de electrones involucrados en cada reducción entonces la expresión anterior puede ser reescrita como
\[ -n_{e^-,NiO_2 \rightarrow Ni}FE^{\circ}_{NiO_2 \rightarrow Ni} = -n_{e^-,NiO_2 \rightarrow Ni^{2+}}FE^{\circ}_{NiO_2 \rightarrow Ni^{2+}} + -n_{e^-,Ni^{2+} \rightarrow Ni}FE^{\circ} _{Ni^{2+} \rightarrow Ni} \nonumber \]
Lo que puede simplificarse aún más cancelando la constante de Faraday\(F\), desde ambos lados, dando una expresión para el valor deseado de\(NE^{\circ}\)
\[ -n_{e^-,NiO_2 \rightarrow Ni}E^{\circ}_{NiO_2 \rightarrow Ni} = NE^{\circ}_{Ni \rightarrow NiO_2} = -n_{e^-,NiO_2 \rightarrow Ni^{2+}}E^{\circ}_{NiO_2 \rightarrow Ni^{2+}} + -n_{e^-,Ni^{2+} \rightarrow Ni}E^{\circ} _{Ni^{2+} \rightarrow Ni} \nonumber \]
A partir de esta expresión se\(NE^{\circ}_{Ni \rightarrow NiO_2}\) puede calcular el valor de insertando los potenciales de reducción relevantes y el número de electrones:
\[ NE^{\circ}_{\sf{Ni \rightarrow NiO_2}} = 2 \times (+1.593 V) + 2 \times (-0.257 V) = +2.672 V \nonumber \]
Para casos complejos puede ser útil tabular los cálculos, como se hace en el siguiente ejemplo.
Calcular el diagrama de Frost ácido del nitrógeno a partir de la información dada en el diagrama de Latimer ácido simplificado para nitrógeno que se da a continuación.
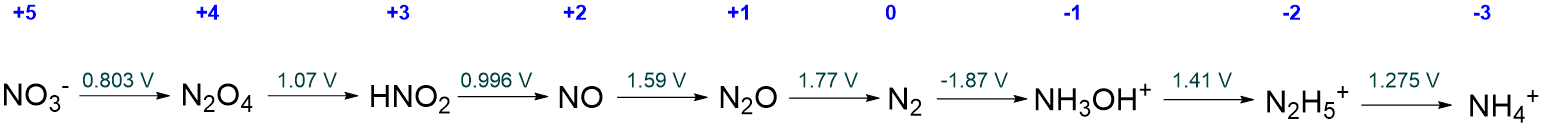
Solución
El valor de\(NE^{\circ}\) para cada estado de oxidación se calcula como se describe en la Tabla\(\PageIndex{1}\). Los cálculos siguen el procedimiento siguiente:
- Set\(NE^{\circ}\) = 0 para el elemento libre.
- Uso\(NE^{\circ}\) = O.S.\(\times\) asociado\(E^{\circ}\) para calcular\(NE^{\circ}\) para los estados de oxidación positivos y negativos más bajos.
- Usar iterativamente\( NE^{\circ}\) =\( NE^{\circ}_{\sf{last~~step}}\) +\(NE^{\circ}_{\sf{one~~lower~~oxidation~~state}}\) para calcular\(NE^{\circ}\) para todos los estados de oxidación más altos.
| Estado de Oxidación | Paso | \(NE^{\circ}\)= | Calculado como la suma de los pasos | Notas |
|---|---|---|---|---|
| 5 | N 2\(\rightarrow\) NO 3 - | \ (NE^ {\ circ}\) =">\(5 \times (E^{\circ}_{NO_3^- \rightarrow N_2})\) |
\(\sf{N_2 \rightarrow N_2O_4 \rightarrow NO_3^-}\) \(NE^{\circ} = 1 \times E^{\circ}_{NO_3^- \rightarrow N_2O_4} +4 \times E^{\circ}_{N_2O_4 \rightarrow N_2}\) \(NE^{\circ} = 1 \times E^{\circ}_{NO_3^- \rightarrow N_2O_4} +NE^{\circ}_{+4~O.S.}\) \(NE^{\circ} = 1 \times 0.803 V + 5.426 V = 6.229 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación +4, NO, primero. Entonces utilízala en este cálculo. |
| 4 | N 2\(\rightarrow\) N 2 O 4 | \ (NE^ {\ circ}\) =">\(4 \times (E^{\circ}_{N_2O_4 \rightarrow N_2})\) |
\(\sf{N_2 \rightarrow HNO_2 \rightarrow N_2O_4}\) \(NE^{\circ} = 1 \times E^{\circ}_{HNO_2 \rightarrow NO} +3 \times E^{\circ}_{HNO_2 \rightarrow N_2}\) \(NE^{\circ} = 1 \times E^{\circ}_{N_2O_4 \rightarrow HNO_2} +NE^{\circ}_{+3~O.S.}\) \(NE^{\circ} = 1 \times 1.07 V + 4.356 V = 5.426 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación +3, NO, primero. Entonces utilízala en este cálculo. |
| 3 | N 2\(\rightarrow\) HNO 2 | \ (NE^ {\ circ}\) =">\(3 \times (E^{\circ}_{HNO_2 \rightarrow N_2})\) |
\(\sf{N_2 \rightarrow NO \rightarrow HNO_2}\) \(NE^{\circ} = 1 \times E^{\circ}_{HNO_2 \rightarrow NO} +2 \times E^{\circ}_{NO \rightarrow N_2}\) \(NE^{\circ} = 1 \times E^{\circ}_{NO \rightarrow N_2O} +NE^{\circ}_{+2~O.S.}\) \(NE^{\circ} = 1 \times 0.996 V + 3.36 V = 4.356 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación +2, NO, primero. Entonces utilízala en este cálculo. |
| 2 | N 2\(\rightarrow\) NO | \ (NE^ {\ circ}\) =">\(2 \times (E^{\circ}_{NO \rightarrow N_2})\) |
\(\sf{N_2 \rightarrow N_2O \rightarrow NO}\) \(NE^{\circ} = 1 \times E^{\circ}_{NO \rightarrow N_2O} +1 \times E^{\circ}_{N_2O \rightarrow N_2}\) \(NE^{\circ} = 1 \times E^{\circ}_{NO \rightarrow N_2O} +NE^{\circ}_{+1~O.S.}\) \(NE^{\circ} = 1 \times 1.59 V + 1.77 V = 3.36 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación +1, NO, primero. Entonces utilízala en este cálculo. |
| 1 | N 2\(\rightarrow\) N 2 O | \ (NE^ {\ circ}\) =">\(1 \times E^{\circ}_{N_2O \rightarrow N_2}\) |
\(\sf{N_2 \rightarrow N_2O}\) \(NE^{\circ} = 1 \times E^{\circ}_{N_2O \rightarrow N_2}\) \(NE^{\circ} = 1 \times +1.77 V = +1.77 V\) |
|
| 0 | Ninguno | \ (NE^ {\ circ}\) =">0 V | \(NE^{\circ} = 0 V\)por definición. | Definido como 0 V |
| -1 | N 2\(\rightarrow\) NH 3 OH + | \ (NE^ {\ circ}\) =">\((-1) \times E^{\circ}_{N_2 \rightarrow NH_3OH^+}\) |
\(\sf{N_2 \rightarrow NH_3OH^+}\) \(NE^{\circ} = (-1) E^{\circ}_{N_2 \rightarrow NH_3OH^+}\) \(NE^{\circ} = (-1) \times (-1.87 V)= +1.87 V\) |
|
| -2 | N 2\(\rightarrow\) N 2 H 5 + | \ (NE^ {\ circ}\) =">\((-2) \times E^{\circ}_{N_2 \rightarrow N_2H_5^+}\) |
\(\sf{N_2 \rightarrow NH_3OH^+ \rightarrow N_2H_5^+}\) \(NE^{\circ} = (-1) \times E^{\circ}_{N_2\rightarrow NH_3OH^+} + (-1) E^{\circ}_{NH_3OH^+\rightarrow N_2H_5^+}\) \(NE^{\circ} = NE^{\circ}_{-1~O.S.} + (-1) E^{\circ}_{NH_3OH^+\rightarrow N_2H_5^+} \) \(NE^{\circ} = +1.87 V + (-1) \times 1.41 V = 0.46 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación -1, NO, primero. Entonces utilízala en este cálculo. |
| -3 | N 2\(\rightarrow\) NH 4 + | \ (NE^ {\ circ}\) =">\((-3) \times E^{\circ}_{N_2 \rightarrow NH_4^+}\) |
\(\sf{N_2 \rightarrow N_2H_5^+ \rightarrow NH_4^+}\) \(NE^{\circ} = (-1) E^{\circ}_{N_2\rightarrow N_2H_5^+} + (-1) E^{\circ}_{N_2H_5^+ \rightarrow NH_4^+}\) \(NE^{\circ} = NE^{\circ}_{-2~O.S.} + (-1) E^{\circ}_{N_2H_5^+ \rightarrow NH_4^+} \) \(NE^{\circ} = +0.46 V + (-1) \times 1.275 V = -0.815 V\) |
Calcular\(NE^{\circ}\) para el estado de oxidación -2, NO, primero. Entonces utilízala en este cálculo. |
El diagrama de Frost resultante para nitrógeno acuoso ácido se da a continuación.
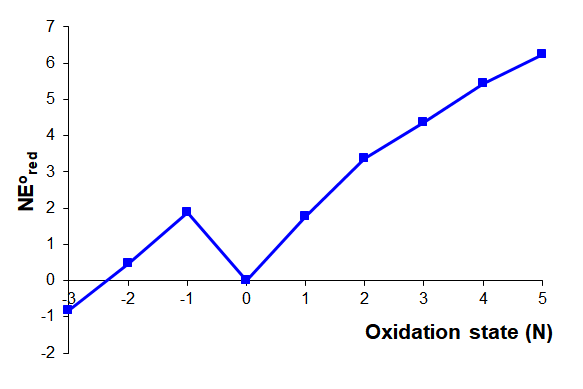
La figura anterior de Stephen Conakes está bajo una Licencia Creative Commons Atribución 4.0 Internacional.
Referencias
- A menos que se indique lo contrario, todos los potenciales son para soluciones fuertemente ácidas y se toman de Bard, A. J.; Parsons, R.; Jordan, J. Potenciales estándar en solución acuosa. M. Dekker: Nueva York, 1985.
- Este diagrama está inspirado en el diagrama similar dado en M. Gerken Chemistry 2810 Lecture Notes. Publicado en classes.uleth.ca/200501/chem2... lecture_20.pdf
- El potencial de\( \sf{Fe^{6/3+}} \) reducción estimado de +2.07 V utilizado para construir el diagrama Frost para los metales de transición de la primera fila se toma de Huheey, J. E.; Keiter, E. A.; Keiter, R. L., Inorganic chemistry: principles of structure and reactivity. 4th ed.; HarperCollins College Publishers: New York, NY, 1993; pg. 596.
- Lu, J.-B.; Jian, J.; Huang, W.; Lin, H.; Li, J.; Zhou, M., Identificación experimental y teórica del estado de oxidación del Fe (vii) en FeO4−. Física Química Física Química 2016, 18 (45), 31125-31131.
- En algunas aplicaciones pedagógicas sólo se consideran los estados colindantes.
Colaboradores y Atribuciones
- Stephen Conakes, Westmont College

