8.6: Grupo 13 (y una nota sobre los metales posteriores a la transición)
- Page ID
- 81422
El grupo 13 elementos comprenden los elementos Boro a través de Nihonio
El grupo 13 elementos comprenden los elementos Boro a través de Nihonio en el grupo 13 de la tabla periódica, como se muestra en la Figura\(\sf{\PageIndex{1}}\).
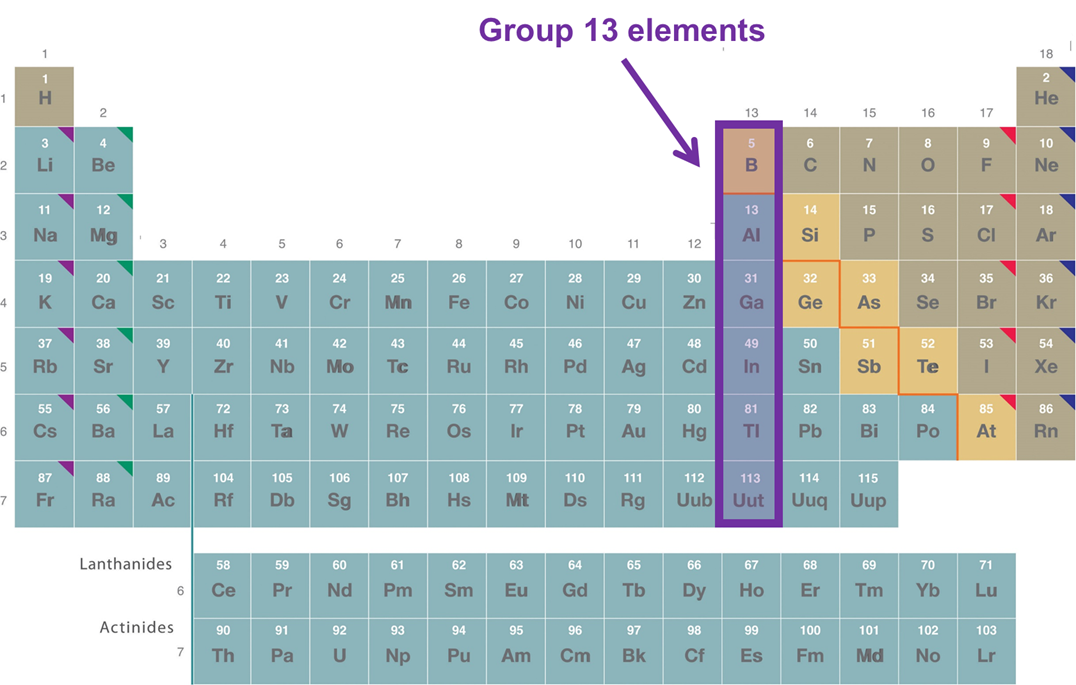
Los elementos del grupo 13 son químicamente diversos, comprendiendo elementos que son
- Boro, B, un elemento de la 2ª fila deficiente en electrones a veces clasificado como no metálico y ocasionalmente como metaloide
- Aluminio, Al, un elemento de tercera fila deficiente en electrones a veces clasificado como metal y a veces como metaloide.
- Galio (Ga), Indio (In), Talio (Tl) y Nihonio (Nh, marcados bajo su antiguo símbolo, Uut, en las Figuras de esta página), metales post transición que exhiben el efecto de par inerte en diversos grados
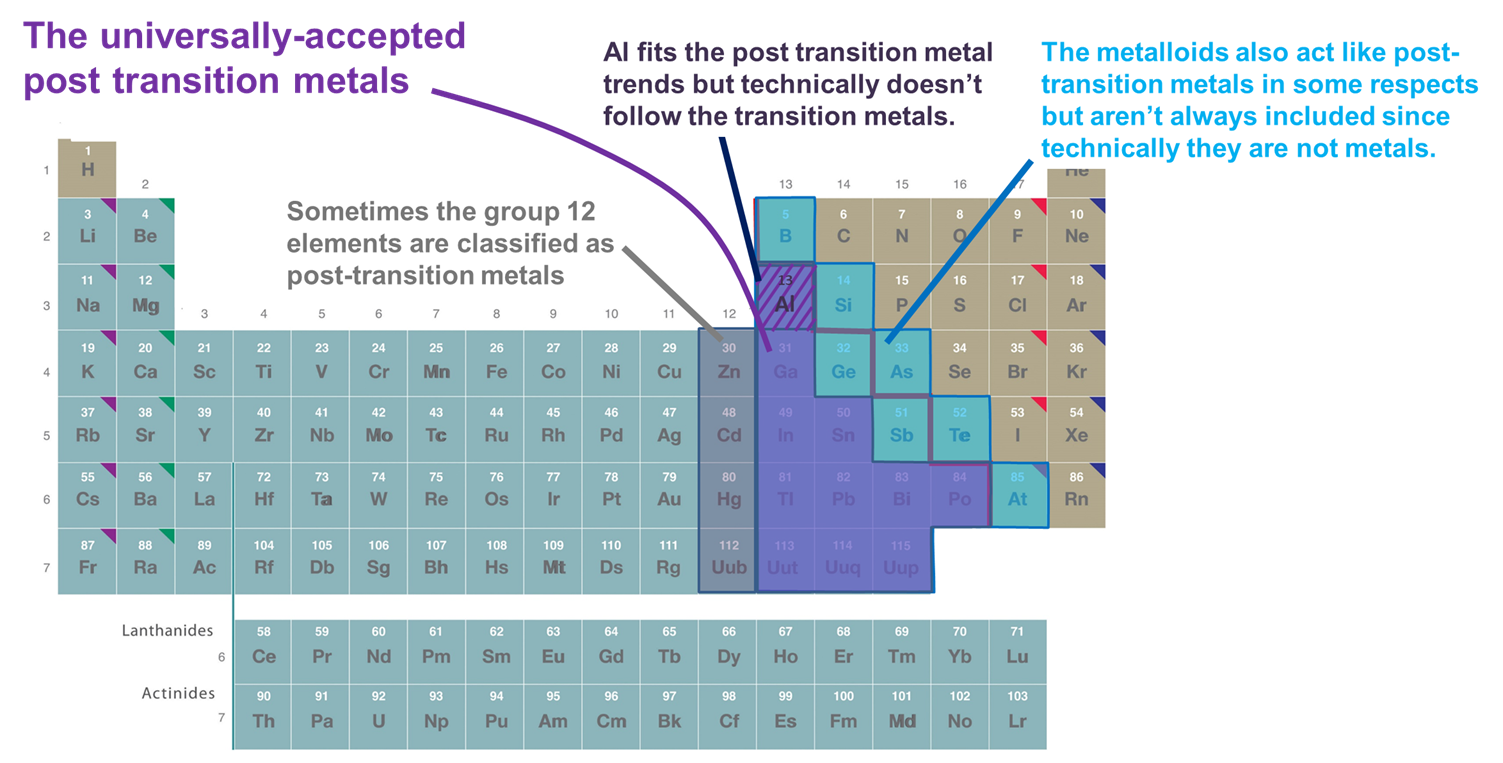
El grupo 13 elementos incluyen metales post-transición.
El término metales post-transición se refiere a aquellos elementos que son metales que siguen a los metales de transición. Al igual que con el concepto metaloide, no hay consenso universal en cuanto a qué es exactamente un metal post transición. Afortunadamente, en la práctica es menos importante definir con precisión qué es y qué no es un metal post transición que entender la razón por la que podría ser útil clasificar los elementos como un metal post-transición.
Las principales características de los metales posteriores a la transición son que son relativamente ricos en electrones y electronegativos en comparación con lo que se piensa clásicamente como un metal. En términos generales, esto se traduce en puntos de fusión relativamente más bajos (ya que tienden a ocupar más niveles antiboinding en la estructura de la banda), mayor preferencia por la covalencia y mayor fragilidad que otros metales (debido a la unión direccional resultante). Su riqueza electrónica significa que tienden a formar cationes blandos.
Se utilizan varios sistemas para clasificar elementos como pertenecientes a los metales de posttransición. Los principales incluyen:
- Metales que siguen el bloque d. Por esta definición solo se incluyen los metales en los grupos 13 y superiores y las Filas 3 y superiores que forman cationes relativamente blandos y ricos en electrones y exhiben una covalencia significativa en su unión. Sin embargo, si se adopta este esquema demasiado rígidamente Al se excluye ya que técnicamente no sigue el bloque d- (y tiene una subcapa sin relleno (n-1) d) y se excluyen los metaloides, aunque muchos de ellos también forman cationes relativamente blandos y ricos en electrones con (n-1) d subconchas. Otra desventaja de este sistema es que enreda la cuestión de qué elementos deben clasificarse como metales post-transición con la cuestión espinosa de qué elementos deben clasificarse como metales vs. metaloides.
- Metales y metaloides del bloque p. Este sistema tiene la ventaja de enfatizar las propiedades interesantes y únicas de los metales y metaloides del bloque p, así como las continuidades en esas propiedades a través del bloque p. En consecuencia, se utilizará en las secciones que siguen. Sin embargo, tiene la desventaja de excluir metales como Zn, Cd y Hg, que forman muchos compuestos en los que el metal tiene una configuración (n-1) d 10.
- Metales que siguen los elementos de transición en el sentido de formar iones con una capa de valencia completamente completa (n-1) d a veces junto con Al y los metaloides del bloque p. Esta definición agrega Zn, Cd y Hg (y a veces Cu, Ag y Au) ya que forman iones con una configuración de electrones de valencia (n-1) d 10 como Zn 2+, Cd 2+ y Hg 2+ (y Cu +, Ag + y Au +). Dado que este capítulo sólo considera los elementos p -block para los efectos de este capítulo este sistema es funcionalmente idéntico al sistema 2.
Cualquiera que sea el esquema de clasificación que se utilice, a menudo es más útil pensar en la clasificación de los elementos como metales post-transiton como una forma de enfatizar similitudes en las propiedades químicas de un conjunto de elementos que como una forma de enfatizar cómo los metales posteriores a la transición difieren de otros metales. Los metales post-transición no son los únicos que forman cationes blandos o compuestos mejor descritos como mantenidos unidos por enlaces covalentes. Como dejaron en claro las secciones anteriores, incluso los metales alcalinos forman aniones en las circunstancias adecuadas y muchos compuestos de metales se describen mejor en términos de covalencia que interacciones iónicas. Esto ya fue evidente en la química de los metales alcalinotérreos Be y Mg discutidos en la sección anterior. En capítulos posteriores se describirá ampliamente en términos covalentes la unión y reactividad en complejos de coordinación y compuestos organometálicos.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

