8.6.1: Propiedades de los Elementos del Grupo 13 y Química del Boro
- Page ID
- 81433
Como elementos, el boro actúa como un no metal deficiente en electrones y el otro grupo 13 elementos metales que exhiben diversos grados de covalencia.
Las propiedades seleccionadas de los elementos del Grupo 13 se dan en la Tabla\(\sf{\PageIndex{1}}\).
Mesa\(\sf{\PageIndex{1}}\). Propiedades Seleccionadas del Grupo 13 Elementos distintos del Nihonio. Para obtener más información sobre cómo se obtuvieron estos datos, consulte la nota 1.
| Element | Forma Elemental |
Punto de fusión (\(\sf{^{\circ}C}\)) |
Electronegatividad Pauling |
Energía de ionización (KJ/mol) |
Afinidad de electrones (KJ/mol) |
Radio Atómico (Å) |
Radio Covalente (Å) |
| Boro, B |
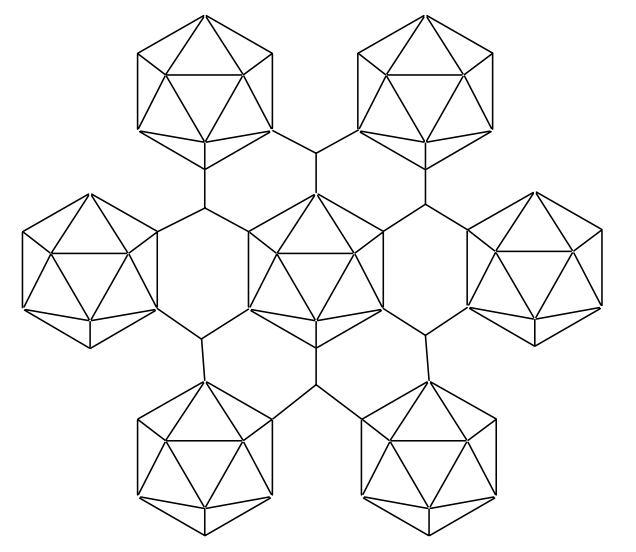
Red Covalente Sólido caracterizado por la compartición de electrones en cúmulos de boro, principalmente icosaedros enlazados, como los que se representan esquemáticamente a continuación.
|
2180 | 2.04 | 801 | 27 | 1.92 | 0.84 |
| Aluminio o Aluminio, 2 Al |
FCC Metálica
|
660 | 1.61 | 577 | 42 | 1.84 | 1.24 |
| Galio, Ga |
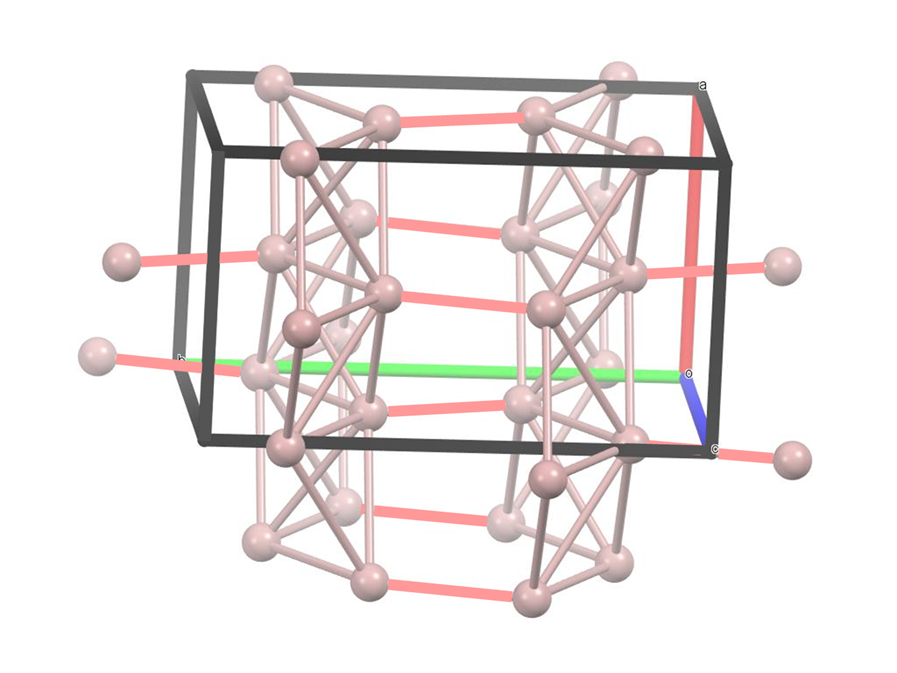
Metal con una estructura cristalina no estándar que puede describirse como unidades Ga 2 empaquetadas, las cuales se muestran unidas por las líneas rosadas más gruesas en la estructura de abajo.
|
30 | 1.81 | 579 | 41 | 1.87 | 1.23 |
| Indio |
Metal empaquetado cerrado distorsionado
|
157 | 1.78 | 558 | 36 | 1.93 | 1.42 |
| Talio, Tl |
HCP Metal
|
304 | 1.8 | 589 | 28.9 | 1.96 | 1.44 |
A partir de los datos que se dan en la Tabla se evidencian\(\sf{\PageIndex{1}}\) varias cosas:
1. Existe una discontinuidad entre las propiedades del Boro y los metales del grupo 13 en las filas 3 y superiores
1. El boro forma compuestos covalentes caracterizados por enlaces multicéntricos y formación de conglomerados; los otros elementos son metales que exhiben diversos grados de covalencia.
3. Las tendencias en las propiedades de los metales de la fila 3+ del grupo 13 están lejos de ser simples, probablemente en parte porque
- Las propiedades atómicas de Ga e In están influenciadas por la contracción del bloque d, dando a ambos una electronegatividad relativamente alta, que en combinación con sus radios pequeños promueven interacciones covalentes más fuertes.
- Las propiedades atómicas de Tl también están influenciadas por la contracción de los lantánidos, lo que resulta en un aumento en la electronegatividad y la energía de ionización en relación con In.
4. La interacción entre el cambio de interacciones covalentes y enlaces metálicos al pasar de Al a Tl resulta en una disminución en el punto de fusión de Al a Ga seguido de un aumento en el punto de fusión al pasar de Ga a Tl.
Los elementos del grupo 13 se preparan por reducción de haluros u óxidos o, en la base de boro, descomposición térmica del hidruro.
El boro se puede preparar por reducción de sus halogenuros o descomposición térmica a alta temperatura de sus hidruros.
\[\sf{2~BCl_3~~+~~3~H_2~~\longrightarrow~~2~B~~+~~6~HCl} \nonumber \]
\[\sf{B_2H_6~~\overset{\Delta}{\longrightarrow}~~2~B~~+~~3~H_2} \nonumber \]
Los metales del grupo 13 se obtienen por reducción electrolítica de los cationes en sales fundidas térmicamente accesibles. El ejemplo más conocido es la producción de aluminio en el proceso Hall Héroult.
\[\sf{2~Al_2O_3~~+~~3~C(s,~graphite)~~\overset{electrolysis, 940-980^{\circ}C, KF, Na_2AlF_6}{\longrightarrow}~~4~Al(s)~~+~~3~CO_2(g)} \nonumber \]
El boro forma enlaces covalentes y se involucra en la unión de grupos y/o puentes cuando hay muy pocos electrones para formar suficientes enlaces por pares para satisfacer un octeto.
El boro posee sólo tres electrones de valencia y puede estabilizarse compartiendo cinco más. Esto lo hace de tres formas principales.
1. El boro forma enlaces covalentes ordinarios y/o gana electrones para dar moléculas o iones estables. Por ejemplo, mientras que el boro de B de BH 3 monomérico puede no tener acceso a suficientes electrones de valencia para lograr un octeto estable, puede satisfacer su octeto formando un aducto con una base de Lewis. Un ejemplo bien conocido es el anión borohidruro, BH 4 -.
\[\sf{BH_3~~+~~H^-~~\longrightarrow~~BH_4^-} \nonumber \]
Un gran número de compuestos de boro son de este tipo. Estos incluyen
a. Los boratos y derivados del ácido bórico que comprenden unas pocas ppm de la corteza terrestre. Estos contienen aniones borato similares al conjunto representativo que se muestra en el Esquema\(\sf{\PageIndex{II}}\). De estos, el borato de sodio o borox se usa comúnmente en detergentes domésticos. Más precisamente, hay una mezcla de boraxes, todos los cuales son de fórmula [Na (H 2 O) x] 2 H 2 B 4 O 9 (a menudo escritos como Na 2 B 4 O 7 ·xH 2 O) y difieren en el número de aguas de hidratación. Todos contienen el anión tetraborato, B 4 O 5 (OH) 4 2-, que tiene la estructura mostrada a la derecha en el Esquema\(\sf{\PageIndex{II}}\)..
Esquema\(\sf{\PageIndex{II}}\). El anión tetraborado.
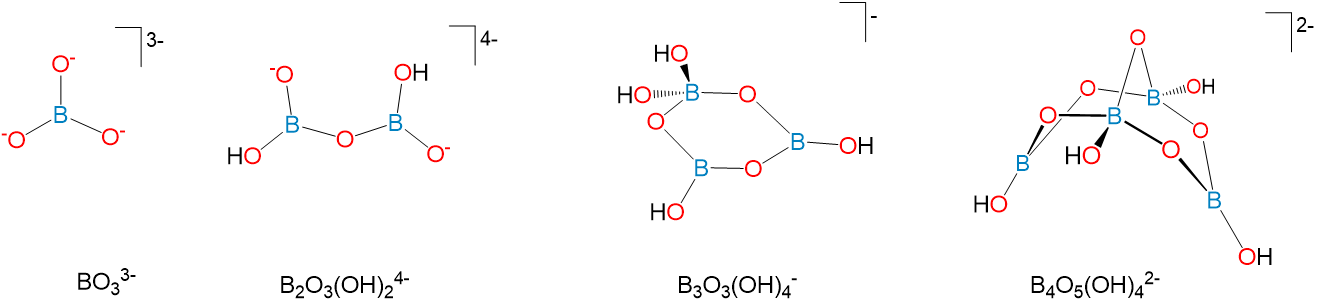
Como lo ilustran las estructuras representadas en el Esquema\(\sf{\PageIndex{II}}\), el boro en boratos se encuentra en tetraedros BO 4 y unidades BO 3 planas trigonales unidas entre sí de diversas maneras.
Los boratos illustran las propiedades ácido-base de estos compuestos convencionales de boro. Los aniones borato pueden considerarse derivados de la hidrólisis de óxido bórico a ácido bórico seguido de disociación ácida.
\[\sf{\underset{boric~acid}{B_2O_3}~~+~~3~H_2O~~\longrightarrow~~\underset{boric~acid}{2~B(OH)_3}} \nonumber \]
\[\sf{B(OH)_3~~\rightleftharpoons~~H^+~~+~~B(OH)_2O^-} \nonumber \]
\[\sf{B(OH)_3~~\rightleftharpoons~~3~H^+~~+~~BO_3^{3-}} \nonumber \]
En este sentido, los óxidos de boro, como todos los óxidos metálicos, son capaces de actuar como un ácido de Brønsted, aunque muy débil. En consecuencia los aniones borato, ya que las bases conjugadas de los ácidos débiles son bases de Brønsted.
Los sitios de boro plano trigonal en especies como el ácido bórico ilustran la capacidad del boro plano trigonal para actuar como un ácido de Lewis, específicamente formando un aducto de base de Lewis.
\[\sf{B(OH)_3~~+~~OH^-~~\rightleftharpoons~~B(OH)_4^-} \nonumber \]
Observe que los tres centros coordinados de boro en Scheme no\(\sf{\PageIndex{II}}\) se dibujan como poseedores de un octeto, aunque sería posible dibujar formas de resonancia que satisfagan el octeto de boro dibujando estructuras de resonancia en las que hay enlaces B=O. Esto se debe a que no está claro que tales estructuras de resonancia contribuyen significativamente a la unión en los centros de boro planos trigonales. Para ver por qué, es útil considerar los trihaluros de boro.
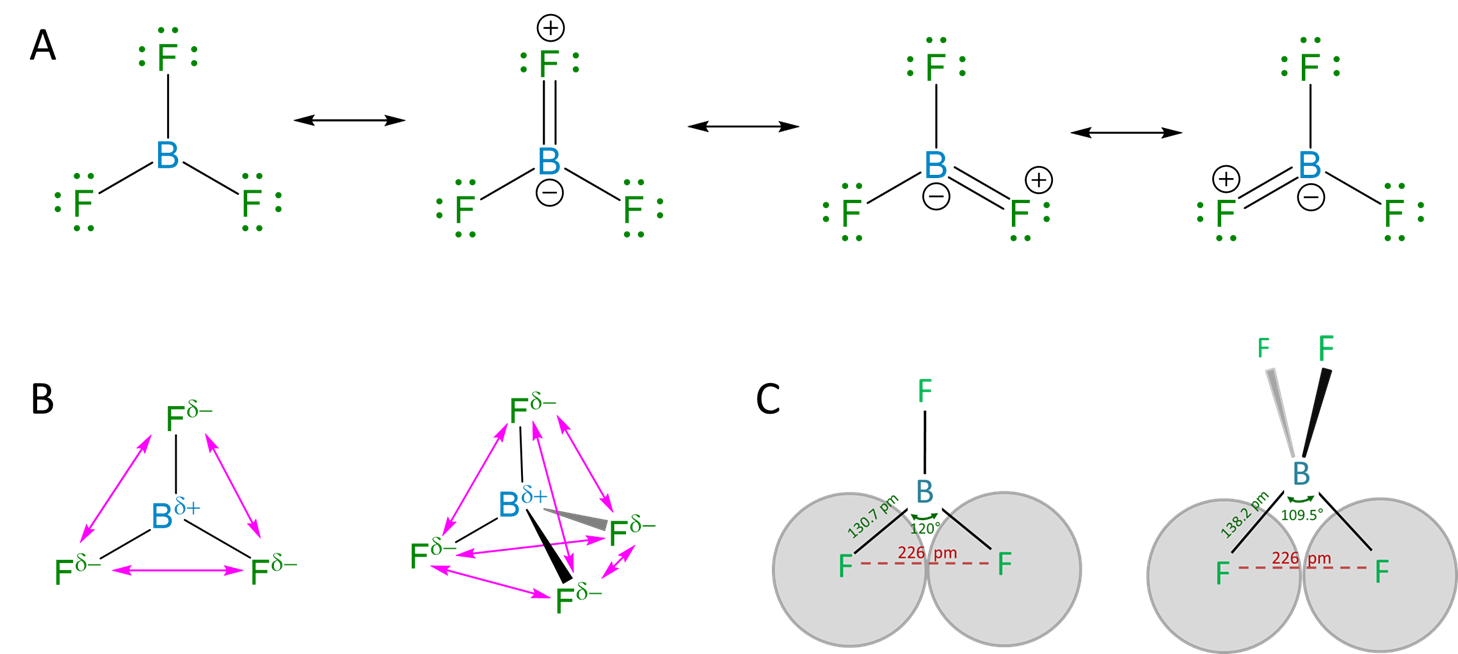
b. Los trihaluros de boro. Estructuralmente, los trihaluros de boro como BCl3 poseen una estructura plana trigonal como la de las unidades BO 3 de ácido bórico y boratos metálicos. Lo notable de la estructura es que los enlaces B-X son más cortos que los de estructuras tetraédricas análogas, como se ilustra en el Esquema\(\sf{\PageIndex{III}}\).
Esquema\(\sf{\PageIndex{III}}\). Aumento de la longitud del enlace B-Cl a medida que el centro de boro pasa de coordinación piramidal trigonal a tetraédrica en la formación de un aducto con amoníaco. Reproducido a partir de un dibujo de Ben Mills basado en la referencia 6.

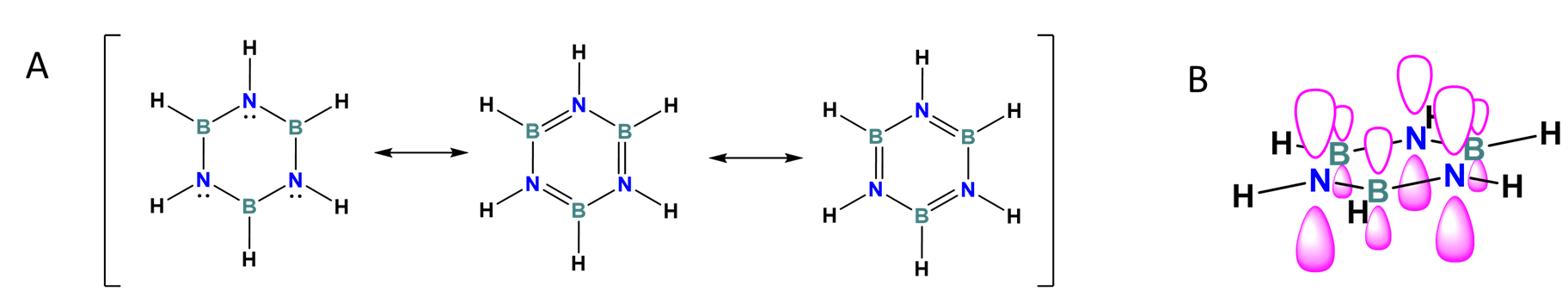
c. La borazina y los polimorfos del nitruro de boro. Una clase de compuestos en los que se cree que los enlaces múltiples que involucran boro juegan algún papel son la borazina y el polimorfo hexagonal del nitruro de boro, BN.
La borazina, B 3, N 3 H 6, es isoelectrónica e isoestructural al benceno, C 6 H 6, y tiene propiedades muy similares. Ambos tienen una estructura molecular hexagonal plana, son no polares y existen como líquidos de punto de ebullición relativamente bajo a temperatura ambiente. La existencia de\(\pi\) enlaces deslocalizados en el anillo de borazina puede inferirse en que las distancias de enlace B-N de 1.44 Å en borazina son menores que las distancias de ~1.6 Å B-N típicas de los enlaces sencillos B-N en sistemas tetraédricos 8 y cercanas a la distancia de enlace C-C de 1.42 Å en benceno. Mientras que en el benceno la deslocalización de electrones se extiende uniformemente alrededor del sistema de anillos de carbono, en la borazina la mayor electronegatividad del N asegura que la densidad de electrones por encima y por debajo de la borazina se concentre más fuertemente cerca de los átomos de N más electronegativos. Esto se representa por las descripciones de resonancia y orbitales de\(\pi\) unión representadas en Scheme\(\sf{\PageIndex{IV}}\). Como resultado de la mayor densidad electrónica en N y la deficiencia de electrones resultante en B, los átomos B y N de la borazina conservan considerable carácter ácido y base de Lewis, respectivamente.
Esquema\(\sf{\PageIndex{IV}}\). (A) Representación por resonancia del enlace en borzaína y (B) representación del MO de\(\pi\) unión de energía más baja en borazina sembrando la mayor densidad de electrones en los átomos de N más electronegativos.
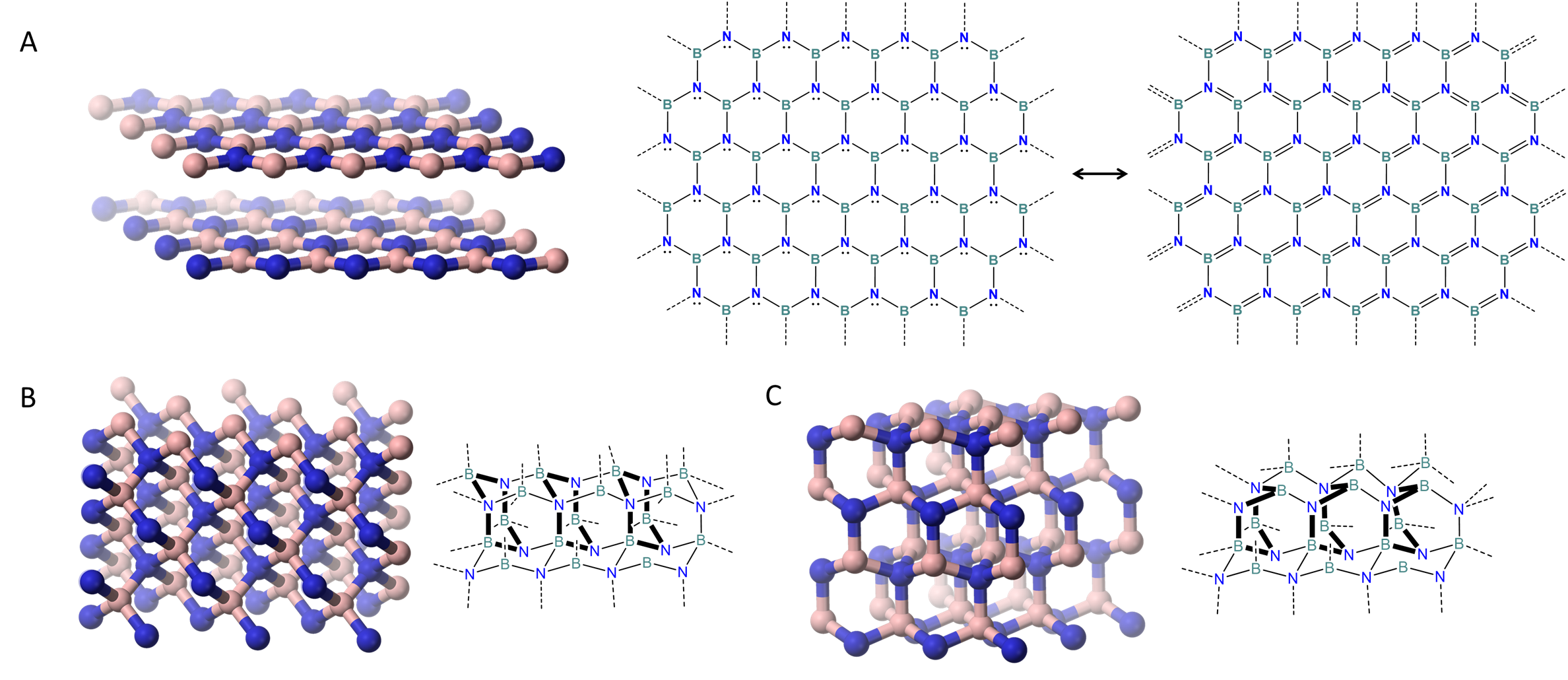
Aunque la estructura hexagonal estratificada del nitruro de boro es la más estable, BN también forma dos polimorfos en los que los átomos B y N están coordinados tetraédrialmente que son análogos a las formas cúbicas de diamante y Lonsdaleita del carbono. Estos se dan en Figuras\(\sf{\PageIndex{3B}}\) y\(\sf{\PageIndex{3C}}\). Se puede pensar que consisten en capas de sillas B 3 N 3 entrelazadas enlazadas. Las dos formas difieren en cuanto a si las capas están dispuestas de manera que se vinculen en forma de silla o embarcación conformación B 3 N 3 anillos.
2. El boro puede lograr configuraciones de unión estables al compartir electrones a través de enlaces puente. Estos son comunes en los hidruros de boro. Por ejemplo, otra forma en que el B de BH 3 puede lograr un octeto es formar dos enlaces puente de electrones centro-tres, como en el diborano.
 \[ \nonumber \]
\[ \nonumber \]
Las descripciones de enlaces de valencia y orbitales moleculares de estos puentes de “dos electrones y tres centros” en estas moléculas ya se han descrito en 8.2.1. Propiedades Químicas del Hidrógeno.
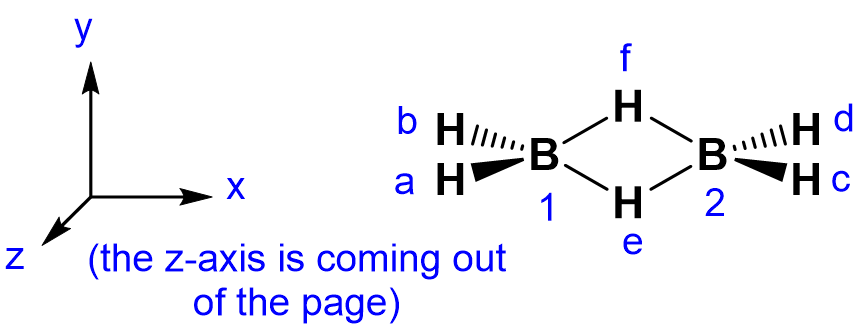
Se invita a quienes deseen revisar la descripción MO de vinculación a considerar la derivación de los MO de diborano dados en el Ejemplo\(\PageIndex{1}\).
Utilice el método del operador de proyección para derivar MO para diborano. A continuación se muestra la estructura del diborano, junto con las etiquetas atómicas y el sistema de coordenadas que se utilizarán en la clave de respuesta.
- Contestar
-
Diborane tiene simetría D 2h, bajo la cual los siguientes conjuntos de orbitales se transformarán entre sí y deben considerarse como un conjunto:
H 1s, a, H 1s, b, H 1s, c, H 1s, d
H 1s, f, H 1s, e
B 1s,1, B 1s,2
B px,1, B px,2
B py,1, B py,2
B pz,1, B pz,2
El uso del método operador de proyección con los siguientes orbitales generadores da:
Generador orbital E C 2
(z)
C 2
(y)
C 2
(x)
i σ
(xy)
σ
(xz)
σ
(yz)
Set 1: H 1s, a H 1s, a H 1s, c H 1s, d H 1s, b H 1s, d H 1s, b H 1s, a H 1s, c Set 2: H 1s, e H 1s, e H 1s, f H 1s, e H 1s, f H 1s, f H 1s, e H 1s, f H 1s, e Conjunto 3: B 1s,1 B 1s,1 B 1s,2 B 1s,2 B 1s,1 B 1s,2 B 1s,1 B 1s,1 B 1s,2 Set 4: B px,1 B px,1 -B px,2 -B px,2 B px,1 -B px,2 B px,1 B px,1 -B px,2 Conjunto 5: B py,1 B py,1 -B py,2 B py,2 -B py,1 -B py,2 B py,1 -B py,1 B py,2 Juego 6: B pz,1 B pz,1 B pz,2 -B pz,2 -B pz,1 -B pz,2 -B pz,1 B pz,1 B pz,2 El uso de estas proyecciones para generar orbitales es sencillo pero mucho trabajo.
Para el Conjunto 1, El terminal H 1s orbitales, tomando el orbital 1s en H a como el orbital del generador:
ψ (A g)? = [1 (H 1sa) + (1) (H 1sc) + (1) (H 1sd) + (1) (H 1sb) + (1) (H 1sd) + (1) (H 1sb) + (1) (H 1sa) + (1) (H 1sc)]
ψ (A g) = 2H 1sa + 2H 1sb + 2H 1sc + 2H 1sd Entonces, habrá uno a g orbital (w/ todos los 1s en fase)
ψ (B 1g)? = [1 (H 1sa) + (1) (H 1sc) + (-1) (H 1sd) + (-1) (H 1sb) + (1) (H 1sd) + (1) (H 1sb) + (-1) (H 1sa) + (-1) (H 1sc)]
ψ (B 1g) = 0H 1sa + 0H 1sb + 0H 1sc + 0H 1sd No b 1g orbital
ψ (B 2g)? = [1 (H 1sa) + (-1) (H 1sc) + (1) (H 1sd) + (-1) (H 1sb) + (1) (H 1sd) + (-1) (H 1sb) + (1) (H 1sa) + (-1) (H 1sc)]
ψ (B 2g) = 2H 1sa - 2H 1sb - 2H 1sc + 2H 1sd Entonces, habrá uno b 2g orbital
ψ (B 3g)? = [1 (H 1sa) + (-1) (H 1sc) + (-1) (H 1sd) + (1) (H 1sb) + (1) (H 1sd) + (-1) (H 1sb) + (-1) (H 1sa) + (-1) (H 1sc)]
ψ (B 3g) = = 0H 1sa + 0H 1sb + 0H 1sc + 0H 1sd No b 3g orbital
ψ (A u)? = [1 (H 1sa) + (1) (H 1sc) + (1) (H 1sd) + (1) (H 1sb) + (-1) (H 1sd) + (-1) (H 1sb) + (-1) (H 1sa) + (-1) (H 1sc)]
ψ (A u) = 0H 1sa + 0H 1sb + 0H 1sc + 0H 1sd Entonces, no habrá una u orbital
ψ (B 1u)? = [1 (H 1sa) + (1) (H 1sc) + (-1) (H 1sd) + (-1) (H 1sb) + (-1) (H 1sd) + (-1) (H 1sb) + (1) (H 1sa) + (1) (H 1sc)]
ψ (B 1u) = 2H 1sa - 2H 1sb + 2H 1sc - 2H 1sd Entonces, habrá uno b 1u orbital
ψ (B 2u)? = [1 (H 1sa) + (-1) (H 1sc) + (1) (H 1sd) + (-1) (H 1sb) + (-1) (H 1sd) + (1) (H 1sb) + (-1) (H 1sa) + (1) (H 1sc)]
ψ (B 2u) = 0H 1sa + 0H 1sb + 0H 1sc + 0H 1sd Entonces, no habrá b 2u orbital
ψ (B 3u)? = [1 (H 1sa) + (-1) (H 1sc) + (-1) (H 1sd) + (1) (H 1sb) + (-1) (H 1sd) + (1) (H 1sb) + (1) (H 1sa) + (-1) (H 1sc)]
ψ (B 3u) = 2H 1sa + 2H 1sb - 2H 1sc - 2H 1sd Entonces, habrá uno b 3u orbital
Entonces el primer conjunto da los siguientes orbitales terminales del grupo de hidrógeno 1s:

Para el Conjunto 2, Los orbitales H 1s en el puente H, tomando el orbital 1s en H e como el orbital del generador.
ψ (A g)? = [1 (H 1se) + (1) (H 1sf) + (1) (H 1se) + (1) (H 1sf) + (1) (H 1sf) + (1) (H 1se) + (1) (H 1sf) + (1) (H 1se)]
ψ (A g) = 4H 1se + 4H 1sf Entonces, habrá uno a g orbital (w/ ambos 1s en fase)
ψ (B 1g)? = [1 (H 1se) + (1) (H 1sf) + (-1) (H 1se) + (-1) (H 1sf) + (1) (H 1sf) + (1) (H 1se) + (-1) (H 1sf) + (-1) (H 1se)
ψ (B 1g) = 0H 1se + 0H 1sf No b 1g orbital
ψ (B 2g)? = [1 (H 1se) + (-1) (H 1sf) + (1) (H 1se) + (-1) (H 1sf) + (1) (H 1sf) + (-1) (H 1se) + (1) (H 1sf) + (-1) (H 1se)]
ψ (B 2g) = 0H 1se + 0H 1sf Entonces, no habrá b 2g orbital
ψ (B 2g)? = [1 (H 1se) + (-1) (H 1sf) + (-1) (H 1se) + (1) (H 1sf) + (1) (H 1sf) + (-1) (H 1se) + (-1) (H 1sf) + (1) (H 1se)]
ψ (B 3g) = = 0H 1sa + 0H 1sb + 0H 1sc + 0H 1sd No b 3g orbital
ψ (A u)? = [1 (H 1se) + (1) (H 1sf) + (1) (H 1se) + (1) (H 1sf) + (-1) (H 1sf) + (-1) (H 1se) + (-1) (H 1sf) + (-1) (H 1se)]
ψ (A u) = 0H 1se + 0H 1sf Entonces, no habrá un orbital a u
ψ (B 1u)? = [1 (H 1se) + (1) (H 1sf) + (-1) (H 1se) + (-1) (H 1sf) + (-1) (H 1sf) + (-1) (H 1se) + (1) (H 1sf) + (1) (H 1se)]
ψ (B 1u) = 0H 1se + 0H 1sf Entonces, no habrá b 1u orbital
ψ (B 2u)? = [1 (H 1se) + (-1) (H 1sf) + (1) (H 1se) + (-1) (H 1sf) + (-1) (H 1sf) + (1) (H 1se) + (-1) (H 1sf) + (1) (H 1se)]
ψ (B 2u) = 4H 1se - 4H 1sf Entonces, habrá un orbital b 2u
ψ (B 3u)? = [1 (H 1se) + (-1) (H 1sf) + (-1) (H 1se) + (1) (H 1sf) + (-1) (H 1sf) + (1) (H 1se) + (1) (H 1sf) + (-1) (H 1se)]
ψ (B 3u) = 0H 1se + 0H 1sf Entonces, no habrá b 3u orbital
Entonces el segundo conjunto da los siguientes orbitales de grupo de hidrógeno puente 1 s:

Para el Conjunto 3, Los orbitales B 2s, tomando el orbital de 2 s en B1 como el orbital del generador:
ψ (A g)? = [1 (B s1) + (1) (B s2) + (1) (B s2) + (1) (B s1) + (1) (B s2) + (1) (B s2) + (B s1) + (1) (B s1) + (1) (B s2)]
ψ (A g) = 4B s,1 + 4B s,2 Entonces, habrá uno orbital a g (w/ los B 1s en fase)
ψ (B 1g)? = [1 (B s1) + (1) (B s2) + (-1) (B s2) + (-1) (B s1) + (1) (B s2) + (1) (B s1) + (-1) (B s1) + (-1) (B s1) + (-1) (B s2)]
ψ (B 1g) = 0B s,1 + 0B s,2 No b 1g orbital
ψ (B 2g)? = [1 (B s1) + (-1) (B s2) + (1) (B s2) + (-1) (B s1) + (1) (B s2) + (-1) (B s1) + (1) (B s1) + (-1) (B s2)]
ψ (B 2g) = 0B s,1 + 0B s,2 No b 2g orbital
ψ (B 2g)? = [1 (B s1) + (-1) (B s2) + (-1) (B s2) + (1) (B s1) + (1) (B s2) + (-1) (B s1) + (-1) (B s1) + (1) (B s2)]
ψ (B 3g) = 0B s,1 + 0B s,2 No b 3g orbital
ψ (A u)? = [1 (B s1) + (1) (B s2) + (1) (B s2) + (1) (B s1) + (-1) (B s2) + (-1) (B s1) + (-1) (B s1) + (-1) (B s2)]
ψ (A u) = 0B s,1 + 0B s,2 Entonces, no habrá un orbital a u
ψ (B 1u)? = [1 (B s1) + (1) (B s2) + (-1) (B s2) + (-1) (B s1) + (-1) (B s2) + (-1) (B s1) + (1) (B s1) + (1) (B s2)]
ψ (B 1u) = 0B s1 + 0B s2 Entonces, no habrá b 1u orbital
ψ (B 2u)? = [1 (B s1) + (-1) (B s2) + (1) (B s2) + (-1) (B s1) + (-1) (B s2) + (1) (B s1) + (-1) (B s1) + (1) (B s2)]
ψ (B 2u) = 0B s1 + 0B s2 Entonces, no habrá b 2u orbital
ψ (B 3u)? = [1 (B s1) + (-1) (B s2) + (-1) (B s2) + (1) (B s1) + (-1) (B s2) + (1) ( B s1) + (1) (B s1) + (-1) (B s2)]
ψ (B 3u) = 4B s1 - 4B s2 Entonces, habrá un orbital b 3u
Los orbitales del grupo boro 2 s son:

Para el Conjunto 4: Los orbitales B 2 p x, usando el orbital de 2 p x en B1 como orbital del generador:
ψ (A g)? = [1 (B px,1) + (1) (-B px2) + (1) (-B px2) + (1) (B px1) + (1) (-B px2) + (1) (B px1) + (1) (B px1) + (1) (-B px2)]
ψ (A g) = 4B 1px1 - 4B 2px1 Entonces, habrá uno orbital a g (w/ el B 2p x antifase)
ψ (B 1g)? = [1 (B px,1) + (1) (-B px2) + (-1) (-B px2) + (-1) (B px1) + (1) (-B px2) + (1) (B px1) + (-1) (B px1) + (-1) (-1) (-B px2)]
ψ (B 1g) = 0B 1px1 + 0B 1px2 No b 1g orbital
ψ (B 2g)? = [1 (B px,1) + (-1) (-B px2) + (1) (-B px2) + (-1) (B px1) + (1) (-B px2) + (-1) (B px1) + (1) (B px1) + (-1) (-B px2)]
ψ (B 2g) = 0B 1px1 + 0B 1px2 No b 2g orbital
ψ (B 3g)? = [1 (B px,1) + (-1) (-B px2) + (-1) (-B px2) + (1) (B px1) + (1) (-B px2) + (-1) (B px1) + (-1) (B px1) + (1) (-B px2)]
ψ (B 3g) = 0B 1px1 + 0B 1px2 No b 3g orbital
ψ (A u)? = [1 (B px,1) + (1) (-B px2) + (1) (-B px2) + (1) (B px1) + (-1) (-B px2) + (-1) (B px1) + (-1) (B px1) + (-1) (-B px2)]
ψ (A u) = 0B 1px1 + 0B 1px2 Entonces, no habrá un orbital a u
ψ (B 1u)? = [1 (B 1s1) + (1) (B 1s2) + (-1) (B 1s2) + (-1) (B 1s1) + (-1) (B 1s2) + (-1) (B 1s1) + (1) (B 1s1) + (1) (B 1s2)]
ψ (B 1u) = 0B 1px1 + 0B 1px2 Entonces, no habrá b 1u orbital
ψ (B 2u)? = [1 (B px,1) + (-1) (-B px2) + (1) (-B px2) + (-1) (B px1) + (-1) (-B px2) + (1) (B px1) + (-1) (B px1) + (1) (-B px2)]
ψ (B 2u) = 0B 1px1 + 0B 1px2 Entonces, no habrá b 2u orbital
ψ (B 3u)? = [1 (B px,1) + (-1) (-B px2) + (-1) (-B px2) + (1) (B px1) + (-1) (-B px2) + (1) (B px1) + (1) (B px1) + (-1) (-B px2)]
ψ (B 3u) = 4B px1 + 4B px2 Entonces, habrá uno b 3u orbital
Entonces los orbitales del grupo B 2 p x son

Para el Conjunto 5: Los orbitales B 2 p y, tomando 2 p y en B1 como orbital del generador:
ψ (A g)? = [1 (B py1) + (1) (-B py2) + (1) (B py2) + (1) (-B py1) + (1) (-B py2) + (1) (B py1) + (1) (-B py1) + (1) (B py2)]
ψ (A g) = 0 B py1 + 0B py2 Entonces, no habrá a g orbital
ψ (B 1g)? = [1 (B py1) + (1) (-B py2) + (-1) (B py2) + (-1) (-B py1) + (1) (-B py2) + (1) (B py1) + (-1) (-B py1) + (-1) (B py2)]
ψ (B 1g) = 2 B py1 - 2 B py2 Una b 1g orbita l
ψ (B 2g)? = [1 (B py1) + (-1) (-B py2) + (1) (B py2) + (-1) (-B py1) + (1) (-B py2) + (-1) (B py1) + (1) (-B py1) + (-1) (B py2)]
ψ (B 2g) = 0B py1 + 0B py2; No b 2g orbital
ψ (B 2g)? = [1 (B py1) + (-1) (-B py2) + (-1) (B py2) + (1) (-B py1) + (1) (-B py2) + (-1) (B py1) + (-1) (-B py1) + (1) (B py2)]
ψ (B 2g) = 0B py1 + 0B py2; No b 3g orbital
ψ (A u)? = [1 (B py1) + (1) (-B py2) + (1) (B py2) + (1) (-B py1) + (-1) (-B py2) + (-1) (B py1) + (-1) (-B py1) + (-1) (B py2)]
ψ (A u) = 0B py1 + 0B py2; Entonces, no habrá un orbital a u
ψ (B 1u)? = [1 (B py1) + (1) (-B py2) + (-1) (B py2) + (-1) (-B py1) + (-1) (-B py2) + (-1) (B py1) + (1) (-B py1) + (1) (B py2)]
ψ (B 1u) = 0B py1 + 0B py2; Entonces, no habrá b 1u orbital
ψ (B 2u)? = [1 (B py1) + (-1) (-B py2) + (1) (B py2) + (-1) (-B py1) + (-1) (-B py2) + (1) (B py1) + (-1) (-B py1) + (1) (B py2)]
ψ (B 2u) = 4 B py1 + 4 B py2; Entonces, habrá un orbital b 2u
ψ (B 3u)? = [1 (B py1) + (-1) (-B py2) + (-1) (B py2) + (1) (-B py1) + (-1) (-B py2) + (1) (B py1) + (1) (-B py1) + (-1) (B py2)]
ψ (B 3u) = 0B py1 + 0B py2; Entonces, no habrá b 3u orbital
Entonces los orbitales del grupo B 2 p y son

Para el Conjunto 6: Los orbitales B 2 p z, tomando el orbital 2 p z de B1 como orbital del generador.
ψ (A g)? = [1 (B pz1) + (1) (B pz2) + (1) (-B pz2) + (1) (-B pz1) + (1) (-B pz2) + (1) (-B pz1) + (1) (B pz1) + (1) (B pz2)]
ψ (A g) = 0 B pz1 + 0 B pz2 Entonces, habrá un orbital a g
ψ (B 1g)? = [1 (B pz1) + (1) (B pz2) + (-1) (-B pz2) + (-1) (-B pz1) + (1) (-B pz2) + (1) (-B pz1) + (-1) (B pz1) + (-1) (B pz2)]
ψ (B 1g) = 0 B pz1 + 0B pz2 Entonces, no habrá b 1g orbital
ψ (B 2g)? = [1 (B pz1) + (-1) (B pz2) + (1) (-B pz2) + (-1) (-B pz1) + (1) (-B pz2) + (-1) (-B pz1) + (1) (B pz1) + (-1) (B pz2)]
ψ (B 2g) = 4 B pz1 - 4 B pz2 Entonces, habrá una b 2g orbita l
ψ (B 3g)? = [1 (B pz1) + (-1) (B pz2) + (-1) (-B pz2) + (1) (-B pz1) + (1) (-B pz2) + (-1) (-B pz1) + (-1) (B pz1) + (1) (B pz2)]
ψ (B 3g) = 0 B pz1 + 0B pz2 Entonces, no habrá b 3g orbital
ψ (A u)? = [1 (B pz1) + (1) (B pz2) + (1) (-B pz2) + (1) (-B pz1) + (-1) (-B pz2) + (-1) (-B pz1) + (-1) (B pz1) + (-1) (B pz2)]
ψ (A u) = 0 B pz1 + 0B pz2 Entonces, no habrá un orbital a u
ψ (B 1u)? = [1 (B pz1) + (1) (B pz2) + (-1) (-B pz2) + (-1) (-B pz1) + (-1) (-B pz2) + (-1) (-B pz1) + (1) (B pz1) + (1) (B pz2)]
ψ (B 1u) = 4 B pz1 + 4 B pz2 Entonces, habrá un orbital b 1u
ψ (B 2u)? = [1 (B pz1) + (-1) (B pz2) + (1) (-B pz2) + (-1) (-B pz1) + (-1) (-B pz2) + (1) (-B pz1) + (-1) (B pz1) + (1) (B pz2)] Y (B 2u) = 0 p z1 + 0B pz2 Entonces, no habrá b Orbital 2u
ψ (B 3u)? = [1 (B pz1) + (-1) (B pz2) + (-1) (-B pz2) + (1) (-B pz1) + (-1) (-B pz2) + (1) (-B pz1) + (1) (B pz1) + (-1) (B pz2)]
ψ (B 3u) = 0 B pz1 + 0B pz2 Entonces, no habrá b 3u orbital
Entonces los orbitales del grupo B 2 p z son

Finalmente, para construir MO para grupos de diboranos se debe permitir que se mezclen orbitales de la misma simetría. La manera exacta en que esto ocurre debería predecirse idealmente realizando un cálculo químico cuántico. Sin embargo, un diagrama aproximado puede estimarse cualitativamente a partir de las energías orbitales atómicas (que están convenientemente disponibles en una tabla periódica de energías orbitales atómicas). El resultado se da en 8.2.1. Propiedades Químicas del Hidrógeno, reproducidas por conveniencia a continuación.
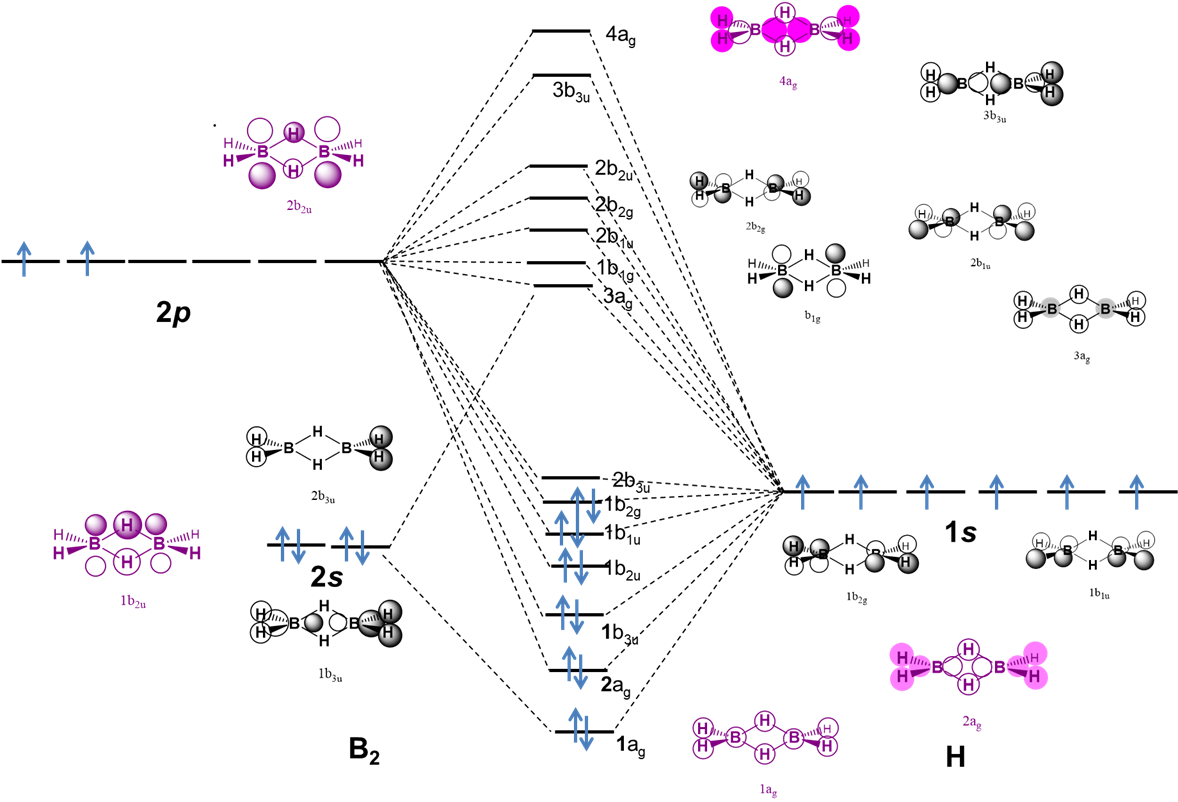
3. Compartir electrones entre múltiples átomos de boro y otros en un cúmulo. Dichos conglomerados son muy comunes entre los hidruros de boro (boranos) y sus derivados. Ejemplos de se dan en Esquema\(\sf{\PageIndex{V}}\).
Esquema\(\sf{\PageIndex{V}}\). Ejemplos de cúmulos de boro deficientes en electrones. Estos consisten en un grupo H-B: grupos en los que los átomos B se mantienen unidos al compartir electrones entre los átomos del cúmulo. Los enlaces B-B y B-B en estas imágenes se dibujan para ayudar a definir la forma del cúmulo, en la que los átomos B tienden a ocupar los vértices de un deltaedro.
Muchos aspectos de la unión en racimos se explicarán con más detalle en la Sección 15.4 Compuestos de racimos, que también presenta las reglas de Wade y la Teoría de Par de Electrones Esqueléticos Poliédricos que pueden ser utilizados para racionalizar su estabilidad. En cambio, esta sección se centra en delinear algunas características de la química del borano.
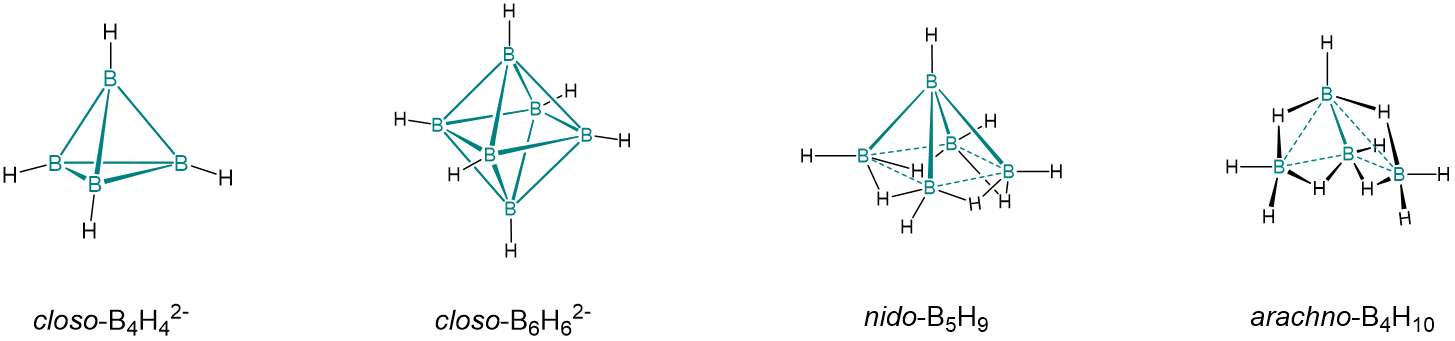
Los clústeres deficientes en electrones se distinguen en función de si su forma es la de un deltaedro completo, un tipo de poliedro en el que todas las caras son triángulos equiláteros. En los clústeres de c loso, los átomos de vértice comprenden un deltaedro completo mientras que en los racimos nido -, aracno- e hifo- uno, dos y tres de los vértices del deltaedro están desocupados, respectivamente. Por ejemplo, en el Esquema\(\sf{\PageIndex{V}}\) tetraédrico B 4 H 4 2- y octaédrico B 6 H 6 2- son closo -mientras que el cuadrado piramidal B 5 H 9 es nido - ya que corresponde a un octaedro con un vértice faltante.
Observe también que existen enlaces puente B-H-B a lo largo de los bordes de los vértices abiertos en los clústeres nido y aracno de Scheme\(\sf{\PageIndex{IV}}\). Esta es una característica común de tales conglomerados, aunque estos hidrógenos no siempre están presentes ya que estos hidrógenos a menudo se pueden desprotonar para dar racimos aniónicos estables.
\[\sf{B_5H_9~~+~~MH~~\overset{low~T}{\longrightarrow}~~M^+~~+~~B_5H_8^-~~H_2~~~~~~~~~~(M~=~alkali~metal)} \nonumber \]
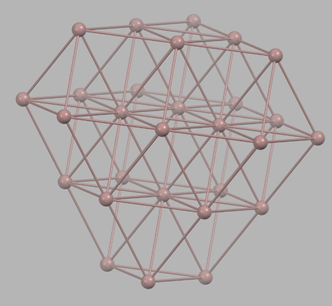
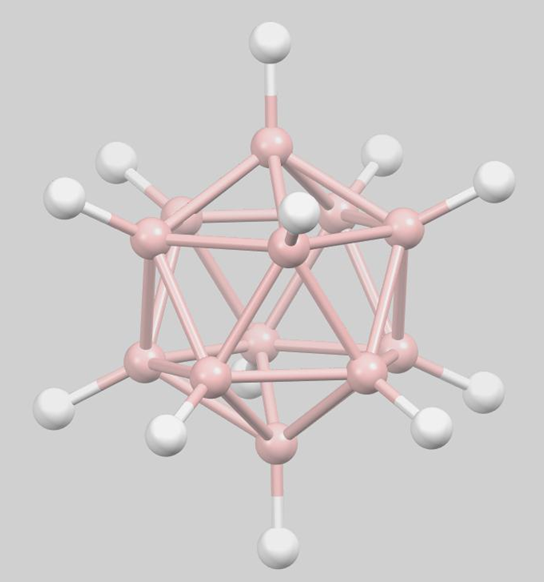
Muchos boranos son aniónicos. El más icónico es el closo- dodecaborato icosaédrico, B 12 H 12 2-, cuya estructura se muestra en la Figura\(\sf{\PageIndex{3}}\).
Típicamente, los boranos superiores se forman por eliminación pirolítica de las unidades H 2, H - y/o H + de BH 3 o BH 4 -. Este proceso puede ser conceptualizado como dando lugar a unidades BH, BH - y BH 2 que se fusionan en racimos. Este proceso puede verse en parte considerando la preparación de c loso- dodecaborato. Primero se piroliza el diborano para dar aracno-decaborano (14), B 10 H 14, en un proceso en el que la pérdida de enlaces B-H y B-H-B es compensada por la formación de enlaces agrupados en los que múltiples átomos B comparten los electrones de unión. El aracno-decaborano resultante (14), B 10 H 14, tiene la forma icosaédrica de dodecaborante.
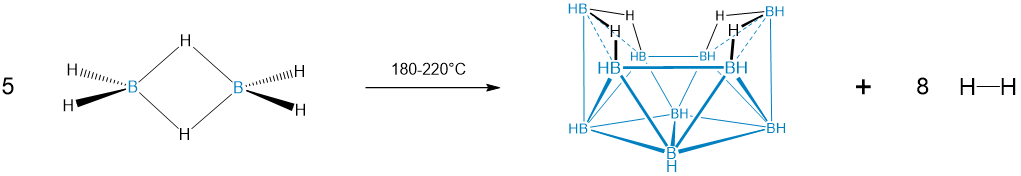 \[ \nonumber \]
\[ \nonumber \]
Los dos vértices faltantes en el racimo aracno se suman al permitir que el clúster reaccione con unidades adicionales de BH 3, esta vez en forma del aducto Et 3 N-BH 3.
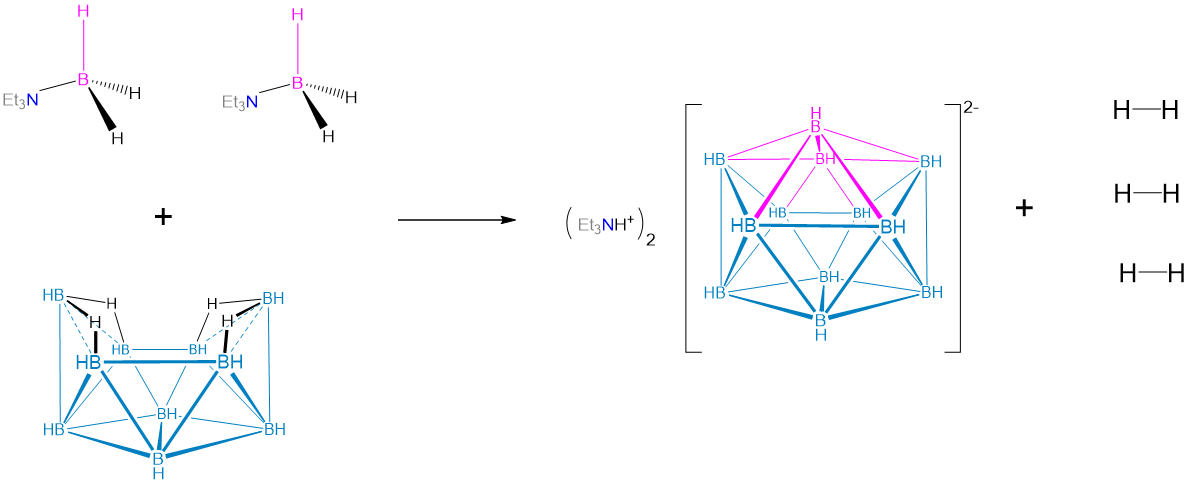 \[ \nonumber \]
\[ \nonumber \]
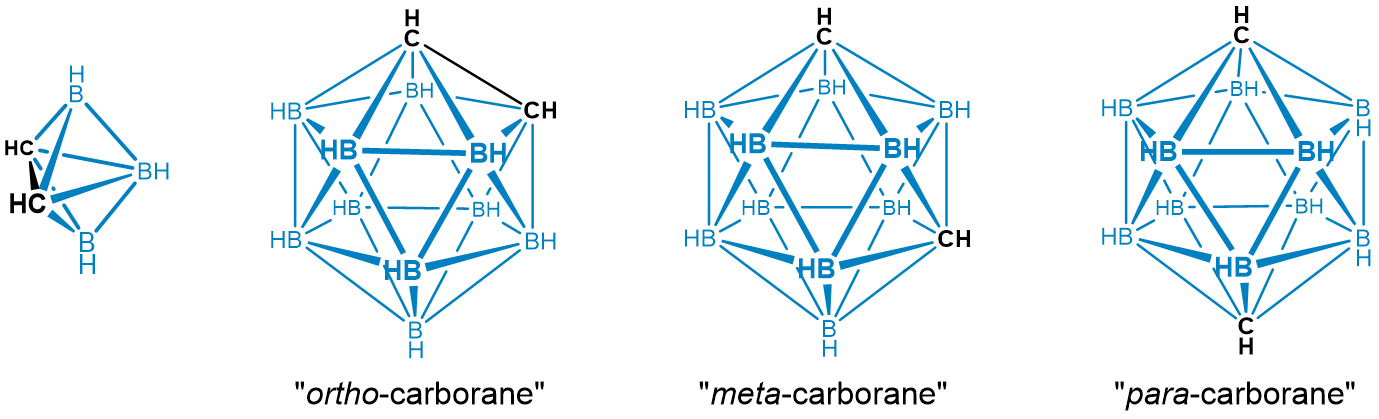
Por último, cabe señalar que elementos distintos al boro pueden formar racimos y que, en consecuencia, el boro forma racimos mixtos con una variedad de elementos. Algunos ejemplos incluyen los carboranos representados en Scheme\(\sf{\PageIndex{VI}}\).
Esquema\(\sf{\PageIndex{VI}}\). Algunos racimos de carborano, incluyendo el orto -, meta- y para- “carborano”, C 2 B 10 H 12.
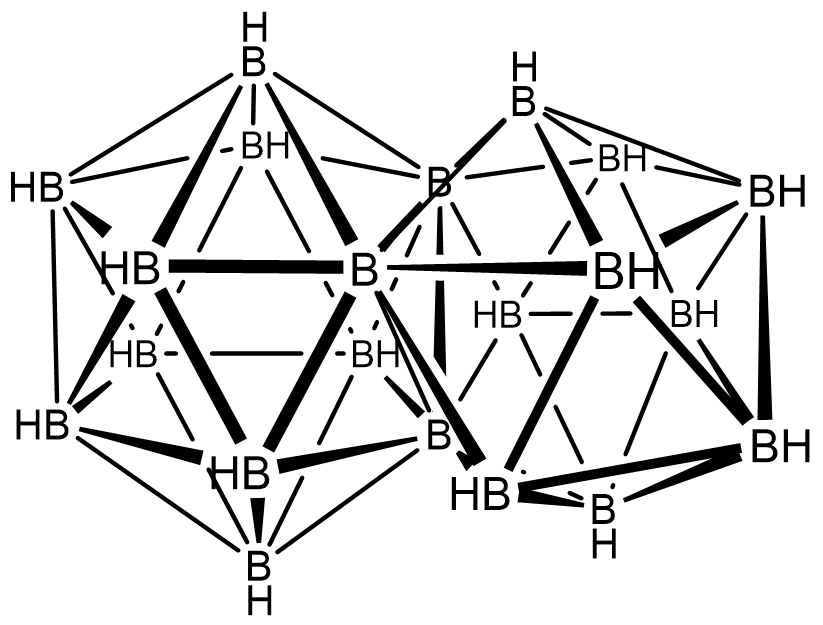
Además de closo-, nido-, aracno- e hifoboranos ordinarios, hay conjunto-boranos, que consisten en dos cúmulos unidos a través de un enlace B-B, en un vértice, borde o cara. Un ejemplo de tal cluster se muestra en Scheme\(\sf{\PageIndex{VI}}\).
Esquema\(\sf{\PageIndex{VII}}\). Una conjunto de cara compartida - borano.
Los boranos y sus derivados son objeto de investigación en curso sobre terapias efectivas de captura de neutrones para el tratamiento de tumores de cabeza y cuello. La base de estas terapias es la química nuclear de su isótopo 10 B, que comprende 19.6% del boro natural (el 80.4% restante es 11 B). El boro-10 puede absorber neutrones para dar 11 B excitado, que sufre desintegración radiativa a través de la emisión alfa:
\[\sf{Neutron ~capture:~~~~\ce{^{10}_5B~~+~~^1_1n~~\longrightarrow~~[^{11}_5B]$^{*}$}} \nonumber \]
\[\sf{alpha~emission:~~~~\ce{[^{11}_5B]$^{*}$~~\longrightarrow~~^7_3Li~~+~~^4_2He}} \nonumber \]
Esta secuencia de reacciones en aplicaciones médicas para tratar tumores se denomina terapia de captura de neutrones. Los principios básicos de la terapia de captura de neutrones se resumen en la Figura\(\sf{\PageIndex{4}}\).

Como se puede observar en la Figura\(\sf{\PageIndex{4}}\), el proceso consiste en irradiar el tumor con infusión de boro con neutrones. Estos neutrones son poco absorbidos por tejidos compuestos principalmente por los seis grandes elementos de la bioquímica (C, H, N, O, S y P) y por lo tanto dañan mínimamente el tejido normal. Sin embargo, en las células tumorales infundidas de boro\(\ce{$[$^{11}_5B$]$^{$*$}}\) producidas por la captura de neutrones se degrada para dar alta energía\(\sf{^7_3Li}\) y\(\sf{^4_2He}\) que dañan el tejido canceroso circundante.
La terapia efectiva de captura de neutrones requiere el uso de un reactivo de boro que de otro modo no es tóxico y puede ser suministrado selectivamente a las células cancerosas en concentraciones terapéuticas eficaces. Esto ha sido un reto de investigación considerable y el desarrollo de dichos reactivos es un tema de investigación en curso. Muchos de los compuestos probados hasta ahora son borano o carborano amino o análogos de ácido nucleico o conjugados de borano y diversas biomoléculas, aunque recientemente se ha demostrado que los liposomas infundidos con borano (los liposomas son preferentemente absorbidos y retenidos por los tumores) contra ciertos tipos de tumores en ratones.
Notas y Referencias
1. El nihonio no está incluido ya que como elemento sintético metaestable con semividas isotópicas de menos de 10 segundos se caracteriza poco. La estructura del boro se toma de https://chem.libretexts.org/Bookshelves/Inorganic_Chemistry/Book%3A_Inorganic_Chemistry_(Saito)/04%3A_Chemistry_of_Nonmetallic_Elements/4.02%3A_Main_group_elements_of_2nd_and_3rd_periods_and_their_ compuestos. Las estructuras FCC y HCP son PNGs originales de Daniel Mayer y DrBob, trazadas en Inkscape por Usuario:Stannered - Cúbico, face-centered.png: Celosía centrada en la cara cubic.svg:, CC BY-SA 3.0, commons.wikimedia.org/w/inde...? curid=1735631; Por! Original: DornelfVector: DePiep - Obra propia basada en: Hexagonal close packed.png, CC BY-SA 3.0, commons.wikimedia.org/w/inde... curid=20183889; las de Ga y In se renderizan usando Mercurio a partir de datos depositados en la Base de Datos de Proyectos de Materiales como se informa en las referencias 4 y 5, respectivamente. Los valores de electronegatividad, energía de ionización, afinidad electrónica y radios se toman de la base de datos de tablas periódicas de la Royal Society of Chemistry en https://www.rsc.org/periodic-table/.
2. Llamado Aluminio en el Reino Unido y otros países donde se utiliza el inglés británico.
3. A. Jain*, S.P. Ong*, G. Hautier, W. Chen, W.D. Richards, S. Dacek, S. Cholia, D. Gunter, D. Skinner, G. Ceder, K.A. Persson (*=contribuciones iguales)
El Proyecto de Materiales: Un enfoque del genoma de materiales para acelerar la innovación de materiales APL Materiales, 2013, 1 (1), 011002.
4. Sharma, B.D. y Donohue, J. Zeitschrift fuer Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1962, 117, 293.
5. Hull, A.W.; Davey, W.P.”, Revisión Física 1921, 17, 266-267.
6. Robinson, E. A.; Johnson, S. A.; Tang, T.-H.; Gillespie, R. J. Inorganic Chemistry 1997, 36 (14), 3022-3030.
7. Robinson, E.A.; Heard, G.L.; Gillespie, R.J. Journal of Molecular Structure 485—486 (1999) 305—319.
8. Orpen, A. G.; Brammer, L.; Allen, F. H.; Kennard, O.; Watson, D. G.; Taylor, R., Apéndice A: Distancias Interatómicas Típicas en Compuestos Orgánicos y Compuestos Organometálicos y Complejos de Coordinación de los metales del bloque d y f. En Correlación estructural, Wiley-VCH Verlag GmbH: 2008; pp 752-858.
9. Jae-Hyuk Her; Muhammed Yousufuddin; Wei Zhou; Satish S. Jalisatgi; James G. Kulleck; Jason A. Zan; Son-Jong Hwang; Robert C. Bowman; Terrence J. Udovic Química Inorgánica 2008, 47, 9757-9759.
10. Kueffer, P. J.; Maitz, C. A.; Khan, A.; Schuster, S. A.; Shlyakhtina, N. I.; Jalisatgi, S. S.; Brockman, J. D.; Nigg, D. W.; Hawthorne, M. F., Terapia de captura de neutrones de boro demostrada en ratones que portan tumores EMT6 tras la administración selectiva de boro por liposomas diseñados racionalmente. Actas de la Academia Nacional de Ciencias 2013, 110 (16), 6512-6517.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College