8.6.2: Elementos más pesados del Grupo 13 y el Efecto de Par Inerte
- Page ID
- 81432
Los metales del grupo 13 también forman compuestos convencionales, así como enlaces puente tipo M-X-M y agrupaciones similares a metales.
Los metales del grupo 13 forman una amplia variedad de compuestos que pueden explicarse en términos de unión covalente iónica o por pares. Hay óxidos generalmente pueden explicarse como iónicos. El óxido principal del talio, Tl 2 O, cristaliza en la celosía de CdI 2, y conssits de capas de octaedros enlazados por bordes, como se muestra en la Figura,\(\sf{\PageIndex{1A}}\) mientras que la forma más estable de Al 2 O 3, Corindón, consiste en capas de octaedros de AlO 6 enlazados en los bordes Vértice vinculado a capas adyacentes como se muestra en la Figura\(\sf{\PageIndex{1B}}\).
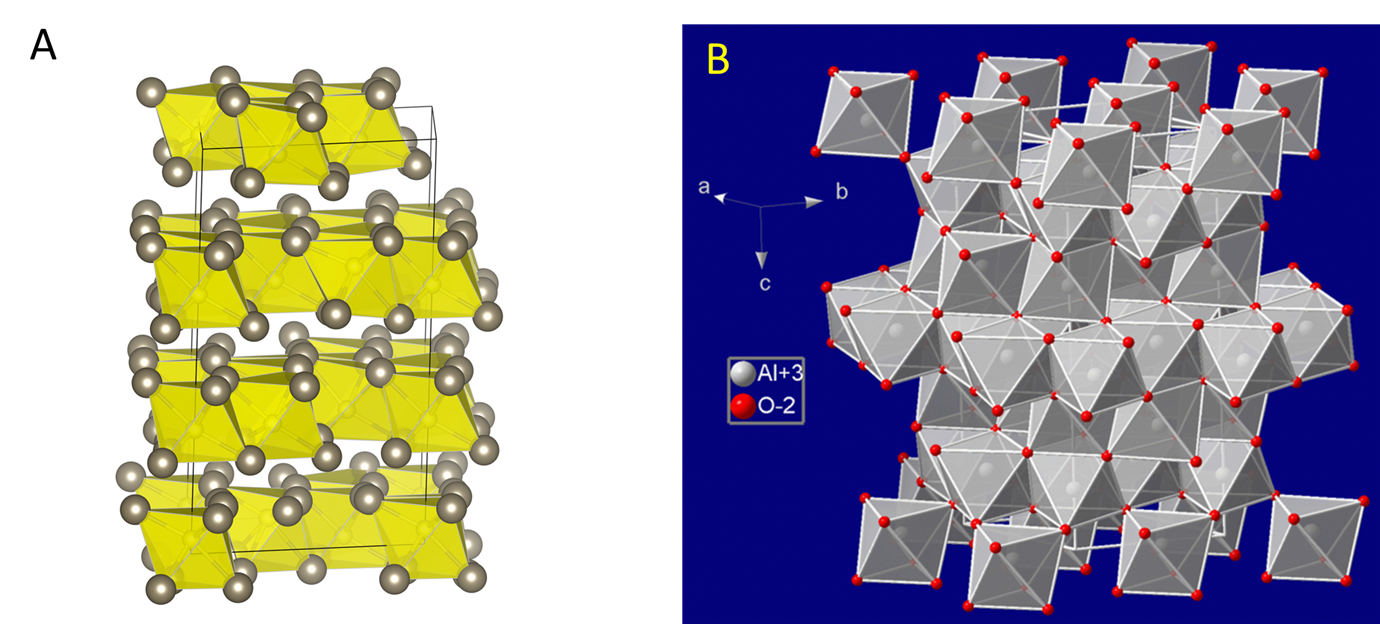
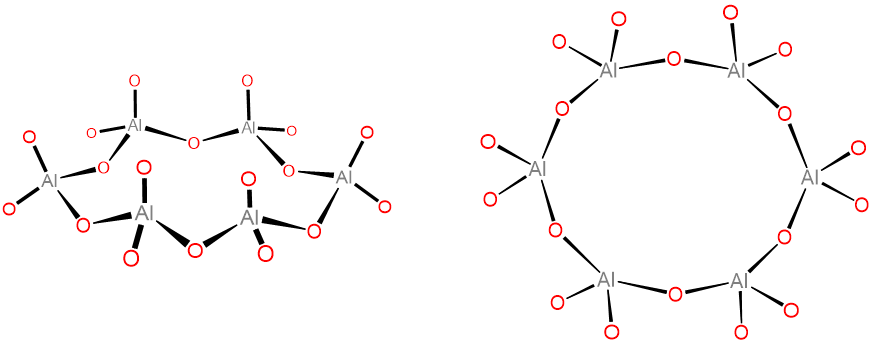
Sin embargo, aunque es posible explicar la química estructural de Al 2 O 3 como involucrando una red iónica, el Al sí forma oxianiones unidos covalentemente al igual que el Boro. Un ejemplo particularmente bien conocido es el anión Al 6 O 18 -, que contiene tetraedros AlO 4 unidos covalentemente en vértice en un anillo Al 6 O 6 como se muestra en el Esquema\(\sf{\PageIndex{I}}\). La sal de calcio de este anión se encuentra en los cementos de aluminato tricálcico, que como su nombre indica se forman mezclando 3 equivalentes de CaO con uno de Al 2 O 3.
Esquema\(\sf{\PageIndex{I}}\). Dos vistas del anión Al 6 O 18 18-.

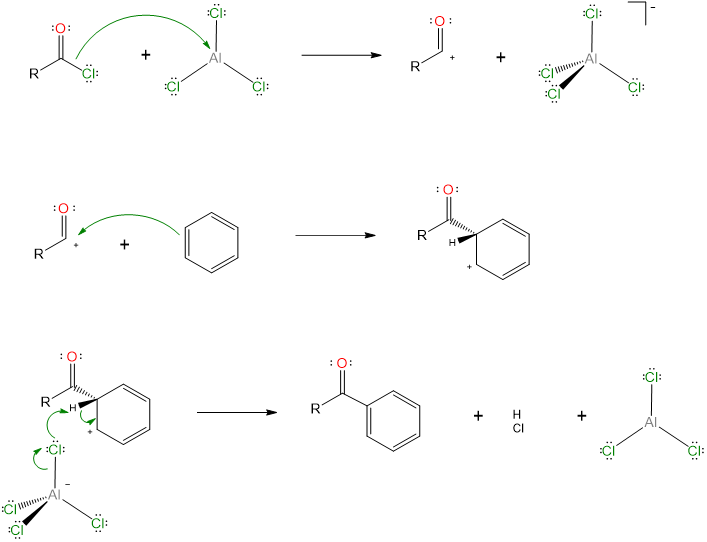
Los trihaluros de aluminio son ácidos de Lewis eficaces. Esta propiedad sirve como base para su uso como catalizador en alquilaciones y acilaciones de Friedel-Crafts. En estas reacciones, el AlCl 3 actúa como una base de Lewis para abstraer un ion cloruro y un haluro de alquilo o acilo, generando un catión a base de carbono que puede agregarse a un anillo aromático en una reacción de sustitución aromática electrófila (Esquema\(\sf{\PageIndex{II}}\)).
Esquema\(\sf{\PageIndex{II}}\). El AlCl 3 actúa como catalizador ácido de Lewis facilitando la acilación de Friedel Crafts.
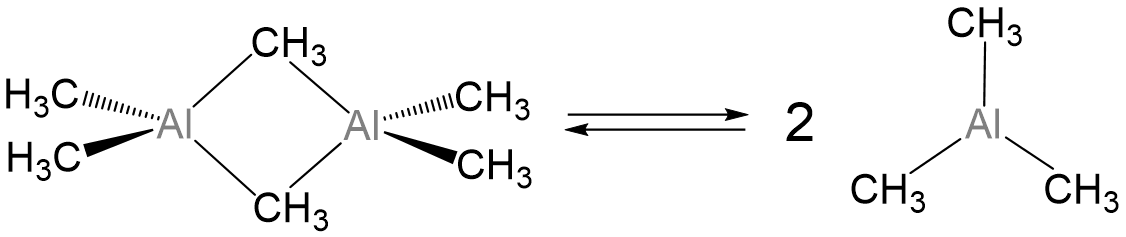
Los compuestos del grupo trialquilo 13 también existen como monómeros y dímeros, aunque la preferencia monómero-dímero se desplaza cada vez más hacia el monómero al pasar de Al a In. En general, las especies gAR 3 e INR 3 existen como monómeros mientras que para Al el monómero y dímero suelen estar en equilibrio (Esquema\(\sf{\PageIndex{II}}\)) para grupos alquilo más pequeños, desplazándose hacia monómero con grupos voluminosos.
Esquema\(\sf{\PageIndex{II}}\). Equilibrio dímero-monómero de trimetil aluminio.
Al igual que con sus análogos de boro, los compuestos de trialquilaluminio y trialquilgalio son ácidos de Lewis efectivos, reaccionando con bases de Lewis en el elemento del grupo 13 para dar especies tetraédricas.
La baja electronegatividad de los metales del grupo 13 también significa que los grupos alquilo de los complejos de trialquilo del grupo 13 son nucleofílicos y básicos. Esta reactividad se emplea en el uso comercial de especies gAR 3 para la deposición química de vapor de GaAs de grado semiconductor a través de la reacción de gAR 3 con Ash 3.
\[\sf{Ga(CH_3)_3~~+~~AsH_3~~\longrightarrow~~GaAS(s)~~+~~3~CH_4} \nonumber \]
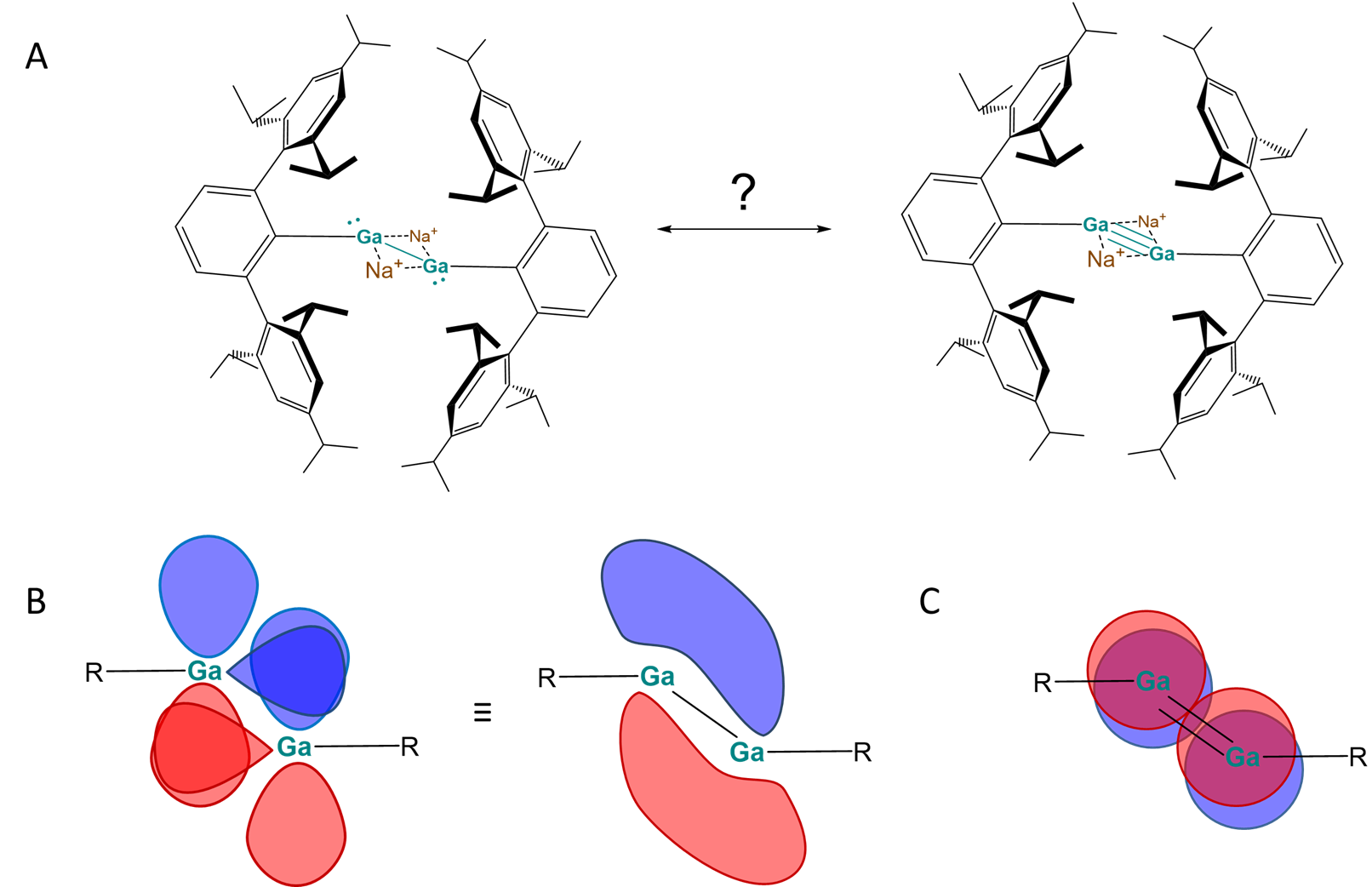
Se pueden preparar compuestos que contienen enlaces simples y múltiples Al-Al y Ga-Ga, aunque los enlaces Al=Al hasta ahora solo se han demostrado en fase gaseosa. 1 En el caso de Ga, se pueden formar múltiples enlaces por reducción de compuestos de tipo RgAX 2 mediante el uso de grupos R extremadamente voluminosos para evitar la dimerización de cualquier especie Ga=Ga o Ga=Ga formada. La naturaleza de las especies de unión múltiple formadas de esta manera han sido objeto de mucha investigación teórica. El informe de 1997 de la síntesis de un gallyne 2, en particular, desencadenó una tormenta de controversia sobre la naturaleza de su vínculo Ga-Ga, lo que dio lugar a afirmaciones contradictorias de que el vínculo debe entenderse como que involucra interacciones de enlaces simples, triples o incluso dobles. Algunas de las opciones se representan en la Figura\(\sf{\PageIndex{3A}}\). Aunque aún no ha surgido un consenso claro, el reciente trabajo experimental y teórico 3 ha señalado que la descripción de la unión implica un\(\sigma\) vínculo, un\(\pi\) vínculo convencional y un enlace deslizado\(\pi\) tipo KlinkHammer, como se muestra en la Figura (\ sf {\ PageIndex {3}}\).
También se sabe que el aluminio y el galio forman cúmulos atómicos. Hay dos tipos:
- Cúmulos de metal desnudo
Los ejemplos incluyen aniones como Tl 7 -, Ga 11 7-, y, Tl 13 11- formados por reacción del metal o haluro metálico con un potente reductor (generalmente un metal alcalino o similar altamente reductor) y “grupos mágicos” que contienen inusualmente especies estables como Al 7 + y Al 13 - formadas por pulverización catódica láser de aluminio (es decir, irradiación de una superficie de Al con un láser y observar qué tipo de racimos se desprenden). Entre estos, el Al 13 - es tan estable que incluso se puede preparar por reducción en fase de solución de AlCl 3 encapsulado en dendrímero por radicales cetilo. El comportamiento químico del anión Al 13 puede racionalizarse pensándolo como análogo a un “haluro”, específicamente del superátomo Al 13. Los superátomos como Al 13 son grupos que poseen niveles de energía bien definidos y orbitales de valencia direccional tal como lo hacen los átomos; en consecuencia, exhiben reactividad atómica al tender a ganar, perder o compartir electrones para llenar una capa de orbitales de baja energía. En el caso del Al 11, su reactividad de imita la de los halógenos y por lo tanto se describe como un superhalógeno.
Ejemplos de estructuras de conglomerados metálicos desnudos se dan en la Figura\(\sf{\PageIndex{4}}\).
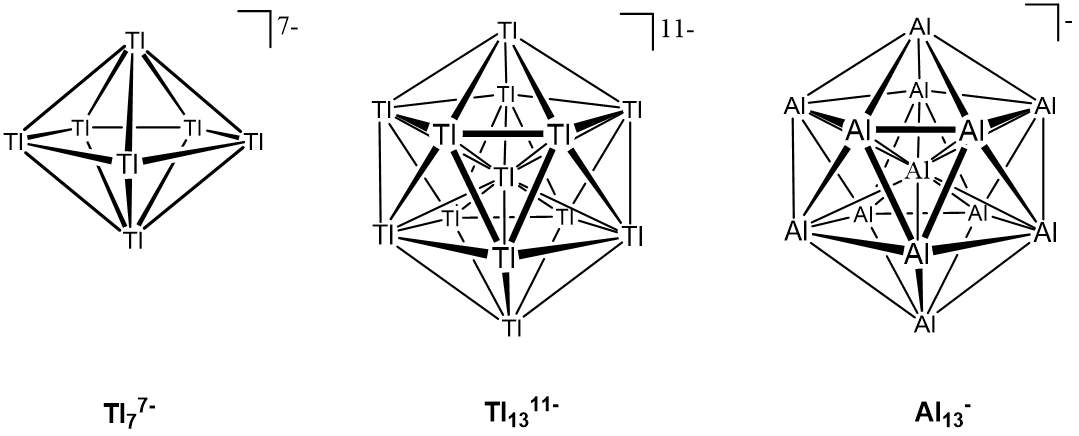
Como puede verse a partir de las estructuras de la Figura\(\sf{\PageIndex{4}}\), estos racimos adoptan formas similares a las de los boranos, aunque como es el caso de Tl 13 11- y Al 13 -a veces uno de los átomos metálicos reside en el interior del racimo. Como cabría esperar, la estabilidad de muchos de estos conglomerados es análoga a la de los boranos al ser explicable en términos de las reglas de Wade, aunque dado que Tl 13 11- y Al 13 - son isoestructurales y ambos estables mientras difieren en sus los recuentos de electrones de valencia por diez electrones es claro que no siempre es así.
La existencia de múltiples recuentos de electrones estables en grupos de superátomos del grupo 13, como Al 13, ha sido explicada por el modelo de estabilidad de conglomerados de jelio, que trata a los grupos como Al 13, como consistentes en un “núcleo iónico” que consiste en los núcleos y sus electrones centrales (Al 3+) 13 rodeados por la “jalea” de los electrones de valencia. En el caso de los clústeres de Al 13, este modelo da conjuntos estables de niveles de energía que permiten configuraciones que contienen los “números mágicos” de 2, 8, 18, 20, 34 o 40 electrones. En este modelo los 40 electrones de valencia en Al 13 - corresponden al último de estos estados estables. Así, Tl 13 11- y Al 13 - representan diferentes regímenes de estabilidad, uno consistente con un cúmulo tipo Wade similar a los boranos explicables en términos de orbitales moleculares formados por combinaciones de orbitales atómicos y el otro explicable en términos de los orbitales dados al tratar Al 13 como un superátomo en el modelo de gellio.
- Cúmulos metaloides
Los conglomerados metaloides consisten en una pequeña partícula de metal rodeada de ligandos. Algunos de estos grupos de Al y Ga incluso contienen más de 69 átomos. Los ejemplos incluyen grupos de fórmula [Al 69 {N (SiMe 3) 2} 18] 3 - y [Al 77 N (SiMe 3) 2} 20] 2 -. La estructura de un ejemplo relativamente pequeño se da en la Figura\(\sf{\PageIndex{5}}\).

Aunque los metales del grupo 13 tienen tendencias variables a formar enlaces covalentes, tienden a actuar químicamente como metales.
Algunas características representativas de estos elementos ilustrativos de su química se resumen en la Tabla\(\sf{\PageIndex{1}}\).
Mesa\(\sf{\PageIndex{1}}\). Propiedades ilustrativas del grupo 13 metales. 9,10
| Grupo 13 Metal | Fuente Natural |
Óxidos (el producto principal de la reacción del elemento con O 2 se da en negrita) |
Haluros mononucleares estables ilustrativos | Comportamiento redox en solución ácida |
| Aluminio, Al |
Aluminosilicatos como
|
Al 2 O 3 | AlX 3 (X = F, Cl, Br, I) | 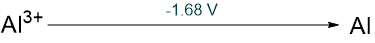 |
| Galio, Ga |
Como impurezas en minerales de Aluminio y Fe/Zn
Pequeñas cantidades en Galita, CuGas 2 |
Ga 2 O 3 Ga 2 O |
GaF 3 covalente de red Dimérico Ga 2 X 6 (X = Cl, Br, I) Ga I Ga III 2 Cl 7 Ga I Ga III X 4 (X = Cl, Br, I) |
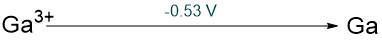 |
| Indio |
Como impurezas en minerales de Zn y Cu/Fe
|
En 2 O 3 |
INx 3 (X = F, Cl, Br, I) En I 3 (En III Cl 6) (X = Cl, Br) En I En III X 4 (X = Br, I) INx (X = Cl, Br, I) |
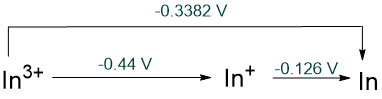 |
| Talio, Tl |
Como impurezas en minerales ricos en sulfuro
pequeñas cantidades en minerales como TLCu 7 Se 4, TLPBAs 5 S 9, otros |
Tl 2 O 3 Tl 2 O |
TLF 3 TLx (X = F, Cl, Br, I) triyoduro de talio (I), Tl I (I 3) |
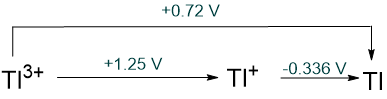 |
Como se desprende de los datos de la Tabla\(\sf{\PageIndex{1}}\), al bajar el grupo 13 de Al a Tl
- La ocurrencia geológica de los elementos en minerales de óxido (Al, Ga) se vuelve cada vez más reemplazada por una preferencia por la ocurrencia en sulfuro y selenuros (Ga, In, Tl). Esto es consistente con el aumento de la suavidad al bajar el grupo 13.
- Existe una preferencia creciente por el estado de oxidación +1. Esto se puede ver desde
- los potenciales estándar para la reducción de M 3+ y M + al metal. Estos muestran una disminución en la estabilidad del ion +3 al descender del grupo. En el caso de Tl, Tl 3+ (aq) es incluso menos estable que Tl + (aq).
- un incremento en la prevalencia del estado de oxidación +1 en los haluros monoméricos. Los monohaluros de aluminio, AlX, son altamente inestables; el bromuro y cloruro de Ga I estabilizables (pero quizás no monoméricos); los haluros In I estables solo para los halógenos menos oxidantes Cl, Br e I; y para el talio, TlF 3 es el único haluro estable de Tl 3+.
Esta creciente preferencia por un estado de oxidación dos inferior a la valencia máxima no se restringe al grupo 13 elementos. Es una característica común de la química de elementos post transición que estos elementos puedan actuar como si sus electrones de valencia n s 2 fueran inertes, por lo que esta tendencia ha sido referida de manera algo engañosa como el efecto de par inerte.
Post-transición exhiben el efecto de par inerte, en el que actúan como si sus electrones de valencia n s 2 no contribuyeran a la unión.
Los metales y metaloides del bloque p comúnmente poseen dos estados de oxidación estables, uno correspondiente a la pérdida de todos sus electrones de valencia n s y n p y uno a la pérdida de dos electrones menos. Esto es evidente a partir de los conocidos iones y estados de oxidación observados para los metales y metaloides del grupo 13, 14 y 15 mostrados en el Esquema\(\sf{\PageIndex{III}}\).
Esquema\(\sf{\PageIndex{III}}\). Estados comunes de oxidación de metales y metaloides de los grupos 13, 14 y 14.
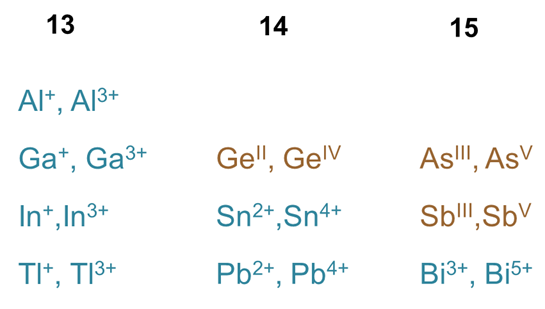
Además, existe una creciente preferencia por el estado de oxidación inferior al bajar un grupo del cuento periódico de manera que
- El estado de oxidación más alto (n+) se favorece para los elementos más ligeros de manera que el orden de preferencia es
Al 3 + > Ga 3 + > En 3+ > Tl 3 +
- El estado de oxidación inferior (n - 2) + se ve favorecido para los elementos más pesados
Al + < Ga + < En + < Tl +
Es por ello que los óxidos y cloruro de Al más estables son Al 2 O 3 y AlCl 3 mientras que los óxidos más estables y Cl de Tl son Tl 2 O y TLCl.
La explicación clásica de la existencia de este comportamiento es postular que los electrones de valencia n s 2 de los elementos más pesados son químicamente inertes, es decir, un par inter. Por esta razón, la observación de que muchos elementos posteriores a la transición tienen estados de oxidación n+ y (n-2) + estables y que existe una preferencia creciente por el estado de oxidación inferior al bajar un grupo se ha denominado el efecto de par inerte.
El efecto de par inerte se debe a la disminución de las energías de enlace en un grupo.
Sin embargo, el término efecto de par inerte es un nombre inapropiado. Hay dos razones para ello
- Los electrones ns no se vuelven significativamente más inertes (a.k.a. menor en energía) a medida que se descienden los grupos de la tabla periódica. Una mirada superficial a las energías orbitales de valencia s y p de los elementos del grupo principal revela que no es simplemente el caso de que los orbitales n s se vuelven más bajos en energía al bajar un grupo de la tabla periódica. Como puede verse a partir de las energías dadas en la Figura\(\sf{\PageIndex{6}}\), la energía de los n s orbitales es generalmente más baja para los elementos del periodo 1 y 2 después de lo cual la única tendencia general que se puede notar es que las energías orbitales n s de las filas 3-6 elementos generalmente no difieren en más de 20% en toda la gama.

2. El efecto de par inerte se debe a la disminución de las energías de enlace a medida que las longitudes de enlace aumentan en un grupo de la tabla periódica. Para ver cómo esto lleva a la aparición de la inercia electrónica de n s a medida que se desciende la tabla periódica considera que el proceso de formación de un enlace E-X implica generalmente
- oxidación endergónica del metal
- Formación exergónica de un enlace M-X
Considerar la interacción entre estas dos energías en el caso de formar los monohlaidos y trihaluros del grupo 13 elementos. El costo de oxidación del metal refleja un equilibrio entre las energías de ionización dadas en la Tabla\(\sf{\PageIndex{2}}\) y las energías de enlace dadas en la Tabla\(\sf{\PageIndex{3}}\). 15
Mesa\(\sf{\PageIndex{2}}\). Costos de energía de ionización para la formación de M + y M 3+. Recalculado de la tabla similar de energías de ionización en es.wikipedia.org/wiki/Inert_Pair_Effect
| Proceso | B | Al | Ga | En | Tl |
|
M/(/derecha/) M + IE 1 (kJ/mol) |
800 | 577 | 578 | 558 | 589 |
|
M/(/derecha/) M 3+ IE 1 + IE 2 + IE 3 (kJ/mol) |
6886 | 5137 | 5520 | 5082 | 5438 |
|
Oxidación de par inerte: M +/(/derecha/) M 3+ IE 2 + IE 3 (kJ/mol) |
6,086 | 4,560 | 4,942 | 4,524 | 4,849 |
Mesa\(\sf{\PageIndex{3}}\). Energías de enlace homolítico M-Cl en kJ/mol. 15
| Bond | B-Cl | Al-Cl | Ga-Cl | In-Cl | Tl-Cl |
| Energía típica de disociación del enlace E-Cl (kJ/mol) | 536 | 494 | 481 | 439 | 372.8 |
Como puede verse en la Tabla\(\sf{\PageIndex{3}}\), el costo de energía para la ionización del “par inerte” es mayor para el boro, disminuye en ~ 25% al ir a Al, y luego permanece aproximadamente constante para los miembros restantes del grupo. En contraste, las energías compensadoras de disociación del enlace caen más lentamente al pasar de B a Tl, con sucesivas disminuciones de ~ 10% y ~ 20% al pasar de Ga a In e In a Tl. Debido a que las energías de enlace caen al pasar de Al a Tl mientras que las energías de ionización no lo hacen, se piensa que el efecto de par inerte no se debe a la inercia de los electrones n s sino al debilitamiento de las energías de enlace. Cuando la energía de estabilización debida a la formación de enlaces M-E ya no es suficiente para pagar el costo necesario para oxidar los electrones n s, el estado de oxidación inferior será más estable que el superior, tal como lo haría si los electrones n s realmente fueran inertes.
El par inerte de electrones ejerce efectos estructurales.
Independientemente del origen del efecto de par inerte, el par inerte de electrones influye en la estructura de los compuestos en el estado de oxidación (n-2) +. Se dice que los pares de electrones que hacen esto alterando la geometría observada de los compuestos son pares inertes estereoquímicamente activos. Los pares solitarios de Sn II Cl 2 son el ejemplo clásico. Como se muestra en la Figura\(\sf{\PageIndex{7A}}\), la fase gaseosa Sn II Cl 2 exhibe una geometría AX 2 E VSEPR mientras que su en estado sólido, hidratos y sales presentan geometrías AX 3 E, consistentes con la influencia de un par solitario de electrones.
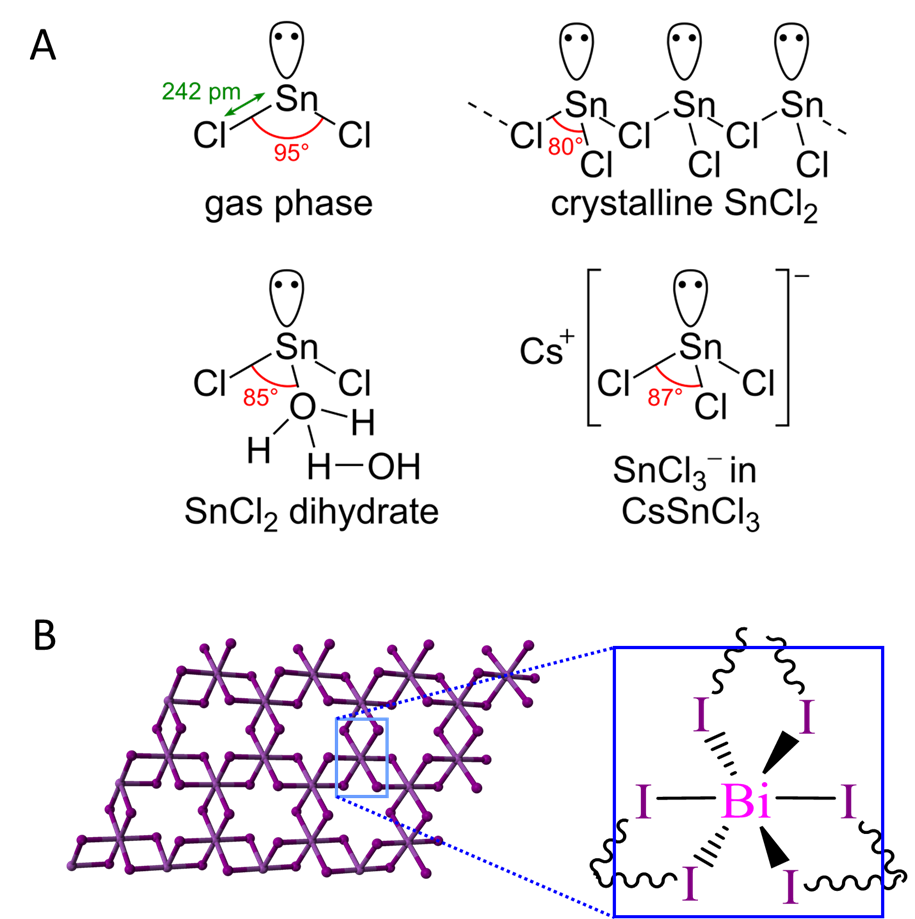
En ocasiones la geometría de coordinación de un elemento es exactamente la que se esperaría si el par inerte no estuviera presente. En tales casos se dice que el par inerte es estereoquímicamente inerte. En general, cuando el número de coordinación del elemento es menor de seis, los pares inertes serán estereoquímicamente activos mientras que para números de coordinación de seis o más el par puede ser estereoquímicamente activo o estereoquímicamente inerte.
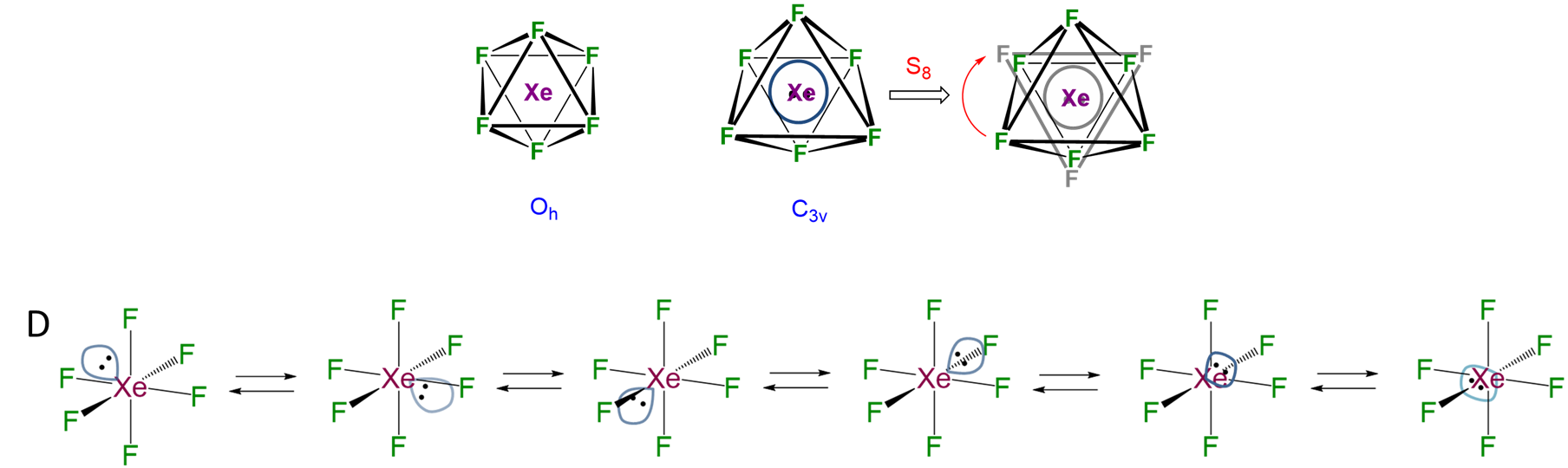
Incluso cuando un par inerte parece esteroecemcialmente inerte no significa que no ejerza ningún efecto sobre la estructura del compuesto. Puede ser que el par sea simplemente fluxional y solo parezca inerte porque está ajustando rápidamente su posición entre posibles localizaciones. Por ejemplo, en la estructura de BiI 3 mostrada en la Figura\(\sf{\PageIndex{7B}}\), es probable que el par solitario esté intercambiando entre las seis caras del octaedro definiendo la esfera de coordinación, como es el caso de xEF 6 (Figura\(\sf{\PageIndex{8}}\)).
Notas y Referencias
1. Zhang, X.; Popov, I. A.; Lundell, K. A.; Wang, H.; Mu, C.; Wang, W.; Schnöckel, H.; Boldyrev, A. I.; Bowen, K. H., Realización de un Triple Enlace Alº Al en el Cluster Na3Al2− en Fase Gasa vía Doble Transmutación Electrónica. Angewandte Chemie Edición Internacional 2018, 57 (43), 14060-14064.
2. Su, J.; Li, X.-W.; Crittendon, R. C.; Robinson, G. H., ¿Qué tan corto es un triple vínculo -Gaga-? Síntesis y Estructura Molecular de Na2 [Mes*2C6H3-GaGa-C6H3Mes*2] (Mes* = 2,4,6-i-Pr3C6H2): La Primera Gallyne. Revista de la American Chemical Society 1997, 119 (23), 5471-5472.
3. Kobera, L.; Southern, S. A.; Rao, G. K.; Richeson, D. S.; Bryce, D. L., New Experimental Insight into the Nature of Metal−Metal Bonds in Digallium Composites: J Acoplamiento entre núcleos cuadrupolares. Química — Una revista europea 2016, 22 (28), 9565-9573.
4. Klinkhammer, K. W., ¿Cómo se puede reconocer un triple vínculo entre los elementos del grupo principal? Angewandte Chemie Edición Internacional en inglés 1997, 36 (21), 2320-2322.
5. Kambe, T.; Haruta, N.; Imaoka, T.; Yamamoto, K., síntesis en fase de solución de Al13− usando un molde dendrímero. Nature Comunicaciones 2017, 8 (1), 2046.
6. Schnepf A. (2016) Cúmulos Metaloides. En: Dehnen S. (eds) Clusters — Contemporary Insight in Structure and Bonding. Estructura y Adhesión, vol. 174. Springer, 135-200.
7. Schnöckel, H., Las estructuras y propiedades de los clústeres metaloides de Al y Ga nos abren los ojos a la diversidad y complejidad de los procesos químicos y físicos fundamentales durante la formación y disolución de metales. Reseñas Químicas 2010, 110 (7), 4125-4163.
8. Köhnlein, H.; Purath, A.; Klemp, C.; Baum, E.; Krossing, I.; Stösser, G.; Schnöckel, H., Síntesis y caracterización de un grupo Al 69 3- con 51 átomos de Al desnudos: analogías y diferencias con el grupo Al 77 2- previamente caracterizado. Química Inorgánica 2001, 40 (19), 4830-4838.
9. La lista de haluros se selecciona de los enumerados en las referencias 4-6 y páginas de Wikipedia de haluro de elementos, contrastadas con la literatura original. Las páginas específicas utilizadas incluyen en.wikipedia.org/wiki/Aluminium_Halides, en.wikipedia.org/wiki/Gallium_Halides, en.wikipedia.org/wiki/Indium_Halides y en.wikipedia.org/wiki/Thallium_Halides.
10. Todos los potenciales son tomados de Bard, A. J.; Parsons, R.; Jordan, J. Potenciales estándar en solución acuosa. M. Dekker: Nueva York, 1985. Tenga en cuenta que esta referencia reporta un potencial Ga 2+/0 además del potencial Ga 3+/0 dado. Esta pareja no se incluyó ya que la naturaleza de las especies de Ga 2+ referenciadas (GaCl 2 producida al reaccionar Ga y GaCl 3) no estaba clara (es decir, puede ser una especie Ga I Ga III o poseer un enlace Ga-Ga).
11. Greenwood, N. N.; Earnshaw, A., Química de los elementos. 2a ed.; Butterworth-Heinemann: Oxford; Boston, 1997.
12. Cotton, F. A.; Cotton, F. A., Química inorgánica avanzada. 6a ed.; Wiley: Nueva York, 1999; p xv, 1355 p.
13. Pardoe, J.; Downs, A., Desarrollo de la Química del Indio en Estados de Oxidación Formal Inferior a +3 †. Revisiones químicas 2007, 107, 2-45.
14. Aldridge, S.; Downs, A. J. El Grupo 13 Metales Aluminio, Galio, Indio y Talio: Patrones Químicos y Peculiaridades, Wiley, 2011.
15. Las energías de enlace se toman de la Tabla 4.11 de Dean, J. A.; Lange, N. A., Lange's manual of chemistry, 14a ed. McGraw-Hill: Nueva York, 1992.
Colaboradores y Atribuciones
Stephen Conakes, Westmont College

