8.13.2.4: Más reacciones de halógenos
- Page ID
- 81381
Esta página describe las reacciones de los halógenos que no entran dentro de las otras categorías en otras páginas de esta sección. Todas las reacciones aquí descritas son reacciones redox.
Reacciones con hidrógeno
Los siguientes ejemplos ilustran la disminución de la reactividad de los halógenos del Grupo 7.
El flúor se combina explosivamente con hidrógeno incluso en condiciones frías y oscuras, produciendo gas fluoruro de hidrógeno.
Una mezcla de cloro e hidrógeno explota si se expone a la luz solar o a una llama, produciendo gas cloruro de hidrógeno. Esta reacción se puede controlar encendiendo un chorro de hidrógeno y luego bajándolo a un frasco de gas de cloro. El hidrógeno se quema a una velocidad más lenta y constante y se forma cloruro de hidrógeno gaseoso como antes.
El vapor de bromo y el hidrógeno se combinan con una leve explosión cuando se encienden. Se forma gas bromuro de hidrógeno.
El yodo y el hidrógeno se combinan solo parcialmente incluso con calentamiento constante. Existe un equilibrio entre el hidrógeno y el yodo y el yoduro de hidrógeno gaseoso.
Cada una de estas reacciones tiene una ecuación de la forma:
\[ H_2 + X_2 \rightarrow 2HX\]
Se hace una excepción menor para el yodo: la flecha única se reemplaza por un signo reversible.
Reacciones con fósforo
Se debe tener cuidado al analizar las tasas de estas reacciones; se deben comparar reacciones análogas. Por ejemplo, no tiene sentido comparar la velocidad a la que el fósforo reacciona con el cloro gaseoso con la velocidad a la que reacciona con el bromo líquido. Hay más contacto entre fósforo y bromo líquido que entre fósforo y cloro gaseoso.
La formación de trihaluros, PX 3
Todos los halógenos reaccionan con el fósforo para formar, en primera instancia, haluros de fósforo (III) de la forma PX 3.
Hay dos formas comunes de fósforo: el fósforo blanco (a veces llamado fósforo amarillo) y el fósforo rojo. El fósforo blanco es más reactivo que el fósforo rojo. Este video en YouTube muestra la reacción entre el fósforo rojo y el bromo. Se trata de una reacción violenta en condiciones de frío, y el fósforo blanco se comporta aún más dramáticamente.
Al escribir las ecuaciones para estas reacciones, es importante recordar que el fósforo blanco es molecular, consistente en moléculas P 4, mientras que el fósforo rojo es polimérico, indicado por el símbolo P. La reacción para fósforo blanco y bromo es la siguiente:
\[ P_4 + 6Br_2 \rightarrow 4PBr_3\]
La ecuación de fósforo rojo se muestra a continuación:
\[ 2P + 3Br_2 \rightarrow 2PBr_3\]
La formación de pentahalidas, PX 5
En exceso de cloro o bromo, el fósforo reacciona para formar cloruro o bromuro de fósforo (V). Más simple, usando fósforo blanco:
\[ P_4 + 10Cl_2 \rightarrow 4PCl_5\]
La reacción entre el cloruro de fósforo (III) y el cloruro de fósforo (V) es reversible:
\[ PCl_3 + Cl_2 \rightleftharpoons PCl_5\]
Un exceso de cloro empuja este equilibrio hacia la derecha. Por el contrario, el fósforo no forma un pentaiodido; esto probablemente se deba a que cinco grandes átomos de yodo no pueden caber físicamente alrededor del átomo central de fósforo.
Reacciones con sodio
Todos los halógenos reaccionan con el sodio para producir haluros de sodio. Una reacción común entre el sodio caliente y el gas cloro produce una llama naranja brillante y cloruro de sodio blanco.
\[ 2Na + Cl_2 \rightarrow 2NaCl\]
El sodio caliente también se quemará en bromo o vapor de yodo para producir bromuro de sodio o yoduro de sodio. Cada una de estas reacciones produce una llama naranja y un sólido blanco.
Reacciones con hierro
A excepción del yodo, el hierro se quema en vapor halógeno, formando haluros de hierro (III). El yodo es menos reactivo y produce yoduro de hierro (II).
Flúor
La lana de hierro fría se quema en flúor frío para dar fluoruro de hierro (III). El fluoruro de hierro anhidro (III) se describe como blanco o verde pálido. Un libro de texto estándar de química inorgánica de Cotton y Wilkinson lo describe como blanco. La reacción se da a continuación:
\[ 2Fe + 3F_2 \rightarrow 2FeF_3\]
Se trata de una reacción rápida, en la que el hierro se quema y se oxida a un compuesto de hierro (III), es decir, de un estado de oxidación de cero en el metal elemental a un estado de oxidación de +3 en el compuesto de hierro (III).
Cloro
El gas cloro en contacto con hierro caliente forma cloruro de hierro (III). El cloruro de hierro anhidro (III) forma cristales negros; cualquier rastro de agua presente en el aparato o en el cloro reacciona con los cristales, volviéndolos de color marrón rojizo. La ecuación para esta reacción se da a continuación:
\[ 2Fe + 3Cl_2 \rightarrow 2FeCl_3\]
El hierro se oxida nuevamente de un estado de cero a +3.
Bromo
El vapor de bromo que pasa sobre hierro caliente desencadena una reacción similar, ligeramente menos vigorosa, que se muestra a continuación; se produce bromuro de hierro (III). El bromuro de hierro anhidro (III) suele aparecer como un sólido de color marrón rojizo.
\[2Fe + 3Br_2 \rightarrow 2FeBr_3\]
En esta reacción el hierro se oxida nuevamente a un estado +3.
Yodo
La reacción entre hierro caliente y vapor de yodo produce yoduro de hierro gris (II), y es mucho menos vigorosa. Esta reacción, cuya ecuación se da a continuación, es difícil de llevar a cabo porque el producto siempre está contaminado con yodo.
\[ Fe + 2I_2 \rightarrow FeI_2\]
El yodo solo es capaz de oxidar el hierro al estado de oxidación +2.
Reacciones con soluciones que contienen iones hierro (II)
Solo se pueden considerar las reacciones del cloro, bromo y yodo. El flúor acuoso es muy reactivo con el agua. El cloro y el bromo son agentes oxidantes lo suficientemente fuertes como para oxidar los iones de hierro (II) a iones de hierro (III). En el proceso, el cloro se reduce a iones cloruro, bromo a iones bromuro.
Este proceso es más fácil de visualizar con ecuaciones iónicas:
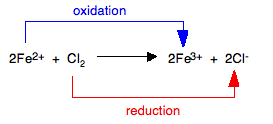
Para la ecuación de bromo, Br se sustituye por Cl.
La solución verde pálido que contiene los iones hierro (II) se convierte en una solución amarilla o naranja que contiene iones de hierro (III). El yodo no es un agente oxidante lo suficientemente fuerte como para oxidar los iones hierro (II), por lo que no hay reacción. De hecho, procede la reacción inversa. Los iones hierro (III) son agentes oxidantes suficientemente fuertes como para oxidar los iones yoduro a yodo como se muestra:
\[ 2Fe_3+ + 2I^- \rightarrow 2Fe^{2+} + I_2\]
Reacciones con solución de hidróxido de sodio
Una vez más, solo se consideran cloro, bromo y yodo.
La reacción de cloro con solución fría de hidróxido de sodio
El cloro y el hidróxido de sodio diluido frío reaccionan de la siguiente manera:
\[ 2NaOH + Cl_2 \rightarrow NaCl + NaClO + H_2O\]
NaClO (a veces escrito como NaOCl) simboliza el clorato de sodio (I). El nombre tradicional de este compuesto es hipoclorito de sodio; la solución en el lado del producto de la ecuación se vende comúnmente como lejía.
Considera esta reacción en términos de estados de oxidación. El cloro muestra un cambio de estado obvio de su forma elemental a compuestos iónicos. Los números de oxidación para cada elemento se muestran a continuación:

El cloro es el único elemento que cambia el estado de oxidación, tanto oxidado como reducido. Un átomo se reduce porque su estado de oxidación ha disminuido; el otro está oxidado. Este es un buen ejemplo de una reacción de desproporción, una reacción en la que una sola sustancia se oxida y se reduce a la vez.
La reacción del cloro con solución caliente de hidróxido de sodio
El cloro reacciona con hidróxido de sodio concentrado caliente de la siguiente manera:
\[ 6NaOH + 3Cl_2 \rightarrow 5NaCl + NaClO_3 + 3H_2O\]
El producto formado es clorato de sodio (V) - NaClO 3. Como antes, se calculan los estados de oxidación de cada elemento. Una vez más, el único cambio es en el cloro, de 0 en las moléculas de cloro en el lado reactivo a -1 (en el NaCl) y +5 (en el NaClO 3). Este es otro ejemplo de una reacción de desproporción.
Ecuaciones de equilibrio para estas reacciones
La primera ecuación es sencilla de equilibrar. El segundo es más difícil; se utilizan estados de oxidación para derivarlo.
Los dos productos principales de la reacción son NaCl y NaCl3, por lo que la reacción puede escribirse tentativamente de la siguiente manera:
\[ NaOH + Cl_2 \rightarrow NaCl + NaClO_3 + ? \]
En su conversión a NaCl, el estado de oxidación del cloro disminuye de 0 a -1. Cuando se convierte a NaClO 3, aumenta de 0 a +5. Los cambios de estado de oxidación positivos y negativos deben cancelarse, por lo que por cada NaClO 3 formado, debe haber 5 NaCl:
\[ NaOH + Cl_2 \rightarrow 5NaCl + NaClO_3 + ? \]
Ahora es una tarea sencilla equilibrar los átomos de sodio y cloro, después de lo cual hay suficientes átomos de hidrógeno y oxígeno para hacer 3H 2 O.
Las reacciones que involucran bromo y yodo
Estos son esencialmente similares a los del cloro; la diferencia radica en las temperaturas de reacción. La tendencia a formar el ion con el halógeno en el estado de oxidación +5 aumenta rápidamente en el grupo.
Solución de bromo e hidróxido de sodio
Para el bromo, la formación del bromato de sodio (V) ocurre alrededor de la temperatura ambiente. El bromato de sodio (I) debe formarse a aproximadamente 0°C.
Solución de yodo e hidróxido de sodio
En este caso, se forma yodato de sodio (V) a cualquier temperatura. Cotton y Wilkinson (Advanced Inorganic Chemistry 3a edición página 477) dicen que el ion yodato (I) es desconocido en solución.
Colaboradores y Atribuciones
Jim Clark (Chemguide.co.uk)


