8.14.4: Reacciones de Gases Nobel
- Page ID
- 81530
Los gases nobles (Grupo 18) se encuentran en el extremo derecho de la tabla periódica y anteriormente se los denominaban “gases inertes” debido a que sus conchas de valencia llenas (octetos) los hacen extremadamente no reactivos.
Las propiedades químicas
Los gases nobles son gases inodoros, incoloros, no inflamables y monótonos que tienen baja reactividad química.
| Número atómico | Element | Número de Electrones/Shell |
|---|---|---|
| 2 | Helio | 2 |
| 10 | Neón | 2,8 |
| 18 | Argón | 2,8,8 |
| 36 | Criptón | 2,8,18,8 |
| 54 | Xenon | 2,8,18,18,8 |
| 86 | Radón | 2,8,18,32,18,8 |
Las capas de electrones de valencia completa de estos átomos hacen que los gases nobles sean extremadamente estables y poco probable que formen enlaces químicos porque tienen poca tendencia a ganar o perder electrones. Aunque los gases nobles normalmente no reaccionan con otros elementos para formar compuestos, hay algunas excepciones. Xe puede formar compuestos con fluoruro y óxido.
Ejemplo 1: Fluoruros de xenón
Difluoruro de xenón (\(XeF_2\))
- Sólido cristalizado blanco denso
- Potente agente de fluoración
- Fluoruros inorgánicos covalentes
- Compuesto de xenón estable
- Se descompone al entrar en contacto con luz o vapor de agua
- Geometría lineal
- Sensible a la humedad
- Baja presión de vapor
Tetrafluoruro de xenón (\(XeF_4\))


- Cristales incoloros
- Geometría plana cuadrada
- Descubierto en 1963
Hexafluoruro de Xenón (\(XeF_6\))

- Agente de fluoración más fuerte
- Sólido incoloro
- Mayor coordinación de los tres fluoruros binarios de xenón (\(XeF_2\)y\(XeF_4\))
- La formación es exergónica y el compuesto es estable a temperaturas normales
- Se sublima fácilmente en vapores de color amarillo intenso
- La estructura carece de simetría octaédrica perfecta
Ejemplo 2: Óxido de xenón
Tetróxido de xenón (Xeo 4)
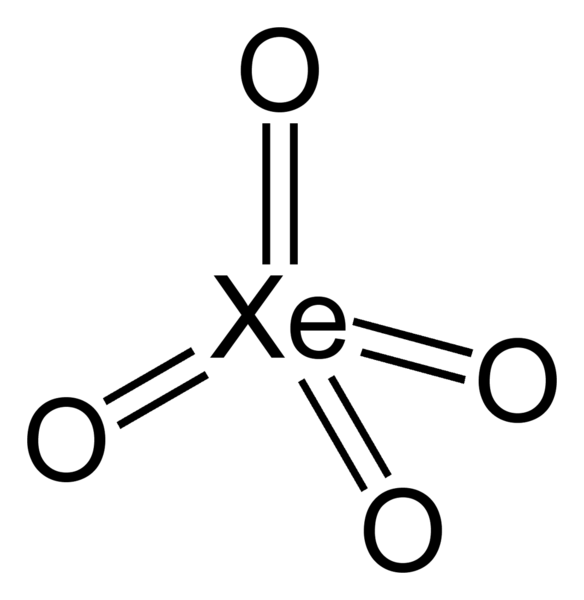
- Sólido cristalino amarillo
- Relativamente estable
- El oxígeno es el único elemento que puede llevar el xenón a su estado de oxidación más alto de +8
Otros dos compuestos de xenón de corta duración con un estado de oxidación de +8, XEo 3 F 2 y XEo 2 F 4, se producen en la reacción del tetroóxido de xenón con hexafluoruro de xenón.
Ejemplo 3: Compuestos de radón
El difluoruro de radón (RnF 2) es uno de los pocos compuestos reportados de radón. El radón reacciona fácilmente con el flúor para formar un compuesto sólido, pero este se descompone al intentar vaporización y su composición exacta es incierta. La utilidad de los compuestos de radón es limitada debido a la radiactividad del gas noble. El isótopo de mayor vida, 222 Ra, tiene una vida media de solo 3.82 días.

