14.1.2: Adición Oxidativa
- Page ID
- 81640
Una adición oxidativa es una reacción en la que tanto el número de coordinación como el estado de oxidación del ión metálico aumentan en 2. En otras palabras, el metal se oxida por dos electrones a medida que el número de coordinación aumenta en 2 ligandos. El reverso microscópico de la adición oxidativa es la eliminación reductora (discutida en la siguiente sección).
La adición oxidativa puede ocurrir en forma cis o trans. Una adición cis significa que se agregan dos ligandos para que tengan orientación cis entre sí después de que se complete la reacción. Una trans-adición implica que dos nuevos ligandos están en posición opuesta, transposición después de haber sido agregados. Podemos distinguir además entre adiciones mononucleares y dinucleares. La adición mononuclear implica un complejo con un solo metal. Las adiciones dinucleares son adiciones a un enlace metal-metal. La adición escinde el enlace metal-metal y agrega un ligando a cada fragmento.
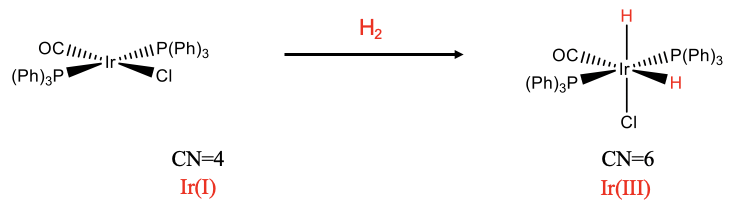
Exploremos algunos ejemplos. El primer ejemplo es una adición cis mononuclear (Fig. \(\PageIndex{1}\)). En la reacción agregamos dihidrógeno a un complejo de iridio plano cuadrado. Después de la reacción hay dos ligandos hidruros adicionales, y el número de coordinación ha aumentado de 4 a 6. Podemos ver que los dos ligandos de hidrido están orientados en forma cis uno respecto al otro. Podemos verificar que la adición de los ligandos hidrido oxidó el metal determinando el número de oxidación del metal antes y después de la reacción. Hay tres ligandos neutros y un ligando de cloro cargado negativamente. No hay ningún cargo general en el complejo. Esto significa que el número de oxidación de Ir es +1. Después de la reacción, están los dos ligandos de hidrido que tienen ambos una carga -1. Recuerde, obtenemos la carga en un ligando escindiendo el enlace metal-ligando para que todos los electrones en el enlace se asignen al ligando. Esto significa que el número de oxidación debe aumentarse en +2, y es +3 después de la reacción.
Podemos racionalizar por qué la adición ocurre en la moda cis y no en la trans-moda. Los dos ligandos hidrido son los ligandos más pequeños, por lo tanto, la repulsión estérica se minimiza en el complejo se minimiza cuando los dos ligandos hidrido están en posición cis.
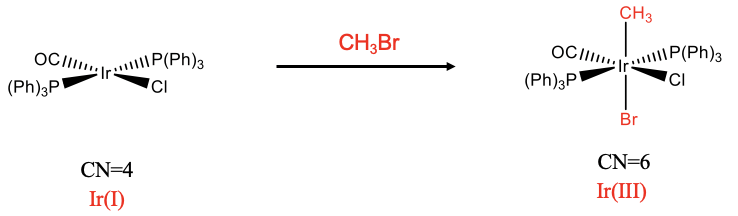
El segundo ejemplo es una trans-adición mononuclear (Fig. \(\PageIndex{2}\)). En esta reacción se agrega CH 3 Br al complejo de iridio. En este caso los dos nuevos ligandos, un CH 3 y el grupo Br están en posición opuesta. Nuevamente, el número de coordinación aumenta de cuatro a seis. Podemos verificar nuevamente que se ha producido una oxidación analizando el número de oxidación de Ir. Como se determinó previamente, el número de oxidación del iridio en el complejo reactivo es +1. Analicemos el complejo del producto. El ligando cloro y el ligando bromo tienen una carga 1-. Además de eso también el ligando CH 3 tiene una carga 1- asumiendo que tratamos el enlace Ir-C como un enlace dativo. Así, el número de oxidación de Ir debe ser +3 para dar un complejo neutro.
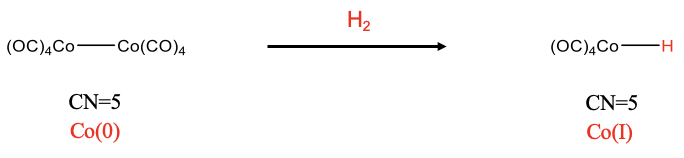
El tercer ejemplo es una adición dinuclear (Fig. \(\PageIndex{3}\)). Esta adición no es ni cis ni trans porque escinde un enlace metal-metal, y el nuevo ligando se agrega a cada fragmento. En el ejemplo, el enlace Co-Co del octacarbonilo dicobalto se escinde tras la reacción con dihidrógeno, y se forman dos complejos de HCO (CO) 4 con enlaces Co-H. En este caso el número de coordinación no aumenta. Tanto el reactivo como los productos tienen el número de coordinación 5. Podemos ver que se ha producido una oxidación de Co comparando los números de oxidación. En el reactivo el número de oxidación de Co es cero porque todos los ligandos de CO son neutros y el complejo es neutro en general. En el producto de hidruro de carbonilo, el Co tiene el número de oxidación +1, debido a que el ligando hidrido tiene una carga 1-.
Adiciones oxidativas con ligandos intactos
En los ejemplos anteriores, los ligandos que reaccionaron con los complejos perdieron su integridad. El enlace H-H en la molécula H 2 se escindió para formar los ligandos hidrido, y el enlace C-Br en CH 3 Br se escindió para formar ligandos Br y metilo separados. No todos los ligandos pierden su integridad tras su adición, en particular cuando contienen múltiples enlaces. Estos ligandos se denominan ligandos intactos. En estos casos se disminuye el orden de enlace entre dos átomos en el ligando, pero el orden de enlace sigue siendo al menos 1. Por ejemplo, el ligando alquino mostrado belo disminuye de un orden de enlace carbono-carbono de tres a un orden de enlace de dos después de que se une a Pt.
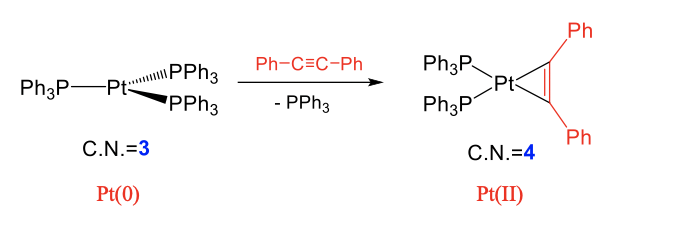
Ejemplos de ligandos intactos son alquenos, alquinos, O 2, etc. En una adición oxidativa con un alquino por ejemplo, el alquino se une de lado al metal de transición bajo la formación de dos enlaces simples metal-C, y la reducción del orden de enlace dentro del alquino de 3 a 2 (Fig. \(\PageIndex{4}\)). En la reacción mostrada, una molécula de difenil etina se suma a tris (trifenil fosfina) platino bajo la formación de dos enlaces simples Pt-C. El triple enlace C-C en el ligando se convierte en un doble enlace. Esta reacción se produce bajo la pérdida de uno de los tres ligandos de trifenilfosfina. El número de coordinación en el metal aumenta de 3 a 4. Podemos demostrar nuevamente que la reacción es oxidativa comparando los números de oxidación del metal. En el reactivo, Pt tiene el número de oxidación 0 debido a que los tres ligandos de trifenilfosfina no tienen carga y el complejo no tiene carga global. Después de la reacción, el número de oxidación de Pt es +2. Esto se debe a que cuando asignamos los cuatro electrones de los dos enlaces simples de Pt-C al ligando, el ligando se convierte en un ligando (Ph-C=C-Ph) 2- con cada átomo de C llevando una carga 1-. Debido a que el complejo producto es neutro en general, el número de oxidación de Pt es +2.
Reacciones de desplazamiento nucleofílico
Otra reacción importante es la reacción de desplazamiento nucleofílico. Este tipo de reacción puede clasificarse como una adición oxidativa aunque no cumple estrictamente con la definición. En estas reacciones un complejo metálico (típicamente un anión) actúa como nucleófilo. Se agrega un ligando, pero no se agregan electrones al complejo. Las reacciones pueden ser extremadamente útiles para la síntesis de compuestos orgánicos. La utilidad resulta principalmente del hecho de que un electrófilo orgánico se convierte en nucleófilo.
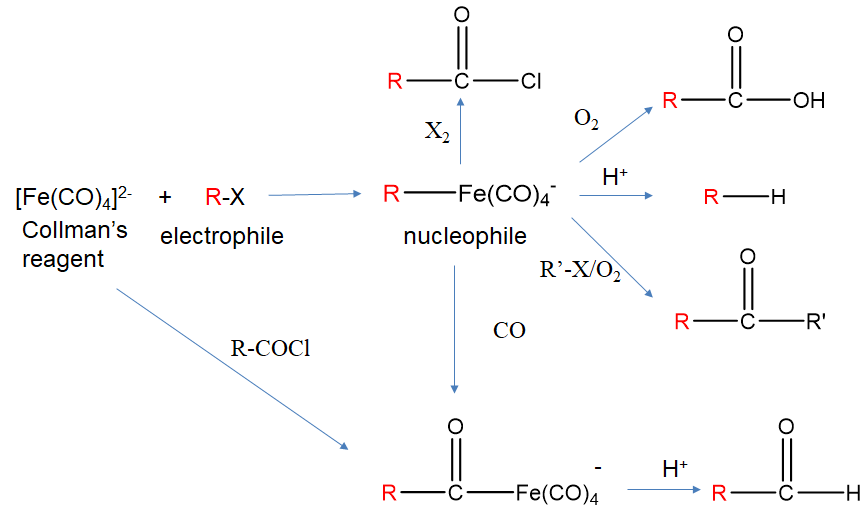
Por ejemplo, el ferrato de tetracarbonilo (2-), también conocido como reactivo de Collman, reacciona con haluros de alquilo para formar ferrato de alquil tetracarbonilo (-) (Fig. \(\PageIndex{5}\)). Podemos verificar que la adición del grupo alquilo no agregó ningún electrón contando los electrones antes y después de la reacción. El anión Fe (CO) 4 2- es un complejo 18e. Aplicando el método del átomo neutro al conteo de electrones en [R-Fe (CO) 4] - significa que Fe aporta 8e, la carga 1- agrega 1e, los ligandos CO 4x2=8 electrones y el ligando alquilo 1e. Esto da 8+1+8+1=18 electrones. Además, el número de oxidación del Fe no ha cambiado tras la adición del ligando. Es -2 antes y después de la reacción.
En el anión alquiltetracarbonilo ferrato (1-), el grupo R que antes era electrófilo en R-X, ahora puede actuar como nucleófilo debido a que el enlace Fe-C está polarizado hacia el átomo C. Como nucleófilo puede, por ejemplo, reaccionar con protones para formar un alcano. También puede reaccionar con oxígeno para formar un ácido carboxílico. En presencia de otro haluro de alquilo R'-X puede formar una cetona R-C (O) -R'. También puede insertar CO en el enlace Fe-C en una llamada reacción de inserción migratoria, y el producto de reacción puede reaccionar con ácido para formar un aldehído. Con dihalógenos X 2 puede formar cloruro de acilo. El reactivo de Collman no solo puede agregar haluros de alquilo por haluros de acilo para formar ferratos de acil tetracarbonilo (-).


