14.1.3: Eliminación reductiva
- Page ID
- 81616
Reacciones de eliminación reductora
La eliminación reductiva es el reverso microscópico de la adición oxidativa. La eliminación reductiva solo puede ocurrir cuando los dos ligandos a eliminar están en posición cis.
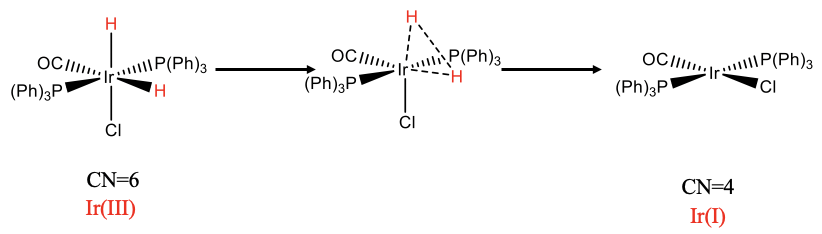
Por ejemplo, la cis-adición oxidativa previamente discutida de H 2 al complejo de iridio es reversible, y a lo contrario se le llama eliminación reductiva (Fig. \(\PageIndex{1}\)). La orientación cis-de los dos ligandos hidrido es necesaria para formar un enlace H-H. Se puede pensar que la reacción va por una ruta de reacción en la que los enlaces Ir-H se hacen gradualmente más grandes y la distancia H-H gradualmente menor hasta que la molécula H2 se elimina del complejo.
Durante la eliminación reductiva, los electrones en el enlace M—X se dirigen hacia el ligando Y, y los electrones en M—Y se dirigen hacia el metal. ¡Los ligandos eliminadores son siempre de tipo X! En general, el estado de oxidación del metal disminuye en dos unidades, se dispone de dos nuevos sitios de coordinación abiertos y se forma un enlace X—Y. ¿Qué sugiere el cambio en el estado de oxidación sobre los cambios en la densidad de electrones en el metal? Como sugiere el nombre “reductivo”, el metal gana electrones. Los ligandos pierden electrones ya que el nuevo enlace X—Y no puede polarizarse tanto a X como a Y, como lo fueron los enlaces M—X y M—Y originales. Usando estas ideas, es posible que ya estés pensando en las tendencias de reactividad en la eliminación reductiva... sostén ese pensamiento.
Se ha observado en varios casos que un ligando se disocia de complejos octaédricos antes de que ocurra la eliminación reductiva concertada. Presumiblemente, la disociación para formar una geometría de TBP distorsionada acerca a los grupos eliminadores entre sí para facilitar la eliminación.

Los complejos planos cuadrados pueden tomar un quinto ligando adicional o perder un ligando para formar un complejo de coordenadas impares antes de la eliminación reductora. También es posible la eliminación reductiva directa sin disociación ni asociación.
Las tendencias de reactividad en la eliminación reductora son opuestas a las de la adición oxidativa. Más ligandos ricos en electrones que llevan grupos donadores de electrones reaccionan más rápidamente, ya que los ligandos pierden densidad electrónica a medida que avanza la reacción. Más centros metálicos pobres en electrones, que llevan ligandos π-ácidos y/o ligandos con grupos aceptores de electrones, reaccionan más rápidamente, ya que el centro metálico gana electrones. Los ligandos auxiliares estéricamente voluminosos promueven la eliminación reductora ya que la liberación de X e Y puede “aliviar” la cepa estérica en el complejo inicial. El impedimento estérico ayuda a explicar, por ejemplo, por qué la coordinación de un quinto ligando a un complejo plano cuadrado promueve la eliminación reductiva a pesar de que la coordinación aumenta la densidad de electrones en el centro metálico. Un segundo ejemplo: las tendencias en las tasas de eliminaciones reductoras de alcanos son paralelas a las demandas estéricas de los ligandos eliminadores: C—C > C—H > H—H.

Las tendencias mecanicistas para la eliminación reductiva en realidad son paralelas a las tendencias en los mecanismos de adición oxidativa, ya que estas dos reacciones son el reverso microscópico entre sí. Los ligandos no polares y moderadamente polares reaccionan por mecanismos concertados o radicales; los ligandos altamente polarizados y/o complejos metálicos muy electrofílicos reaccionan por mecanismos iónicos (S N 2). ¡La termodinámica de la eliminación reductiva debe ser favorable para que ocurra! La mayoría de las eliminaciones reductoras carbono-halógeno, por ejemplo, son termodinámicamente desfavorables (esto ha resultado ser algo bueno, especialmente para las reacciones de acoplamiento cruzado).
La eliminación reductiva es un paso importante en muchos ciclos catalíticos, generalmente se acerca al “final” de los mecanismos catalíticos, justo antes de la formación del producto. Para algunos ciclos catalíticos es el paso limitante de volumen de negocios, ¡por lo que es muy importante considerarlo! La hidrocianación es un ejemplo clásico; en el mecanismo de esta reacción, la eliminación reductiva de C-CN es el paso lento. ¡Los ligandos alquílicos pobres en electrones, derivados de olefinas pobres en electrones como las cetonas insaturadas, son lo suficientemente malos en la eliminación reductiva para evitar la rotación por completo! Por supuesto, el ligando electronegativo CN tampoco ayuda a las cosas... ¿cómo diseñarías los ligandos auxiliares L para acelerar este paso?

Dr. Michael Evans (Georgia Tech)
Template:ContribLandskron

