5.4: Concentración de soluciones
( \newcommand{\kernel}{\mathrm{null}\,}\)
La concentración de una solución indica la cantidad de soluto disuelto en una cantidad dada de solución.
Hacer una solución de concentración de conocimiento
Una cantidad medida de soluto se disuelve en suficiente disolvente para hacer el volumen deseado de la solución, como se ilustra en la Fig. 5.4.1. La concentración de la solución se puede expresar de diferentes maneras usando unidades de masa, volumen o moles, como se explica a continuación.
Concentración en porcentaje (%)
El porcentaje (%) es un número o razón que representa una fracción de 100.
Por ejemplo, 5% significa 5:100, donde 5 es la parte, y 100 es el total. El porcentaje se calcula como cien veces de parte por total, es decir,
\ begin {ecuación}
\ texto {Porcentaje} (\%) =\ frac {\ texto {parte}} {\ texto {Total}}\ veces 100. \ nonumber
\ end {ecuación}
Se disuelve un NaCl de 50.0 g en agua para hacer una solución de 500 g. ¿Cuál es el porcentaje de NaCl en la solución?
Solución
Parte dada = 50.0 g NaCl, y total = 500 g de solución. Deseado: ¿% NaCl en la solución?
Fórmula: Percentage (%)= part Total ×100.
Cálculos: Percentage (%)=50.0cancel g500cancel g×100=10.0 %NaCl
Las unidades cancelan en la parte de cálculo de fracciones, y se agrega un signo de% a la respuesta para decir que es una fracción de cien.
Porcentaje de masa (m/m)% de concentración
La concentración porcentual en masa expresa las unidades de masa de soluto en cien unidades de masa de la solución.
\ begin {ecuación}
\ nombreoperador {Masa} (\%) =\ frac {\ text {masa de soluto} (g)} {\ text {masa de soluto} (g) +\ text {masa de solvente} (g)}\ times 100=\ frac {\ text {masa de soluto} (g)} {\ text {masa de solución} (g)}\ veces 100\ nonumber
\ end {ecuación}
Obsérvese que el total es soluto y disolvente añadidos juntos, es decir, solución.
¿Cuál es el% en masa de NaOH en una solución preparada disolviendo 10.0 g NaOH en 100 g de agua?
Solución
Dado soluto = 10.0 g, y disolvente = 100 g, Deseado: Masa% NaOH?
Fórmula: Mass (%)= mass of solute (g) mass of solute (g)+ mass of solvent (g)×100
Cálculos: Mass (%)=10.0 gNaOH(10.0 g+100 g) solution ×100=9.09%NaOH
Tenga en cuenta que la concentración de% en masa y su recíproco son dos factores de conversión: given g solute 100g solution y100g solution given g solute
El antibiótico de neosporina es una solución de neomicina al 3.5% m/m. ¿Cuántos gramos de neomicina hay en 50 g de ungüento?
Solución
Dado:3.5% neomycin =3.5 g neomycin 100 g solution , y Cantidad de solución = 50 g, Deseado:? g neomicina
Cálculos:50 g solution ×3.5 g neomycin 100 g solution =1.8 g neomycin.
Porcentaje en volumen (v/v)% de concentración
La concentración porcentual en volumen expresa las unidades de volumen de soluto en cien unidades de volumen de la solución.
La forma matemática del% v/v es:
\ begin {ecuación}
\ text {Volumen} (\%) =\ frac {\ text {volumen de soluto} (\ mathrm {mL})} {\ text {volumen de solución} (\ mathrm {mL})}\ times 100\ nonumber
\ end {ecuación}
La Fig. 5.4.2 muestra los intervalos de concentración porcentual en volumen de diferentes clases de fragancias.

¿Cuál es el% en volumen de extracto de rosa en una solución preparada disolviendo 14.0 mL de extracto de rosa en un solvente para hacer 200 mL de solución?
Solución
Dado: Soluto = 14.0 g, y solución = 200 g, Deseado: Volumen% solución de rosa?
Fórmula:\ begin {ecuación}
\ text {Volumen} (\%) =\ frac {\ text {volumen de soluto} (m L)} {\ text {volumen de solución} (m L)}\ times 100\ nonumber
\ end {ecuación}
Cálculos:\ begin {ecuación}
\ text {Volumen} (\%) =\ frac {14\ mathrm {~mL}\ text {extracto de rosa}} {200\ mathrm {~mL}\ text {solution}}\ times 100=7.0\%\ text {solución rosa}\ nonumber
\ end {ecuación}
Los dos factores de conversión para v/v% concentración son:\ begin {ecuación}
\ frac {\ text {dado mL soluto}} {100\ mathrm {~mL}\ text {solution}}\ quad\ text {, y}\ quad\ frac {100\ mathrm {~mL}\ text {solution}} {\ text {dado}\ mathrm {~mL}\ text {soluto}\ nonumbte er
\ end {ecuación}
¿Cuál es el volumen de bromo (Br 2) en 250 mL de 4.8% v/v de solución de Br 2 en tetracloruro de carbono?
Solución
Dado: Concentración 4.8% v/v bromo=4.8 mL bromine 100 mL solution , volumen de solución = 250 mL, Deseado: Volumen de soluto, es decir,? mL de bromo.
Cálculos:\ [
250\ mathrm {~mL}\ text {solution}\ times\ frac {4.8\ mathrm {~mL}\ text {bromo}} {100\ mathrm {~mL}\ text {solution}.} =12\ mathrm {~mL ~bromo}\ text {.}\ nonumber\]
Porcentaje masa/volumen (m/v)% de concentración
La concentración porcentual masa/volumen expresa las unidades de masa de soluto en cien unidades de volumen de solución.
La forma matemática de m/v% es:
\ begin {ecuación}
\ text {masa/volumen} (\%) =\ frac {\ text {masa de soluto} (g)} {\ text {volumen de solución} (m L)}\ times 100\ nonumber
\ end {ecuación}
¿Cuál es el% masa/volumen de solución de glucosa que se prepara disolviendo 50 g de glucosa en agua suficiente para hacer 1000 mL de solución?
Solución
Dado: Soluto = 50.0 g, y Solución = 1000 mL, Deseado: Masa/volumen% solución de glucosa?
Fórmula:\ begin {ecuación}
\ text {masa/volumen} (\%) =\ frac {\ text {masa de soluto} (g)} {\ text {volumen de solución} (m L)}\ times 100\ nonumber
\ end {ecuación}
Cálculos:\ begin {ecuación}
\ frac {\ text {Mass}} {\ text {volume}} (\%) =\ frac {50\ mathrm {~g}\ text {glucosa}} {1000\ mathrm {~mL}\ text {solution}}\ times 100=5.0\%\ text {solución de glucosa por}\ frac {\ mathrm {m}} {\ mathrm {v}}. \ nonumber
\ end {ecuación}
Los dos factores de conversión de ms/v% concentración son:\ begin {equation}
\ frac {\ text {dado} g\ text {soluto}} {100\ mathrm {~mL}\ text {solution}}\ quad\ text {y}\ quad\ frac {100\ mathrm {~mL}\ text {solution}} {\ text {dado}\ mathrm {g}\ text {soluto}}\ nonumber
\ end { ecuación}
¿Cuántos gramos de antibióticos de clindamicina hay en una cápsula de 45 mL de la clindamicina al 1.0% (m/v)?
Solución
Dado:% m/v concentración: 1.08% m/v clindamicina=1.0 g clindamycin 100 mL solution , y volumen de solución = 45 mL, Deseado:? g clindamicina?
Cálculos:\ begin {ecuación}
45\ text {mL solution}\ times\ frac {1.0\ mathrm {~g}\ text {clindamicina}} {100\ mathrm {~mL}\ text {solution}} =4.5\ mathrm {~g}\ text {clindamicina.}\ nonumber
\ end {ecuación}
Concentración de partes por millón (ppm) y partes por mil millones (ppb)
Partes por millón (ppm) es un número o proporción expresado como una fracción de millón (10 6).
Por ejemplo, 2 ppm significa21,000,000 o 2:1 ,000,000, donde 2 es la parte, y 1,000,000 es el total. La concentración en ppm se calcula como un millón de veces de parte por total, es decir:\ begin {ecuación}
\ text {Concentración en ppm} =\ frac {p a r t} {\ text {Total}}\ times 10^ {6}\ nonumber
\ end {ecuación}
Partes por mil millones (ppb) es un número o proporción expresado como una fracción de mil millones (10 9).
Es decir:\ begin {ecuación}
\ text {Concentración en ppb} =\ frac {\ text {part}} {\ text {Total}}\ times 10^ {9}\ nonumber
\ end {ecuación}
Al igual que la concentración porcentual, los ppm y ppb pueden ser masa/masa (m/m), volumen/volumen (v/v) o masa/volumen (m/v).
El límite de acción de la EPA para el cobre es de 1.3 mg/L en agua potable. ¿Cuál es este límite en ppm de cobre m/v en el agua potable?
Solución
Dado: 1.3 mg de cobre en solución de 1L, Deseado:? ppm m/v de Cobre en agua
Fórmula: Concentration in ppm =solute( g)solution( mL)×106
Cálculos: Primero, convierta las unidades dadas de masa y volumen en las unidades correspondientes que tome la fórmula, luego conecte los valores en la fórmula y calcule.
Solute =1.3 mg×1 g1000 mg=0.0013 g
Solution =1 L×1000 mL1 L=1000 mL
Concentration in ppm =0.0013 g1000 mL×106=1.3 ppm copper v/m
El límite de acción de la EPA para el plomo es de 0.015 mg/L en agua potable. ¿Cuál es este límite en ppb de plomo m/v en el agua potable?
Solución
Dado: 0.015 mg en solución de 1L, Deseado:? ppb m/v de Plomo en agua
Fórmula: Concentration in ppb =solute(g)solution(mL)×109
Cálculos: Primero, convierta las unidades dadas de masa y volumen en las unidades correspondientes que tome la fórmula, luego conecte los valores en la fórmula y calcule.
Solute =0.015 mg×1 g1000 mg=0.000015 g
Solution =1 L×1000 mL1 L=1000 mL
Concentration in ppb =0.000015 g1000 mL×109=15 ppb lead v/m
Molaridad
La molaridad (M) expresa los moles de soluto en un litro de solución.
La unidad de concentración de solución más común utilizada en química es la molaridad (M):
Molarity (M)=n (moles of solute )V (Litters of solution )
¿Cuál es la molaridad (M) de una solución preparada disolviendo 50.0 g de NaOH en suficiente agua para hacer 250 mL de solución?
Solución
Dado: Soluto = 50.0 g NaOH, Volumen de solución = 250 mL, Deseado:? ¿Solución M de NaOH?
Fórmula: Molarity (M)=n (moles of solute )V (Litters of solution )
Cálculos: Primero, convierta las unidades dadas de masa y volumen en las unidades correspondientes que tome la fórmula, luego conecte los valores en la fórmula y calcule.
Solute =50.0 g NaOH×1 mol NaOH40.00 g NaOH=1.25 mol NaOH
Solution =250 mL×1 L1000 mL=0.250 L
Molarity (M)=1.25 mol NaOH0.250 L solution=5.00 M NaOH
Los dos factores de conversión de molaridad son los siguientes:
n (moles of solute) V (Litters of solution) and V (Litters of solution) n (moles of solute )
¿Cuántas camadas de solución de HCl 0.211 M se necesitan para proporcionar 0.400 mol de HCl?
Solución
Dado: cantidad de soluto = 0.400 mol HCl, Concentración de soluto = 0.211M =0.211 mol HCl1L solution
Cálculos: Liters of solution needed =0.400 mol HCl×1 L soluton 0.211 mol HCl=1.90 L solution
Una solución de 2.50 L de NaOH 1.12 M contiene ¿cuántos moles de NaOH?
Solución
Dado: Volumen de solución = 2.50 L de solución, concentración de solución =1.12 M NaOH=1.12 mol NaOH1 L solution , Deseado:? ¿moles de NaOH?
Cálculos: Moles of NaOH in the solution =2.50 L solution ×1.12 mol NaOH1 L solution =2.80 mol NaOH
Dilución de soluciones
La dilución de una solución es la adición de un disolvente para disminuir la concentración de soluto del soluto en la solución.
El producto de concentración (C) y volumen (V) es la cantidad de soluto, es decir,
\ begin {ecuación}
\ text {Cantidad de soluto} =C\ text {in}\ frac {\ text {cantidad de soluto}} {\ text {volumen de solución}}\ veces V\ text {en volumen de solución.}\ nonumber
\ end {ecuación}
La cantidad de soluto no cambia añadiendo disolvente. Por lo tanto, el producto de concentración y volumen, es decir, CV, que es la cantidad de soluto, es una constante, es decir,
\ begin {ecuación}
C_ {1} V_ {1} =C_ {2} V_ {2} =\ texto {cantidad de soluto}\ nonumber
\ end {ecuación}
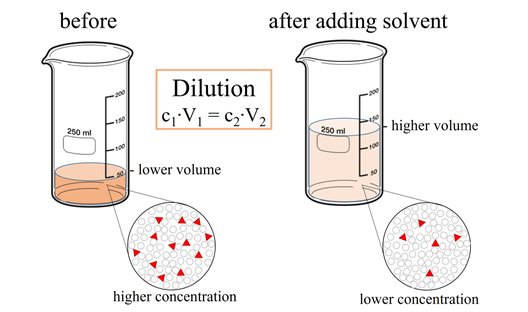
La Fig. 5.4.3 muestra que si la concentración inicial es C1, el volumen inicial es V 1, y después de la dilución, la concentración final es C 2, el volumen final es V 2, luego C 1 V 1 = C 2 V 2 = cantidad de soluto que es constante. Si se conocen tres de las cuatro variables en esta ecuación, se puede calcular la que falta, como se explica en el siguiente ejemplo.
Tenga en cuenta que las concentraciones y volúmenes deben estar en las mismas unidades en ambos lados de la ecuación: C 1 V 1 = C 2 V 2. Si no están en las mismas unidades, conviértalas a las mismas unidades antes de sumergirlas en la fórmula.
¿Cuánto volumen de HCl 11.3 M se necesita para preparar 250 mL de HCl 2.00 M?
Solución
Dado: C 1 = 11.3 M HCl, C 2 = 2.00 M HCl, V 2 = 250 mL solución, Deseado V 1 =?
Fórmula: C 1 V 1 = C 2 V 2, reordenarlo para aislar el parámetro deseado:V1=C2V2C1
Cálculos:V1=C2V2C1=2.00 M HCl×250 mL solution 11.3 M HCl=44.2 mL solution
¿Cuál es la molaridad de la solución de NaOH preparada diluyendo 100 mL de solución de NaOH 0.521 M a 500 mL?
Solución
Dado C 1 = 0.521 M NaOH, V 1 = 100 mL solución, V 2 = 500 mL solución, Deseado: Concentración de la solución final C 2 =? NaOH M
Fórmula: C 1 V 1 = C 2 V 2, reorganizar para aislar el parámetro deseado:C2=C1V1V2
Cálculos:C2=C1V1V2=0.521 M NaOH×100 mL NaOH500 mL NaOH=0.104 M NaOH
La dopamina se administra por vía intravenosa a un paciente para aumentar la presión arterial. ¿Cuántos mililitros (mL) de una solución de dopamina al 4.0% (m/v) se necesitan para preparar 250 mL de una solución al 0.030% m/v)?
Solución
Dado: C 1 = 4.0% (m/v), C 2 = 0.030% (m/v), V 2 = 250 mL solución, Deseado V 1 =?
Fórmula: C 1 V 1 = C 2 V 2, reorganizar para aislar el parámetro deseado:V1=C2V2C1
Cálculos:V1=C2V2C1=0.030%×250 mL solution 4.0%=5.0 mL of solution
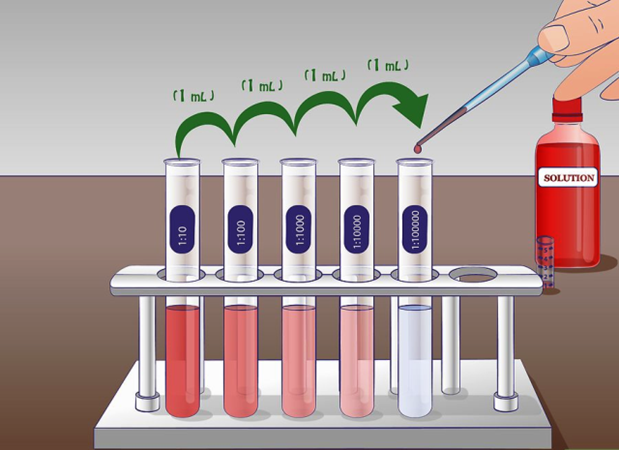
dilución logarítmica
Tomar un volumen unitario de una solución dada y agregar suficiente disolvente para aumentar el volumen de la solución 10 veces para un diluitón logarítmico.
Una dilución logarítmica es diez veces la dilución, es decir, probada por la siguiente fórmula:C2=C1V1V2=1 mL×C110 mL=0.1×C1
Repetir el paso anterior con la solución diluida da como resultado 10x10 = dilución de 100 veces, y repetir la tercera vez resulta en 10x10x10 = dilución de 1000 veces. Esta dilución de 10 veces en cada paso se denomina dilución logarítmica. La Fig. 5.4.4 muestra que cinco etapas de dilución logarítmica en una solución inicial al 10% dan como resultado una concentración de 10 ppm en la solución final.