5.5: Ósmosis
( \newcommand{\kernel}{\mathrm{null}\,}\)
Las membranas semipermeables rodean las células vivas y los orgánulos en las células. Las membranas semipermeables permiten el agua y las moléculas pequeñas pero no permiten el paso de moléculas e iones grandes.
La ósmosis es el paso de agua y moléculas pequeñas a través de una membrana semipermeable con un flujo neto de una solución menos concentrada a una solución más concentrada.
La ósmosis ayuda en la absorción, retención y flujo de agua, nutrientes y otras moléculas requeridas en los sistemas biológicos. La Fig. 5.5.1 ilustra el proceso de ósmosis.
Presión osmótica
La ósmosis provoca un flujo neto de agua de la solución menos concentrada a la más concentrada a través de la membrana semipermeable. En consecuencia, el nivel de agua sube en el compartimento de solución menos concentrada, como se ilustra en la Fig. 5.5.2. La diferencia en la altura del agua aumenta y aplica presión, bombeando el agua de nuevo al lado más concentrado hasta que el flujo de agua sea igual en los dos lados.
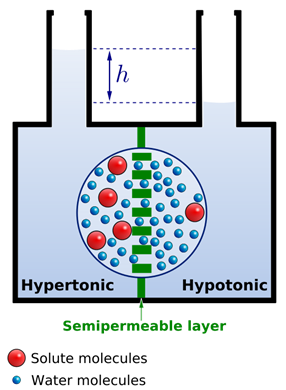
La presión que impide el flujo de agua adicional hacia el lado de solución más concentrada de la membrana semipermeable se llama presión osmótica.
La presión osmótica es proporcional a la concentración global de las partículas de soluto. Por ejemplo, el NaCl 0.1 molar tiene una presión osmótica aproximadamente el doble que la de glucosa 0.1 molar debido a que cada mol de glucosa agrega un mol de partículas de soluto, mientras que cada mol de NaCl produce dos moles de partículas, es decir, un mol de iones Na + y un mol Cl - en la solución.
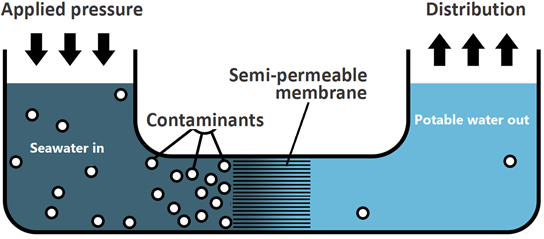
La ósmosis inversa es el flujo neto de agua al agua menos concentrada o pura a través de la membrana semipermeable al aplicar presión externa más que la presión osmótica en el lado de la solución más concentrada.
La ósmosis inversa es el flujo neto de agua al agua menos concentrada o pura a través de la membrana semipermeable al aplicar presión externa más que la presión osmótica. Tenga en cuenta que el flujo de disolvente en ósmosis inversa impulsada por presión externa es lo opuesto a la ósmosis regular. La ósmosis inversa se utiliza para producir agua potable a partir de fuentes de agua de mar, como se ilustra en la Fig. 5.5.3.
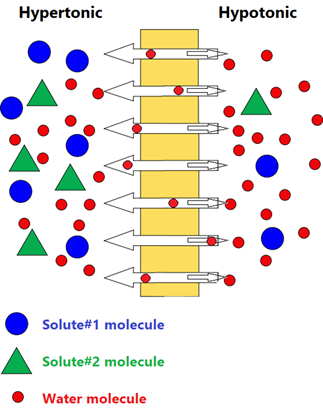
Soluciones isotónicas, hipertónicas e hipotónicas
Las membranas celulares son membranas semipermeables que separan los fluidos intracelulares y extracelulares. La diferencia de concentración a través de la membrana y la presión osmótica resultante juega un papel esencial en las funciones celulares. Las soluciones intravenosas inyectadas en los pacientes deben tener la misma presión osmótica que los fluidos corporales.
Las soluciones con la misma concentración de partículas de soluto y presión osmótica se denominan isotónicas. Si las dos soluciones a través de una membrana semipermeable no tienen la misma concentración de partículas de soluto, la solución con mayor concentración de partículas de soluto y mayor presión osmótica es hipertónica, y la otra tiene menor concentración de partículas de soluto y menor presión osmótica es hipotónico.
Recuerde que hiper- significa más e hipo-significa menos, concerniente a la concentración de partículas de soluto en el caso de la ósmosis.
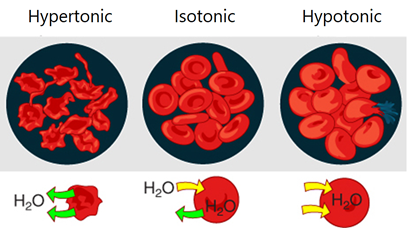
Las células colocadas en una solución externa pueden retener su tamaño, encogerse o hincharse dependiendo de la presión osmótica relativa del fluido dentro y fuera de la celda, como se ilustra en la Fig. 5.5.4. Por ejemplo, los glóbulos rojos colocados en una solución isotónica conservan su tamaño debido a que el flujo de agua dentro y fuera de la célula es el mismo.
- Las soluciones isotónicas típicas son solución de NaCl al 0.9% m/v en agua o solución de glucosa al 5% m/v en agua.
- Los glóbulos rojos colocados en una solución hipertónica se reducen de tamaño debido a que hay más flujo de agua que hacia la célula, un proceso llamado crenación.
- Los glóbulos rojos colocados en una solución hipotónica se hinchan y estallan debido a que más agua fluye dentro que fuera de las células, un proceso llamado hemólisis.
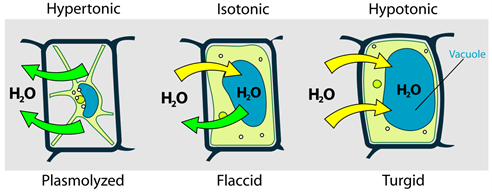
Una situación similar ocurre en células vegetales que se colocan en diferentes ambientes respecto a la presión osmótica, como se ilustra en la Fig. 5.5.5.
Diálisis
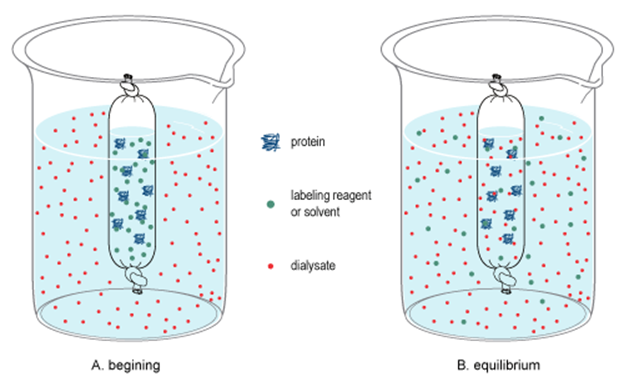
La diálisis separa los coloides del agua, los iones disueltos y las moléculas de pequeña dimensión
La diálisis es similar a la ósmosis con la diferencia de que en el agua de diálisis, pequeñas moléculas e iones pueden pasar a través de una membrana de dialización dejando atrás colisionar partículas como proteínas y moléculas de almidón, como se ilustra en la Fig. 5.5.6.
Papel de la diálisis en el cuerpo humano
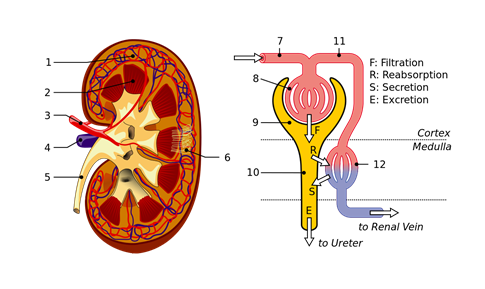
Los riñones filtran la sangre por proceso de diálisis. Hay más de un millón de estructuras tubulares, llamadas nefronas, en el riñón rodeadas de membranas dializantes. Las nefronas filtran el agua, pequeñas moléculas como glucosa, aminoácidos, urea e iones de la sangre. Los productos útiles y la mayor parte del agua se reabsorben posteriormente, pero la urea y otros productos de desecho se excretan a través de la orina, como se ilustra en la Fig. 5.5.7.
Hemodiálisis
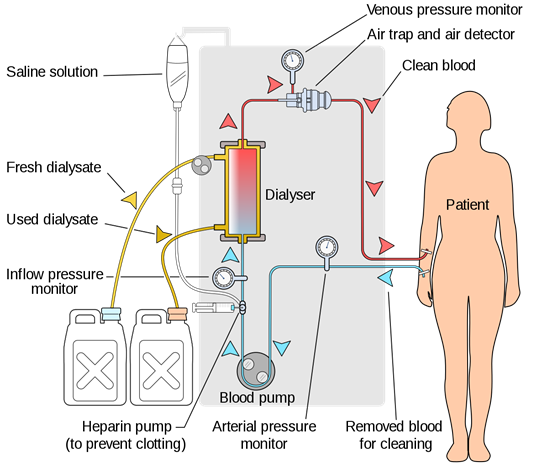
La hemodiálisis se utiliza para extraer urea y otros productos de desecho de la sangre cuando el riñón de una persona no logra eliminarlos, como se ilustra en la Fig. 5.5.8. Un sistema de hemodiálisis es una especie de riñón artificial en el que la sangre fluye a través de largos tubos de celofán colocados en una solución isotónica que contiene NaCl, KCl, NaHCO 3 y glucosa. El celofán es una membrana dializante que no deja que las proteínas, otras moléculas grandes y la sangre pasen a través de ella, sino que la urea excreta.