2.1: Isótopos y masa atómica
- Page ID
- 77576
Resultados de aprendizaje
- Definir números atómicos y de masa.
- Determinar el número de protones, neutrones y electrones en un átomo.
- Identificar la carga y masa relativa de las partículas subatómicas.
- Marcar la ubicación de las partículas subatómicas en el átomo.
- Definir isótopo.
- Escribe el símbolo isotópico de un átomo.
- Explicar el concepto de masa atómica promedio.
Los átomos son los bloques de construcción fundamentales de toda la materia y están compuestos por protones, neutrones y electrones. Debido a que los átomos son eléctricamente neutros, el número de protones cargados positivamente debe ser igual al número de electrones cargados negativamente. Dado que los neutrones no afectan la carga, el número de neutrones no depende del número de protones y variará incluso entre átomos del mismo elemento.
Número atómico
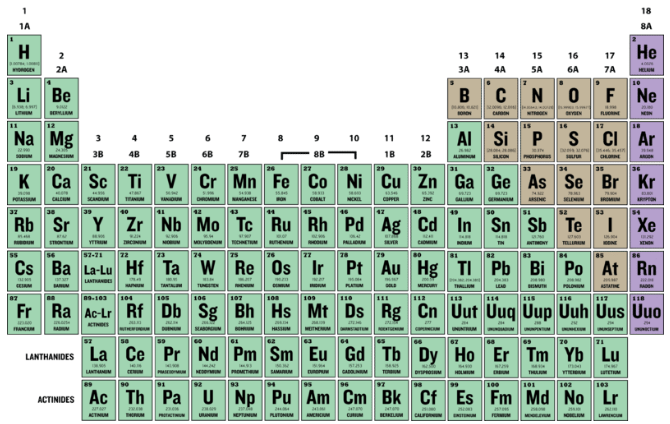
El número atómico (Z) de un elemento es el número de protones en el núcleo de cada átomo de ese elemento. Un átomo puede clasificarse como un elemento particular basado únicamente en su número atómico. Por ejemplo, cualquier átomo con un número atómico de 8 (su núcleo contiene 8 protones) es un átomo de oxígeno, y cualquier átomo con un número diferente de protones sería un elemento diferente. La tabla periódica (ver figura abajo) muestra todos los elementos conocidos y está dispuesta en orden de aumento del número atómico. En esta tabla, el número atómico de un elemento se indica por encima del símbolo elemental. El hidrógeno, en la parte superior izquierda de la mesa, tiene un número atómico de 1. Cada átomo de hidrógeno tiene un protón en su núcleo. A continuación sobre la mesa está el helio, cuyos átomos tienen dos protones en el núcleo. Los átomos de litio tienen tres protones, los átomos de berilio tienen cuatro, y así sucesivamente.
Dado que los átomos son neutros, el número de electrones en un átomo es igual al número de protones. Todos los átomos de hidrógeno tienen un electrón ocupando el espacio exterior del núcleo. El helio, con dos protones, tendrá dos electrones.
Número Masivo
Los datos experimentales mostraron que la gran mayoría de la masa de un átomo se concentra en su núcleo, el cual está compuesto por protones y neutrones. El número de masa se define como el número total de protones y neutrones en un átomo. Considera la siguiente tabla, que muestra datos de los primeros seis elementos de la tabla periódica.
| Nombre | Símbolo | Número atómico | Protones | Neutrones | Electrones | Número Masivo |
|---|---|---|---|---|---|---|
| hidrógeno | \(\ce{H}\) | 1 | 1 | 0 | 1 | 1 |
| helio | \(\ce{He}\) | 2 | 2 | 2 | 2 | 4 |
| litio | \(\ce{Li}\) | 3 | 3 | 4 | 3 | 7 |
| berilio | \(\ce{Be}\) | 4 | 4 | 5 | 4 | 9 |
| boro | \(\ce{B}\) | 5 | 5 | 6 | 5 | 11 |
| carbono | \(\ce{C}\) | 6 | 6 | 6 | 6 | 12 |
Vea animaciones que muestran la estructura atómica de los primeros 11 elementos en la tabla periódica en http://web.visionlearning.com/custom...imations.shtml
Considera el elemento helio. Su número atómico es 2, por lo que tiene dos protones en su núcleo. Su núcleo también contiene dos neutrones. Ya que\(2 + 2 = 4\), sabemos que el número de masa del átomo de helio es 4. Por último, el átomo de helio también contiene dos electrones, ya que el número de electrones debe ser igual al número de protones. Este ejemplo puede llevarte a creer que los átomos tienen el mismo número de protones y neutrones, pero un examen más detallado de la tabla anterior demostrará que este no es el caso. El litio, por ejemplo, tiene tres protones y cuatro neutrones, lo que le da un número de masa de 7.
Conocer el número de masa y el número atómico de un átomo permite determinar el número de neutrones presentes en ese átomo por resta.
\[\text{Number of neutrons} = \text{mass number} - \text{atomic number}\]
Los átomos del elemento cromo\(\left( \ce{Cr} \right)\) tienen un número atómico de 24 y un número másico de 52. ¿Cuántos neutrones hay en el núcleo de un átomo de cromo? Para determinar esto, restaría como se muestra:
\[52 - 24 = 28 \: \text{neutrons in a chromium atom}\]
La composición de cualquier átomo se puede ilustrar con una notación taquigráfica usando el número atómico y el número másico. Ambos están escritos antes del símbolo químico, con el número de masa escrito como superíndice y el número atómico escrito como subíndice. El átomo de cromo discutido anteriormente estaría escrito como:
\[\ce{^{52}_{24}Cr}\]
Otra forma de referirse a un átomo específico es escribir el número de masa del átomo después del nombre, separado por un guión. El átomo anterior estaría escrito como cromo-52, con el número de masa escrito después del nombre. El número atómico no tiene que ser incluido porque todos los átomos de cromo tienen el mismo número de protones pero pueden variar en la masa atómica.
Isótopos
Como se dijo anteriormente, no todos los átomos de un elemento dado son idénticos. Específicamente, el número de neutrones en el núcleo puede variar para muchos elementos. Como ejemplo, el carbono natural existe en tres formas, las cuales se ilustran en la siguiente figura.

Cada átomo de carbono tiene el mismo número de protones (6), que es igual a su número atómico. Cada átomo de carbono también contiene seis electrones, lo que permite que el átomo permanezca eléctricamente neutro. Sin embargo, el número de neutrones varía de seis a ocho. Los isótopos son átomos que tienen el mismo número atómico pero diferentes números de masa debido a un cambio en el número de neutrones. Los tres isótopos de carbono pueden denominarse carbono-12\(\left( \ce{^{12}_6C} \right)\), carbono-13\(\left( \ce{^{13}_6C} \right)\) y carbono-14\(\left( \ce{^{14}_6C} \right)\). Las muestras naturales de la mayoría de los elementos son mezclas de isótopos. El carbono tiene sólo tres isótopos naturales, pero algunos elementos más pesados tienen muchos más. El estaño tiene diez isótopos estables, que es la mayor parte de cualquier elemento conocido. El núcleo de un átomo de carbono dado será uno de los tres posibles isótopos discutidos anteriormente.
Si bien la presencia de isótopos afecta la masa de un átomo, no afecta su reactividad química. El comportamiento químico se rige por el número de electrones y el número de protones. El carbono-13 se comporta químicamente exactamente de la misma manera que el carbono-12 más abundante.
Tamaño de los átomos
El grafito en tu lápiz está compuesto por el elemento carbono, un no metal. Imagínese tomar un pequeño trozo de carbono y triturarlo hasta que quede un polvo fino. Cada mota de carbono aún tendría todas las propiedades físicas y químicas del carbono. Ahora imagina que de alguna manera podrías seguir dividiendo la mota de carbono en piezas cada vez más pequeñas. Eventualmente, llegarías a un punto en el que tu muestra de carbono es tan pequeña como podría ser. Esta partícula final se llama átomo.
Los átomos, como probablemente sabrás, son extremadamente pequeños. De hecho, el grafito en un lápiz ordinario contiene aproximadamente\(5 \times 10^{20}\) átomos de carbono. Se trata de un número casi incomprensiblemente grande. La población de toda la Tierra se trata de\(7 \times 10^9\) personas, es decir, ¡hay casi\(7 \times 10^{10}\) veces tantos átomos de carbono en tu lápiz como personas en la Tierra! Para que esto sea cierto, los átomos deben ser extremadamente pequeños. Solo podemos ver átomos con un instrumento moderno llamado microscopio de túnel de barrido. (www.nobelprize.org/educationa... opes/scanning/)
Masa atómica
Las masas de átomos individuales son muy, muy pequeñas. Sin embargo, utilizando un dispositivo moderno llamado espectrómetro de masas, es posible medir tales masas minúsculas. Un átomo de oxígeno-16, por ejemplo, tiene una masa de\(2.66 \times 10^{-23} \: \text{g}\). Si bien las comparaciones de masas medidas en gramos tendrían alguna utilidad, es mucho más práctico tener un sistema que nos permita comparar más fácilmente las masas atómicas relativas. Los científicos decidieron usar el nucleido carbono-12 como estándar de referencia por el cual se compararían todas las demás masas. Por definición, a un átomo de carbono-12 se le asigna una masa de exactamente 12 unidades de masa atómica\(\left( \text{amu} \right)\). Una unidad de masa atómica se define como una masa igual a una doceava parte de un átomo de carbono-12. La masa de cualquier isótopo de cualquier elemento se expresa en relación con el patrón carbono-12. Por ejemplo, un átomo de helio-4 tiene una masa de\(4.0026 \: \text{amu}\). Un átomo de azufre 32 tiene una masa de\(31.972 \: \text{amu}\).
El átomo de carbono-12 tiene seis protones y seis neutrones en su núcleo para un número de masa de 12. Dado que el núcleo representa casi toda la masa del átomo, un solo protón o neutrón único tiene una masa de aproximadamente\(1 \: \text{amu}\). Sin embargo, como lo ven los ejemplos de helio y azufre, las masas de átomos individuales no son números enteros. Esto se debe a que la masa de un átomo se ve afectada muy ligeramente por las interacciones de las diversas partículas dentro del núcleo y también incluye la pequeña masa añadida por cada electrón.
Como se indica en la sección sobre isótopos, la mayoría de los elementos ocurren naturalmente como una mezcla de dos o más isótopos. A continuación se enumeran los isótopos naturales de varios elementos junto con el porcentaje de abundancia natural de cada uno.
| Element | Isótopo (Símbolo) | Porcentaje de Abundancia Natural | Masa atómica\(\left( \text{amu} \right)\) | Masa atómica promedio\(\left( \text{amu} \right)\) |
|---|---|---|---|---|
| Hidrógeno | \(\ce{^1_1H}\) | 99.985 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">1.0078 | \ (\ left (\ text {amu}\ right)\)” rowspan="3" style="vertical-align:middle; text-align:center; ">1.0079 |
| \(\ce{^2_1H}\) | 0.015 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">2.0141 | ||
| \(\ce{^3_1H}\) | insignificante | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">3.0160 | ||
| Carbono | \(\ce{^{12}_6C}\) | 98.89 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">12.000 | \ (\ left (\ text {amu}\ right)\)” rowspan="3" style="vertical-align:middle; text-align:center; ">12.011 |
| \(\ce{^{13}_6C}\) | 1.11 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">13.003 | ||
| \(\ce{^{14}_6C}\) | rastro | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">14.003 | ||
| Oxígeno | \(\ce{^{16}_8O}\) | 99.759 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">15.995 | \ (\ left (\ text {amu}\ right)\)” rowspan="3" style="vertical-align:middle; text-align:center; ">15.999 |
| \(\ce{^{17}_8O}\) | 0.037 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">16.995 | ||
| \(\ce{^{18}_8O}\) | 0.204 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">17.999 | ||
| Cloro | \(\ce{^{35}_{17}Cl}\) | 75.77 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">34.969 | \ (\ left (\ text {amu}\ right)\)” rowspan="2" style="vertical-align:middle; text-align:center; ">35.453 |
| \(\ce{^{37}_{17}Cl}\) | 24.23 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">36.966 | ||
| Cobre | \(\ce{^{63}_{29}Cu}\) | 69.17 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">62.930 | \ (\ left (\ text {amu}\ right)\)” rowspan="2" style="vertical-align:middle; text-align:center; ">63.546 |
| \(\ce{^{65}_{29}Cu}\) | 30.83 | \ (\ left (\ text {amu}\ right)\)” style="vertical-align:middle; text-align:center; ">64.928 |
Para algunos elementos, un isótopo en particular es mucho más abundante que cualquier otro isótopo. Por ejemplo, el hidrógeno natural es casi todo hidrógeno-1, y el oxígeno natural es casi todo oxígeno-16. Para muchos otros elementos, sin embargo, puede existir más de un isótopo en cantidades sustanciales. El cloro (número atómico 17) es gas tóxico de color verde amarillento. Alrededor de tres cuartas partes de todos los átomos de cloro tienen 18 neutrones, dando a esos átomos un número de masa de 35. Alrededor de una cuarta parte de todos los átomos de cloro tienen 20 neutrones, dando a esos átomos un número de masa de 37. Si simplemente calculara el promedio aritmético de las masas atómicas precisas, obtendría aproximadamente 36.
\[\frac{34.969 + 36.966}{2} = 35.968\]
Como puede ver, la masa atómica promedio dada en la última columna de la tabla anterior es significativamente menor. ¿Por qué? La razón es que necesitamos tomar en cuenta los porcentajes de abundancia natural de cada isótopo para poder calcular lo que se llama el promedio ponderado. La masa atómica de un elemento es el promedio ponderado de las masas atómicas de los isótopos naturales de ese elemento. Las masas atómicas promedio son los valores que vemos en la tabla periódica.
\[0.7577 \left( 34.969 \right) + 0.2423 \left( 36.966 \right) = 35.453\]
El promedio ponderado se determina multiplicando el porcentaje de abundancia natural por la masa real del isótopo. Esto se repite hasta que haya un término para cada isótopo. Para el cloro, solo hay dos isótopos naturales por lo que solo hay dos términos.
Recursos Suplementarios
- Elementos y Átomos: http://www.youtube.com/watch?v=IFKnq9QM6_A
- Introducción al Átomo: http://www.youtube.com/watch?v=1xSQIwWGT8M
- Historia atómica - Un breve descubrimiento: http://www.pbs.org/wgbh/nova/diamond...dehistory.html
- Todo sobre los átomos: http://education.jlab.org/atomtour/index.html
- Construir y Atom: http://phet.colorado.edu/en/simulation/build-an-atom
- Banco de Trabajo Molecular - Estructura Atómica: http://workbench.concord.org/databas...vities/47.html
- Ver Dentro de un Diamante: http://www.pbs.org/wgbh/nova/diamond/insidewave.html
- Isótopos y masa atómica: http://phet.colorado.edu/en/simulati...nd-atomic-mass
- Estructura atómica: freezeray.com/FlashFiles/AtomcStructure.htm
- Atom Builder: freezeray.com/FlashFiles/AtomBuilder.htm
- Isótopos de Pelota de Tenis: http://www.youtube.com/watch?v=oLnuXpf4hsA
- Juego Element Math: http://education.jlab.org/elementmath/index.html
- Crucigrama Átomos y Materia: http://education.jlab.org/sciencecro... /atoms_01.html
- Revisión del Número Atómico #1: www.ScienceGeek.net/Chemistry... micNumbers.htm
- Revisión del Número Atómico #2: www.ScienceGeek.net/Chemistry... t1Numbers2.htm
- Estructura Atómica: www.ScienceGeek.net/Chemistry... omicStructure/
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

