2.2: Materia
- Page ID
- 77575
Resultados de aprendizaje
- Definir materia.
- Clasificar las sustancias puras como elementos o compuestos.
- Clasificar las mezclas como homogéneas o heterogéneas.
- Conoce los nombres y símbolos de los elementos indicados en “Cosas para Memorizar” en Lienzo.
- Distinguir entre metales, no metales y metaloides.
Los seres vivos están hechos de materia. De hecho, la materia es la “materia” de la que están hechas todas las cosas (véase la figura a continuación. Cualquier cosa que ocupe espacio y tenga masa se conoce como materia. La materia, a su vez, consiste en sustancias químicas. La química es el estudio de la materia y los cambios que sufre.
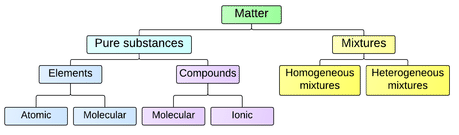
Sustancias Puras
Una sustancia pura es un material que tiene una composición química definida. También es homogéneo, por lo que la misma composición química se encuentra de manera uniforme en toda la sustancia. Una sustancia pura puede ser un elemento o un compuesto químico.
Elementos
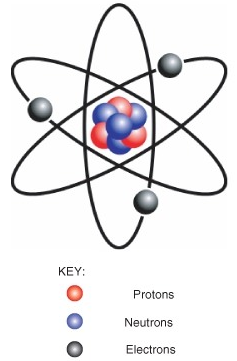
Un elemento es una sustancia pura que no se puede descomponer en diferentes tipos de sustancias. Ejemplos de elementos incluyen carbono, oxígeno, hidrógeno y hierro. Cada elemento está formado por un solo tipo de átomo. Un átomo es la partícula más pequeña de un elemento que aún caracteriza al elemento. Como se muestra en la siguiente figura, en el centro de un átomo se encuentra un núcleo. El núcleo contiene partículas cargadas positivamente llamadas protones y partículas eléctricamente neutras llamadas neutrones. Alrededor del núcleo hay una nube de electrones mucho más grande que consiste en electrones cargados negativamente. Un átomo es eléctricamente neutro si tiene el mismo número de protones que los electrones. Cada elemento tiene átomos con un número característico de protones. Por ejemplo, todos los átomos de carbono tienen seis protones, y todos los átomos de oxígeno tienen ocho protones.
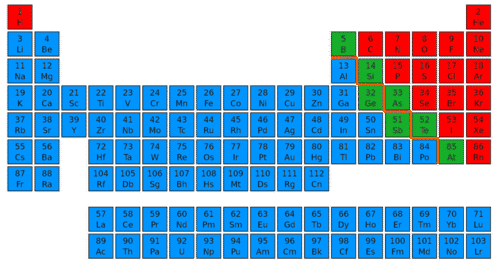
Hay casi 120 elementos conocidos (ver figura abajo) y cada uno está representado en la tabla periódica por un símbolo de una o dos letras. La mayoría de los elementos conocidos se clasifican como metales. Los metales son elementos que son lustrosos, o brillantes. También son buenos conductores de electricidad y calor. Ejemplos de metales incluyen hierro, oro y cobre. Menos de 20 elementos se clasifican como no metales. Los no metales carecen de las propiedades de los metales. Los ejemplos de no metales incluyen oxígeno, hidrógeno y azufre. Algunos otros elementos tienen propiedades tanto de metales como de no metales. Se les conoce como metaloides. Los ejemplos de metaloides incluyen silicio y boro.
La Nueva Canción de la Tabla Periódica se puede escuchar en https://youtu.be/zUDDiWtFtEM
Tom Lehrer interpretó la canción original de The Element Song en 1967. Se puede escuchar en https://youtu.be/DYW50F42ss8.
Compuestos Químicos
Un compuesto químico es una sustancia pura que se forma cuando los átomos de dos o más elementos reaccionan entre sí. Un compuesto siempre tiene una composición química única y fija y los átomos de un compuesto se mantienen unidos por enlaces químicos. Existen diferentes tipos de enlaces químicos, y varían en cuanto a la fuerza con la que mantienen unidos los átomos de un compuesto. Dos tipos de enlaces son los enlaces covalentes e iónicos. Los enlaces covalentes se forman cuando los átomos comparten electrones y ocurren entre dos o más no metales. Los enlaces iónicos se forman cuando los electrones se transfieren de un átomo a otro y generalmente se forman entre un metal y un no metal.
Un ejemplo de un compuesto químico es el agua. Una molécula de agua se forma cuando los\(\left( \ce{H} \right)\) átomos de oxígeno\(\left( \ce{O} \right)\) e hidrógeno reaccionan y se mantienen unidos por enlaces covalentes. Al igual que otros compuestos, el agua siempre tiene la misma composición química: una relación 2:1 de átomos de hidrógeno a átomos de oxígeno. Esto se expresa en la fórmula química para el agua,\(\ce{H_2O}\). La relación de elementos en un compuesto viene dada por la fórmula química. Por ejemplo,\(\ce{NaCl}\) tiene una relación 1:1 entre átomos de sodio y cloro. La ausencia de un número subcriptado dentro de la fórmula indica que existe uno de ese elemento.
Mezclas
Al igual que un compuesto químico, una mezcla consiste en más de una sustancia química. A diferencia de un compuesto, una mezcla no tiene una composición química fija. Las sustancias en una mezcla se pueden combinar en cualquier proporción. Una característica de las mezclas es que se pueden separar en sus componentes por métodos físicos. Dado que cada parte de la mezcla no ha reaccionado con otra parte de la mezcla, las identidades de las diferentes sustancias permanecen inalteradas.
Los siguientes ejemplos ilustran estas diferencias entre mezclas y compuestos. Ambos ejemplos involucran los mismos dos elementos: el hierro metálico\(\left( \ce{Fe} \right)\) y el azufre no metálico\(\left( \ce{S} \right)\).
- Cuando los rellenos de hierro y el polvo de azufre se mezclan en cualquier proporción, forman una mezcla (ver figura a continuación). No se produce ninguna reacción química, y ambos elementos conservan sus propiedades individuales. Se puede utilizar un imán para separar físicamente los dos elementos atrayendo los rellenos de hierro de la mezcla y dejando atrás el azufre.
- Cuando el hierro y el azufre se mezclan en cierta proporción y se calientan, se produce una reacción química. Esto da como resultado la formación de un nuevo compuesto único, llamado sulfuro de hierro (II)\(\left( \ce{FeS} \right)\) (ver figura a continuación). No se puede usar un imán para separar mecánicamente el hierro del sulfuro de hierro (II) porque ni el hierro ni el azufre existen en el compuesto. En cambio, se requiere otra reacción química para separar el hierro y el azufre.


Mezclas Homogéneas
Una mezcla homogénea es una mezcla en la que la composición es uniforme en toda la mezcla. Una mezcla de sal y agua es homogénea porque la sal disuelta se distribuye uniformemente por toda la muestra de agua salada. Muchas veces es fácil confundir una mezcla homogénea con una sustancia pura porque ambas son uniformes. La diferencia es que la composición de la sustancia es siempre la misma, mientras que la composición de una mezcla puede variar. La cantidad de sal en el agua salada puede variar de una muestra a otra, mientras que el agua, por ejemplo, siempre tiene la misma composición.
Mezclas heterogéneas
Una mezcla heterogénea es una mezcla en la que la composición no es uniforme en toda la mezcla. Un ejemplo de una mezcla heterogénea es la sopa de verduras. Cualquier cucharada dada de sopa contendrá cantidades variables de las diferentes verduras y otros componentes de la sopa. Otro ejemplo de una mezcla heterogénea es el suelo que está compuesto por una variedad de sustancias y a menudo tiene una composición diferente dependiendo de la muestra tomada. Una pala puede llegar con tierra y pasto mientras que la siguiente pala podría contener una lombriz de tierra.
Ver más ejemplos de mezclas heterogéneas en www.buzzle.com/articles/homog... -examples.html
Recursos Suplementarios
Aprende más
- David Bodanis, E = mc\(^2\): Una biografía de la pregunta más famosa del mundo. Walker y compañía, 2005
- John Emsley, Nature's Building Blocks: Una guía A-Z de los elementos. Oxford University Press, 2003.
- Nevin Katz, Elementos, Compuestos y Mezclas: Secundaria y Preparatoria (Mr. Birdley Enseña Ciencias). Publicaciones de Incentivos, 2007.
- La ciencia de la ensalada de macarrones: ¿qué hay en una mezcla? http://youtu.be/Vt7IN4QPU0k
- Mezclas heterogéneas antoine.frostburg.edu/chem/se... ogeneous.shtml
- Tarjetas Flash Element http://education.jlab.org/elementflashcards/
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

