2.4: Arreglos de electrones
- Page ID
- 77567
Resultados de aprendizaje
- Determinar los niveles de energía de los electrones para los primeros 20 elementos.
- Explicar la relevancia de los electrones de valencia en los procesos químicos.
- Identificar el número de electrones de valencia en un elemento.
- Describir la estabilidad de un átomo como resultado de seguir la regla del octeto.
La estructura del átomo se discutió en la unidad anterior y ahora nos centraremos en el papel que juegan los electrones en la formación de compuestos. Independientemente del tipo de compuesto o del número de átomos o electrones involucrados, son los electrones de esos átomos los que interactúan para formar un compuesto.
Arreglo de Electrones
Los electrones no están dispuestos aleatoriamente en un átomo y su posición dentro del átomo se puede describir usando disposiciones de electrones, que son una versión simplificada de las configuraciones de electrones. Para cada elemento de interés, observamos el número de electrones en un solo átomo y luego determinamos cómo se organizan esos electrones con base en el modelo atómico. La idea principal detrás de los arreglos de electrones es que los electrones solo pueden existir en ciertos niveles de energía. Al comprender los niveles de energía de los electrones en un átomo, podemos predecir propiedades y entender el comportamiento del átomo.
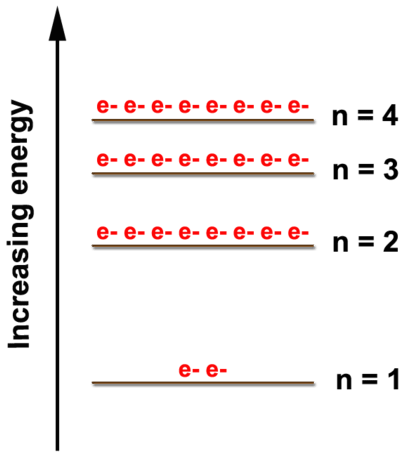
Como se muestra en la siguiente figura, existen múltiples niveles de energía donde se pueden encontrar electrones. A medida que aumenta el nivel de energía, la diferencia de energía entre ellos disminuye. Se puede encontrar un máximo de dos electrones en el\(n=1\) nivel; ocho electrones pueden estar en el\(n=2\) nivel. Aunque los\(n=4\) niveles\(n=3\) y muestran solo ocho electrones en este diagrama, esos niveles de energía pueden contener más pero no hasta que empecemos a mirar los metales de transición. Sólo nos ocuparemos de las disposiciones de electrones de los elementos a través del calcio\(\left( Z = 20 \right)\) por lo que pondremos un máximo de ocho electrones en el\(n=3\) nivel y dos en el\(n=4\) nivel.
Ejemplo\(\PageIndex{1}\)
¿Cuál es la disposición electrónica del oxígeno?
Solución
El oxígeno tiene ocho electrones. Los dos primeros electrones irán en el\(n=1\) nivel. Dos es el número máximo de electrones para el nivel por lo que los otros electrones tendrán que ir en un nivel de energía superior. El\(n=2\) nivel puede contener hasta ocho electrones por lo que los seis electrones restantes irán en el\(n=2\) nivel. La disposición electrónica del oxígeno es (2, 6).
Ejemplo\(\PageIndex{2}\)
¿Cuál es la disposición electrónica del cloro?
Solución
El cloro tiene 17 electrones. Los dos primeros electrones irán en el\(n=1\) nivel. Dos es el número máximo de electrones para el nivel por lo que los otros electrones tendrán que ir en niveles de energía más altos. El\(n=2\) nivel puede contener hasta ocho electrones por lo que los siguientes 8 electrones irán en el\(n=2\) nivel. Los 7 electrones restantes pueden ir en el\(n=3\) nivel ya que contiene un máximo de 8 electrones. La disposición electrónica del cloro es (2, 8, 7).
La disposición de electrones también proporciona información sobre el número de electrones de valencia. Los electrones de valencia son los electrones en el nivel de energía más alto y los involucrados en la formación de iones y enlaces. Conocer el número de electrones de valencia nos permitirá predecir cómo interactuará un elemento en particular con otros elementos. Los electrones en niveles de energía más bajos se denominan electrones centrales.
Veamos la siguiente figura en la que se muestra el diagrama de electrones para el magnesio y sus 12 electrones. Los dos primeros electrones se encuentran en el nivel de\(n=1\) energía, los siguientes ocho electrones se encuentran en el\(n=2\) nivel, y los dos electrones restantes se encuentran en el\(n=3\) nivel. Los electrones siempre llenan los niveles de energía más bajos disponibles hasta que ese nivel se llena, luego los electrones llenan el siguiente nivel de energía hasta que se llena. Esto continúa para todos los electrones en un átomo. Podemos mostrar la disposición de electrones como (2, 8, 2) representando los electrones en los\(n=3\) niveles\(n=1\)\(n=2\), y, respectivamente.
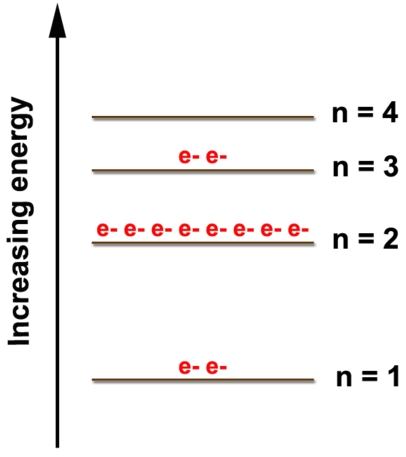
La disposición electrónica también muestra el número de electrones de valencia que es dos para el magnesio porque hay dos electrones en el nivel de\(n=3\) energía que es el nivel de energía ocupado más alto para el magnesio. Esto corresponde a la\(2+\) carga que se forma cuando el magnesio forma un ion. Está dispuesto a perder 2 electrones para que tenga las mismas disposiciones de electrones que el gas noble más cercano, que es el neón (2, 8). Los átomos ganarán o perderán electrones para parecerse al gas noble más cercano porque los gases nobles no son reactivos debido a la estabilidad de tener ocho electrones en el nivel de energía más alto. Este deseo de átomos de tener ocho electrones en su caparazón más exterior se conoce como la regla del octeto.
Ejemplo\(\PageIndex{3}\)
¿Cuál es la disposición electrónica del aluminio? ¿Cuántos electrones de valencia tiene?
Solución
El aluminio tiene 13 electrones por lo que tendrá la disposición de electrones (2, 8, 3) que representa dos electrones en el nivel de\(n=1\) energía, ocho electrones en el\(n=2\) nivel y tres electrones en el\(n=3\) nivel. El aluminio tiene tres electrones de valencia (indicados por los tres electrones en el\(n=3\) nivel).
Ejemplo\(\PageIndex{4}\)
¿Cuántos electrones de valencia tiene el cloro? ¿Cuántos electrones ganará o perderá el cloro para formar un ion?
Solución
El cloro tiene 7 electrones en su caparazón de valencia. Para cumplir con la regla del octeto, debe ganar un electrón o perder siete electrones. Ganar uno es más fácil que perder siete por lo que ganará un electrón para tener un total de ocho electrones cuando forme un ion (es decir, una partícula cargada).
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

