2.3: Masa molar y molar
- Page ID
- 77597
Resultados de aprendizaje
- Definir mole.
- Determinar la relación de elementos en un compuesto a partir de una fórmula.
- Determinar la masa molar de un elemento y compuesto.
- Convertir entre masa, moles y número de partículas de una sustancia.

Cuando vas a la panadería y pides una docena de donas, tanto tú como el panadero saben que eso significa 12. Docena es un número de conteo que se define como 12. Hay otros números de conteo como par (2), resma (500), bruto (144) y puntaje (20). El último fue famoso por Abraham Lincoln en el discurso de Gettysburg cuando dijo “Cuatro anotaciones y hace siete años”. Todas estas palabras definen un número específico de cosas independientemente de lo que sea que estemos contando. Un topo es también un número de conteo.
Número de Avogadro
Ciertamente es fácil contar plátanos o contar elefantes (siempre y cuando te mantengas fuera de su camino). Sin embargo, estarías contando granos de azúcar de tu bote de azúcar durante mucho tiempo. mucho tiempo. Los átomos y las moléculas son extremadamente pequeños, mucho más pequeños que los granos de azúcar. Contar átomos y moléculas no sólo es imprudente, es absolutamente imposible. Una gota de agua contiene aproximadamente\(10^{22}\) moléculas de agua. Si contaras 10 moléculas cada segundo durante 50 años sin parar habrías contado solo\(1.6 \times 10^{10}\) moléculas. Dicho de otra manera, a esa tasa de conteo, te tomaría más de 30 billones de años contar las moléculas de agua en una pequeña gota.
Los químicos necesitaban un nombre que pudiera representar una gran cantidad de artículos. Amedeo Avogadro (1776 - 1856), un científico italiano, proporcionó precisamente ese número. Él es el responsable de la unidad de medida de conteo llamada el topo. Un mol (abreviado como\(\text{mol}\)) es la cantidad de una sustancia que contiene partículas\(6.02 \times 10^{23}\) representativas de esa sustancia. El mol es la unidad SI por cantidad de una sustancia. Al igual que docena o bruto, es un nombre que significa un número. Hay\(6.02 \times 10^{23}\) átomos en un mol de carbono. Hay moléculas de\(6.02 \times 10^{23}\) agua en un mol de moléculas de agua. También habría\(6.02 \times 10^{23}\) plátanos en un mole de plátanos, si alguna vez existiera una cantidad tan grande de plátanos.

Al número\(6.02 \times 10^{23}\) se le llama número de Avogadro, el número de partículas representativas en un mol. Es un número determinado experimentalmente. Una partícula representativa es la unidad más pequeña en la que existe una sustancia de forma natural. Para la mayoría de los elementos, la partícula representativa es el átomo. El hierro, el carbono y el helio consisten en átomos de hierro, átomos de carbono y átomos de helio, respectivamente. Siete elementos existen en la naturaleza como moléculas diatómicas y los son\(\ce{H_2}\)\(\ce{N_2}\),\(\ce{O_2}\),\(\ce{F_2}\),\(\ce{Cl_2}\),\(\ce{Br_2}\), y\(\ce{I_2}\). La partícula representativa para estos elementos es la molécula. Así mismo, todos los compuestos moleculares tales como\(\ce{H_2O}\) y\(\ce{CO_2}\) existen como moléculas y así la molécula es su partícula representativa. Para compuestos iónicos tales como\(\ce{NaCl}\) y\(\ce{Ca(NO_3)_2}\), la partícula representativa es la unidad de fórmula. Un mol de cualquier sustancia contiene el número de partículas representativas\(\left( 6.02 \times 10^{23} \right)\) de Avogadro.

Conversiones entre moles y número de partículas
Usando nuestras técnicas de conversión de unidades, podemos usar la etiqueta molar para convertir de un lado a otro entre el número de partículas y moles.
Ejemplo\(\PageIndex{1}\)
El elemento carbono existe en dos formas primarias: grafito y diamante. ¿Cuántos moles de átomos de carbono son los\(4.72 \times 10^{24}\) átomos de carbono?
Solución
En este problema, se nos da el número de átomos y se nos pide proporcionar el número de moles. Necesitamos determinar qué factor usaremos para convertir de átomos a moles. El número de Avogadro nos da la relación que necesitamos,\(1 \: \text{mol} = 6.02 \times 10^{23}\) átomos.
\[4.72 \times 10^{24} \: \text{atoms} \: \ce{C} \times \frac{1 \: \text{mol} \: \ce{C}}{6.02 \times 10^{23} \: \text{atoms} \: \ce{C}} = 7.84 \: \text{mol} \: \text{C}\]
Observe que los átomos están en la parte inferior del factor de conversión porque necesitamos átomos para cancelar así que nos quedan con moles de carbono. Nuestra verificación final es para asegurarnos de que nuestra respuesta sea razonable. Observe que tenemos\(10^{24}\) átomos de carbono por lo que es razonable que el valor sea mayor a 1 mol.
Supongamos que quisieras saber cuántos átomos de hidrógeno había en un mol de moléculas de agua. Primero, necesitarías conocer la fórmula química para el agua, que es\(\ce{H_2O}\). Con base en el subíndice de hidrógeno, hay dos átomos de hidrógeno en cada molécula de agua. ¿Cuántos átomos de hidrógeno habría en dos moléculas de agua? (ver figura abajo) Habría átomos de\(2 \times 2 = 4\) hidrógeno. ¿Qué tal en una docena? En ese caso una docena es de 12 por lo que los átomos de\(12 \times 2 = 24\) hidrógeno en una docena de moléculas de agua. Para obtener las respuestas (4 y 24), había que multiplicar el número dado de moléculas por dos átomos de hidrógeno por molécula. Entonces, para encontrar el número de átomos de hidrógeno en un mol de moléculas de agua, el problema podría resolverse de manera similar.
\[1 \: \text{mol} \: \ce{H_2O} \times \frac{6.02 \times 10^{23} \: \text{molecules} \: \ce{H_2O}}{1 \: \text{mol} \: \ce{H_2O}} \times \frac{2 \: \text{atoms} \: \ce{H}}{1 \: \text{molecule} \: \ce{H_2O}} = 1.20 \times 10^{24} \: \text{atoms} \: \ce{H}\]
El primer factor de conversión convierte de moles de partículas al número de partículas. El segundo factor de conversión refleja el número de átomos contenidos dentro de cada molécula.
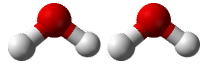
Dos moléculas de agua contienen 4 átomos de hidrógeno y 2 átomos de oxígeno. Un mol de moléculas de agua contiene 2 moles de átomos de hidrógeno y 1 mol de átomos de oxígeno.
Ejemplo\(\PageIndex{2}\)
El ácido sulfúrico tiene la fórmula química\(\ce{H_2SO_4}\). Una cierta cantidad de ácido sulfúrico contiene\(4.89 \times 10^{25}\) átomos de oxígeno. ¿Cuántos moles de ácido sulfúrico hay en la muestra?
Solución
En este problema, se da el número de átomos de oxígeno. Sin embargo, el número de moléculas de no\(\ce{H_2SO_4}\) es igual al número de átomos. Por lo tanto, se necesitará un paso adicional para resolver el problema.
Podemos escribir dos relaciones que ayudarán a resolver este problema.
- \(1 \: \text{mol} = 6.02 \times 10^{23} \: \text{molecules}\)
- \(1 \: \text{molecule} \: \ce{H_2SO_4} = 4 \: \ce{O} \: \ce{atoms}\)
Si bien 1 mol siempre será igual\(6.02 \times 10^{23}\), la segunda relación variará dependiendo de la identidad del compuesto y del elemento. Para\(\ce{H_2SO_4}\), también podríamos escribir esa 1 molécula de\(\ce{H_2SO_4} = \) 2 átomos\(\ce{H}\) o 1 molécula\(\ce{H_2SO_4} =\) 1 átomo\(\ce{S}\). Ambos son ciertos, pero simplemente no son útiles para este problema.
\[4.89 \times 10^{25} \: \text{atoms} \: \ce{O} \times \frac{1 \: \text{molecule} \: \ce{H_2SO_4}}{4 \: \text{atoms} \: \ce{O}} \times \frac{1 \: \text{mol} \: \ce{H_2SO_4}}{6.02 \times 10^{23} \: \text{molecules} \: \ce{H_2SO_4}} = 20.3 \: \text{mol} \: \ce{H_2SO_4}\]
Tenga en cuenta que\(\ce{O}\)\(\ce{H_2SO_4}\) tanto átomos como moléculas cancelan y nos quedan unidades de\(\text{mol} \: \ce{H_2SO_4}\).
Una forma alternativa de configurar este problema es usar la relación\(1 \: \text{mol} \: \ce{H_2SO_4} = 4 \: \text{mol} \: \ce{O} \: \text{atoms}\). Dado que un mol es solo un número de conteo, simplemente estamos multiplicando ambos valores (1 molécula y 1 átomo) por el número de Avogadro para conseguir una relación en términos de moles. En este ejemplo, convertimos de átomos a moles de\(\ce{O}\), luego convertimos de moles de\(\ce{O}\) a moles de\(\ce{H_2SO_4}\).
\[4.89 \times 10^{25} \: \text{atoms} \: \ce{O} \times \frac{1 \: \text{mol} \: \ce{O}}{6.02 \times 10^{23} \: \text{atoms} \: \ce{O}} \times \frac{1 \: \text{mol} \: \ce{H_2SO_4}}{4 \: \text{mol} \: \ce{O}} = 20.3 \: \text{mol} \: \ce{H_2SO_4}\]
Ambos métodos son correctos y te darán la misma respuesta. Usa el método que tenga más sentido para ti.
Masa molar
La masa molar se define como la masa (en gramos) de un mol de partículas representativas de una sustancia. Al observar una tabla periódica, podemos concluir que la masa molar del litio es\(6.94 \: \text{g}\), la masa molar del zinc es\(65.38 \: \text{g}\), y la masa molar del oro lo es\(196.97 \: \text{g}\). Cada una de estas cantidades contiene\(6.02 \times 10^{23}\) átomos de ese elemento en particular. Las unidades para masa molar son gramos por mol o\(\text{g/mol}\). Observe que estos son los mismos números que la masa atómica pero con diferentes unidades. Por ejemplo 1 átomo de litio tiene una masa de\(6.94 \: \text{amu}\) mientras que 1 mol\(\left( 6.02 \times 10^{23} \: \text{atoms} \right)\) tiene una masa de\(6.94 \: \text{g}\). Podemos usar esta relación para determinar los moles de un elemento a partir de su masa o viceversa.
Ejemplo\(\PageIndex{3}\)
¿Cuántos moles de carbono hay en una\(29.3 \: \text{g}\) muestra?
Solución
Se nos da la masa de la muestra y se busca la masa molar de carbono en la tabla periódica que es\(12.01 \: \text{g/mol}\). Ahora, podemos configurar el cálculo para resolver los lunares.
\[29.3 \: \text{g} \: \ce{C} \times \frac{1 \: \text{mol} \: \ce{C}}{12.01 \: \text{g} \: \ce{C}} = 2.44 \: \text{mol} \: \ce{C}\]
Tenga en cuenta que los gramos cancelarán y nos quedaremos con unidades de moles de carbono para nuestra respuesta que es lo que se está pidiendo en este problema. Dado que la masa de la muestra de carbono es mayor que la masa molar, es razonable que tengamos más de un mol del carbono.
Ejemplo\(\PageIndex{4}\)
¿Cuál es la masa de aluminio en una\(1.95 \: \text{mol}\) muestra?
Solución
Al igual que en el ejemplo anterior, necesitaremos la masa molar para resolver el problema. Para el aluminio, la masa molar es\(27.0 \: \text{g/mol}\). Ahora, podemos configurar el cálculo para resolver por masa.
\[1.95 \: \text{mol} \: \ce{Al} \times \frac{27.0 \: \text{g} \: \ce{Al}}{1 \: \text{mol} \: \ce{Al}} = 52.7 \: \text{g} \: \ce{Al}\]
En este ejemplo, colocamos gras en la parte superior y lunares en la parte inferior para que las unidades cancelaran correctamente. Tenga en cuenta que\(\text{mol} \: \ce{Al}\) cancelará y nos quedamos con unidades de gramos de aluminio que es lo que se está pidiendo en el problema. La respuesta parece razonable porque tenemos casi dos moles de aluminio y la masa es casi el doble de la masa molar.
Masas Molares de Compuestos
La fórmula molecular del compuesto dióxido de carbono es\(\ce{CO_2}\). Una molécula de dióxido de carbono consiste en 1 átomo de carbono y 2 átomos de oxígeno. Podemos calcular la masa de una molécula de dióxido de carbono sumando las masas de 1 átomo de carbono y 2 átomos de oxígeno.
\[12.01 \: \text{amu} + 2 \left( 16.00 \: \text{amu} \right) = 44.01 \: \text{amu}\]
La masa molecular de un compuesto es la masa de una molécula de ese compuesto. La masa molecular del dióxido de carbono es\(44.01 \: \text{amu}\).
La masa molar de cualquier compuesto es la masa en gramos de un mol de ese compuesto. Un mol de moléculas de dióxido de carbono tiene una masa de\(44.01 \: \text{g}\). La masa molar es\(44.01 \: \text{g/mol}\) para\(\ce{CO_2}\). Para el agua, la masa molar es\(18.02 \: \text{g/mol}\). En ambos casos, es la masa de\(6.02 \times 10^{23}\) moléculas.
Ejemplo\(\PageIndex{5}\)
El nitrato de calcio\(\ce{Ca(NO_3)_2}\),, se utiliza como componente en fertilizantes. Determinar la masa molar del nitrato de calcio.
Solución
La masa molar de un compuesto se encuentra a partir de las masas molares de los elementos en el compuesto.
- \(\ce{Ca} = 40.08 \: \text{g/mol}\)
- \(\ce{N} = 14.01 \: \text{g/mol}\)
- \(\ce{O} = 16.00 \: \text{g/mol}\)
Primero tenemos que analizar la fórmula. Al\(\ce{Ca}\) carecer de un subíndice, hay un\(\ce{Ca}\) átomo por unidad de fórmula. El 2 fuera de los paréntesis significa que hay dos iones nitrato por unidad de fórmula y cada ion nitrato consiste en un átomo de nitrógeno y tres átomos de oxígeno. Por lo tanto, hay un total de átomos de\(1 \times 2 = 2\) nitrógeno y átomos de\(3 \times 2 = 6\) oxígeno por unidad de fórmula. Así,\(1 \: \text{mol}\) de nitrato de calcio contiene\(1 \: \text{mol}\) de\(\ce{Ca}\) átomos,\(2 \: \text{mol}\) de\(\ce{N}\) átomos, y\(6 \: \text{mol}\) de\(\ce{O}\) átomos.
Usa las masas molares de cada átomo junto con el número de átomos en la fórmula y sumar.
\[\begin{align} &1 \: \text{mol} \: \ce{Ca} \times \frac{40.08 \: \text{g} \: \ce{Ca}}{1 \: \text{mol} \: \ce{Ca}} = 40.08 \: \text{g} \: \ce{Ca} \\ &2 \: \text{mol} \: \ce{N} \times \frac{14.01 \: \text{g} \: \ce{N}}{1 \: \text{mol} \: \ce{N}} = 28.02 \: \text{g} \: \ce{N} \\ &6 \: \text{mol} \: \ce{O} \times \frac{16.00 \: \text{g} \: \ce{O}}{1 \: \text{mol} \: \ce{O}} = 96.00 \: \text{g} \: \ce{O} \\ &\text{molar mass of} \ce{Ca(NO_3)_2} = 40.08 \: \text{g} + 28.02 \: \text{g} + 96.00 \: \text{g} = 164.10 \: \text{g/mol} \end{align}\]
Conversiones entre moles y masa
Al igual que convertimos entre moles y masa de un elemento, también podemos convertir entre moles y masa de un compuesto usando la masa molar del compuesto. Esta relación se utiliza frecuentemente en el laboratorio. Supongamos que para cierto experimento se necesitan 3.00 moles de cloruro de calcio\(\left( \ce{CaCl_2} \right)\). Dado que el cloruro de calcio es un sólido, sería conveniente utilizar una balanza para medir la masa que se necesita. La masa molar de\(\ce{CaCl_2}\) es\(110.98 \: \text{g/mol}\). La relación que se puede utilizar se basa entonces en la igualdad que\(1 \: \text{mol} = 110.98 \: \text{g} \: \ce{CaCl_2}\). El análisis dimensional te permitirá calcular la masa de la\(\ce{CaCl_2}\) que debes medir.
\[3.00 \: \text{mol} \: \ce{CaCl_2} \times \frac{110.98 \: \text{g} \: \ce{CaCl_2}}{1 \: \text{mol} \: \ce{CaCl_2}} = 333 \: \text{g} \: \ce{CaCl_2}\]
Al medir la masa de\(333 \: \text{g}\) de\(\ce{CaCl_2}\), estás midiendo 3.00 moles de\(\ce{CaCl_2}\).

El cloruro de calcio se utiliza como agente de secado y como deshielo de carreteras.
Ejemplo\(\PageIndex{6}\)
Una cierta reacción produce\(2.81 \: \text{g}\) de hidróxido de cobre (II),\(\ce{Cu(OH)_2}\). Determinar el número de moles producidos en la reacción.
Solución
Se conoce la masa de la sustancia y podemos determinar los moles usando la masa molar del compuesto,\(\ce{Cu(OH)_2}\). Primero tenemos que encontrar la masa molar de\(\ce{Cu(OH)_2}\) usar las masas molares de los elementos.
\[\text{molar mass} \: \ce{Cu(OH)_2} = 63.55 \: \text{g/mol} + 2 \left( 16.00 \: \text{g/mol} \right) + 2 \left( 1.008 \: \text{g/mol} \right) = 97.57 \: \text{g/mol}\]
Ahora, podemos usar la masa molar para convertir de gramos a moles.
\[2.81 \: \text{g} \: \ce{Cu(OH)_2} \times \frac{1 \: \text{mol} \: \ce{Cu(OH)_2}}{97.57 \: \text{g} \: \ce{Cu(OH)_2}} = 0.0288 \: \text{mol} \: \ce{Cu(OH)_2}\]
Se cancelarán las unidades de gramos y nos quedamos con unidades de moles que es lo que se solicita en la pregunta.
Ejemplo\(\PageIndex{7}\)
¿Cuál es la masa de agua en una\(3.50 \: \text{mol}\) muestra?
Solución
En este ejemplo, se conocen los moles de agua y necesitamos encontrar la masa. Nuevamente, utilizaremos la masa molar que previamente se dio como\(18.02 \: \text{g/mol}\).
\[3.50 \: \text{mol} \: \ce{H_2O} \times \frac{18.02 \: \text{g} \: \ce{H_2O}}{1 \: \text{mol} \: \ce{H_2O}} = 63.1 \: \text{g} \: \ce{H_2O}\]
Las unidades de\(\text{mol} \: \ce{H_2O}\) cancelarán y nos quedamos con unidades de gramos que es lo que se está solicitando en la pregunta.
Recursos Suplementarios
- Problemas de Masa Molar: http://misterguch.brinkster.net/molarmass.html
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

