2.6: Compuestos iónicos
- Page ID
- 77587
Resultados de aprendizaje
- Describir los tipos de elementos que forman un enlace iónico.
- Explicar cómo se forma un enlace iónico.
- Predecir la fórmula de un compuesto iónico.
La química se puede dividir ampliamente en clases principales de estopa en función de la identidad de los elementos presentes en los compuestos químicos. La química orgánica es la rama de la química que se ocupa de los compuestos que contienen carbono. En esta sección y en la siguiente, estaremos discutiendo la química inorgánica, que es la rama de la química que trata de compuestos que no contienen carbono. Los compuestos iónicos son ejemplos de compuestos inorgánicos.
Tipos de Fórmulas
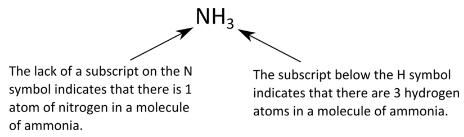
Recordemos que una molécula incluye dos o más átomos que se han combinado químicamente. Una fórmula química que indica cuántos de cada tipo de átomo están presentes en una sola molécula se denomina fórmula molecular. Por ejemplo, una molécula de amoníaco contiene un átomo de nitrógeno y tres átomos de hidrógeno, por lo que tiene la siguiente fórmula molecular.
Otro tipo de fórmula química, la fórmula empírica, muestra los elementos en un compuesto en su menor relación de número entero. La glucosa es un azúcar simple importante que las células utilizan como fuente primaria de energía. Su fórmula molecular es\(\ce{C_6H_{12}O_6}\). Dado que cada uno de los subíndices es divisible por 6, la fórmula empírica para la glucosa es\(\ce{CH_2O}\). Cuando los químicos analizan un compuesto desconocido, a menudo el primer paso es determinar su fórmula empírica. Hay muchos compuestos cuyas fórmulas moleculares y empíricas son las mismas. Si la fórmula molecular no puede simplificarse en una relación de número entero menor, como en el caso de\(\ce{H_2O}\) o\(\ce{P_2O_5}\), entonces la fórmula empírica es también la fórmula molecular.
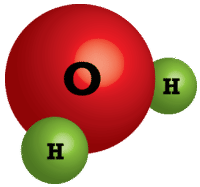
A diferencia de los compuestos moleculares, los compuestos iónicos son bastante diferentes. El agua y otras moléculas existen como colecciones de moléculas individuales (ver figura a continuación) mientras que los compuestos iónicos no existen como unidades moleculares discretas. En cambio, un compuesto iónico consiste en una gran matriz tridimensional de cationes y aniones alternantes. Por ejemplo, el cloruro de sodio\(\left( \ce{NaCl} \right)\) está compuesto por muchos\(\ce{Na^+}\) e\(\ce{Cl^-}\) iones dispuestos en una estructura como la que se muestra en la foto (ver figura a continuación). La fórmula para compuestos iónicos es siempre una fórmula empírica porque muestra la menor relación de número entero entre los cationes y aniones. El número real de iones en una muestra de un compuesto iónico será muy grande y variará de una muestra a otra.

La forma más sencilla de describir esta estructura con una fórmula química es dar la menor relación de número entero entre los dos iones. En el caso de\(\ce{NaCl}\), hay igual número de iones sodio e iones cloruro en el cristal de sal. En contraste, un cristal de cloruro de magnesio tiene el doble de iones cloruro que iones magnesio, por lo que tiene una fórmula de\(\ce{MgCl_2}\).
Escribir fórmulas para compuestos iónicos binarios
Si conoces los elementos que forman un compuesto iónico binario, puedes escribir su fórmula. Comience escribiendo el ion metálico y su carga, seguido del ion no metálico con su carga. Debido a que el compuesto general debe ser eléctricamente neutro, decida cuántos iones de cada tipo se necesitan para que las cargas positivas y negativas se cancelen entre sí. Considera el compuesto nitruro de aluminio. Las cargas en cada uno de estos iones se pueden determinar observando los grupos en los que se encuentran aluminio y nitrógeno en la tabla periódica. Los iones son:
\[\ce{Al^{3+}} \: \: \: \: \: \: \: \: \: \: \ce{N^{3-}}\]
Dado que los iones tienen cargas que son iguales en magnitud (3, pero diferentes signos), 1:1 es la relación más baja de iones que producirán un compuesto neutro. Dado que la carga sobre el aluminio es 3+ y la carga sobre nitrógeno es\(3-\), la suma de sus cargas es cero (\(+3\;+\; -3=0\)). Como resultado, la fórmula del nitruro de aluminio es\(\ce{AlN}\). Otro compuesto, el óxido de litio, contiene los siguientes iones:
\[\ce{Li^+} \: \: \: \: \: \: \: \: \: \: \ce{O^{2-}}\]
En este caso, se requieren dos iones litio, cada uno con una carga 1+, para equilibrar la carga de cada ion óxido, que tiene una\(2-\) carga. La fórmula del óxido de litio se\(\ce{Li_2O}\) debe a que el compuesto debe ser neutro. Por lo tanto,\(\left( 2\times+1\right) \;+\left( 1\times -2\right)=0\).
Para los compuestos en los que la relación de iones no es tan obvia, una forma alternativa de determinar la fórmula correcta es usar el método de “entrecruzamiento”. En este método, el valor numérico de cada carga se cruza para convertirse en el subíndice del ion opuesto. Se retiran las señales de los cargos. El método de entrecruzamiento se demuestra a continuación para el óxido de aluminio.
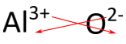
Las flechas rojas indican que el 3 de la\(3+\) carga cruzará para convertirse en el subíndice para\(\ce{O}\), mientras que el 2 de la\(2-\) carga cruzará para convertirse en el subíndice para\(\ce{Al}\). La fórmula para el óxido de aluminio es\(\ce{Al_2O_3}\).
Para el óxido de aluminio, el método entrecruzado produce directamente la fórmula correcta, pero en algunos casos, se requiere otro paso. Debido a que los compuestos iónicos siempre se describen por sus fórmulas empíricas, deben escribirse como la relación de número entero más baja de los iones. En el caso del nitruro de aluminio, el método entrecruzado produciría una fórmula de\(\ce{Al_3N_3}\), que no es correcta. Se debe realizar un segundo paso en el que se reduzcan los subíndices pero la relación se mantenga igual. \(\ce{Al_3N_3}\)se puede reducir a\(\ce{AlN}\), porque ambas fórmulas describen una relación 1:1 de iones de aluminio a iones nitruro. Seguir el método entrecruzado para escribir la fórmula para el óxido de plomo (IV) implicaría los siguientes pasos:
Algunos metales de transición pueden tener más de una carga posible. Cuando esto sucede, la carga sobre el catión de metal de transición se incluye entre paréntesis en el nombre. Por ejemplo, el óxido de plomo (IV) tiene\(\ce{Pb^{4+}}\) como catión metálico.
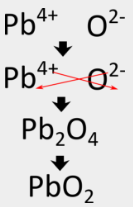
El método entrecruzado rinde primero\(\ce{Pb_2O_4}\) para la fórmula, pero eso debe reducirse a\(\ce{PbO_2}\), que es la fórmula correcta.
Fórmulas de escritura para compuestos iónicos que contienen iones poliatómicos
Escribir una fórmula para un compuesto iónico con iones poliatómicos implica los mismos pasos que para un compuesto iónico binario (de dos elementos). Escribe el símbolo y carga del catión seguido del símbolo y carga del anión. Utilice el método entrecruzado para asegurarse de que la fórmula final sea neutra. El nitrato de calcio está compuesto por cationes de calcio y aniones nitrato.

La carga se equilibra por la presencia de dos iones nitrato y un ion calcio. Se utilizan paréntesis alrededor del ion nitrato porque se necesita más de un ion poliatómico. Si solo un ion poliatómico está presente en una fórmula, no se utilizan paréntesis. Por ejemplo, la fórmula para el carbonato de calcio es\(\ce{CaCO_3}\). El ion carbonato lleva una\(2-\) carga, por lo que equilibra exactamente la\(2+\) carga del ion calcio y no se necesitan paréntesis alrededor del ion poliatómico.
Ejemplo\(\PageIndex{1}\)
Escriba la fórmula para el fosfato de zinc que se compone de\(Zn^{2+}\) e\(PO_4^{3-}\) iones.
Solución
Escribe el catión metálico seguido del anión no metálico. Entrecruzar las cargas de iones para hacer que el compuesto iónico sea neutro. Use paréntesis alrededor del ion poliatómico si hay más de uno presente en la fórmula final. Reducir a la relación más baja si es necesario.
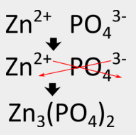
La fórmula para el fosfato de zinc es\(\ce{Zn_3(PO_4)_2}\). Tres cationes de zinc con\(2+\) cargas equilibran dos aniones fosfato con\(3-\) cargas.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

