4.4: Grupos funcionales
- Page ID
- 77372
Resultados de aprendizaje
- Describir la importancia y propósito de los grupos funcionales en reacciones orgánicas.
- Identificar y nombrar grupos funcionales en compuestos.
Con más de veinte millones de compuestos orgánicos conocidos en existencia, sería muy difícil memorizar reacciones químicas para cada uno. Afortunadamente, las moléculas con grupos funcionales similares tienden a sufrir reacciones similares. Un grupo funcional se define como un átomo o grupo de átomos dentro de una molécula que tiene propiedades químicas similares cada vez que aparece en diversos compuestos. Incluso si otras partes de la molécula son bastante diferentes, ciertos grupos funcionales tienden a reaccionar de ciertas maneras.
Ya hemos mirado los alcanos, pero generalmente no son reactivos. Utilizamos principalmente los alcanos como fuente de energía cuando se queman. Si bien la mayoría de los grupos funcionales involucran átomos distintos del carbono y el hidrógeno, también veremos algunos que incluyen solo carbono e hidrógeno. Algunos de los grupos funcionales más comunes se presentan en las siguientes secciones.
Las moléculas orgánicas varían mucho en tamaño y al enfocarnos en grupos funcionales, queremos dirigir nuestra atención hacia los átomos involucrados en el grupo funcional. Como resultado, en algunos ejemplos se utiliza la abreviatura R. La letra R se utiliza en estructuras moleculares para representar el “R est de la molécula”. Consiste en un grupo de átomos de carbono e hidrógeno de cualquier tamaño. Se utiliza como abreviatura ya que un grupo de átomos de carbono e hidrógeno no afecta la funcionalidad del compuesto. En algunas moléculas, verá R, R' o R” lo que indica que los grupos R en la molécula pueden ser diferentes entre sí. Por ejemplo, R podría ser —CH 2 CH 3 mientras que R' es —CH 2 CH 2 CH 2 CH 3.
Alquenos y Alquinos
Los alquenos son hidrocarburos que contienen uno o más dobles enlaces entre átomos de carbono vecinos. Los alquinos contienen uno o más enlaces triples entre los átomos de carbono vecinos. La presencia de un doble o triple enlace da como resultado una reactividad no presente en alcanos y los alquinos (ver figura a continuación) experimentan reacciones características que se cubrirán posteriormente.

Aromaticos
El grupo funcional adicional que contiene solo carbono e hidrógeno es un anillo aromático que es un anillo de seis carbonos con dobles enlaces alternativos. El anillo aromático también se muestra como un anillo con un círculo en el medio que representa los dobles enlaces. Los anillos aromáticos (ver figura abajo) se encuentran en muchos compuestos incluyendo esteroides y medicamentos.
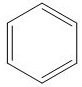
Alcoholes
El grupo funcional alcohol involucra un átomo de oxígeno que está unido a un átomo de hidrógeno y un átomo de carbono. El átomo de carbono formará parte de una estructura orgánica más grande. Una forma de indicar un alcohol genérico sería con la fórmula\(\ce{R-OH}\). \(\ce{R}\)representa cualquier fragmento orgánico en el que un átomo de carbono está unido directamente al grupo funcional explícitamente indicado (en este caso,\(\ce{OH}\)). El\(\ce{R}\) grupo es típicamente una cadena de átomos de carbono.
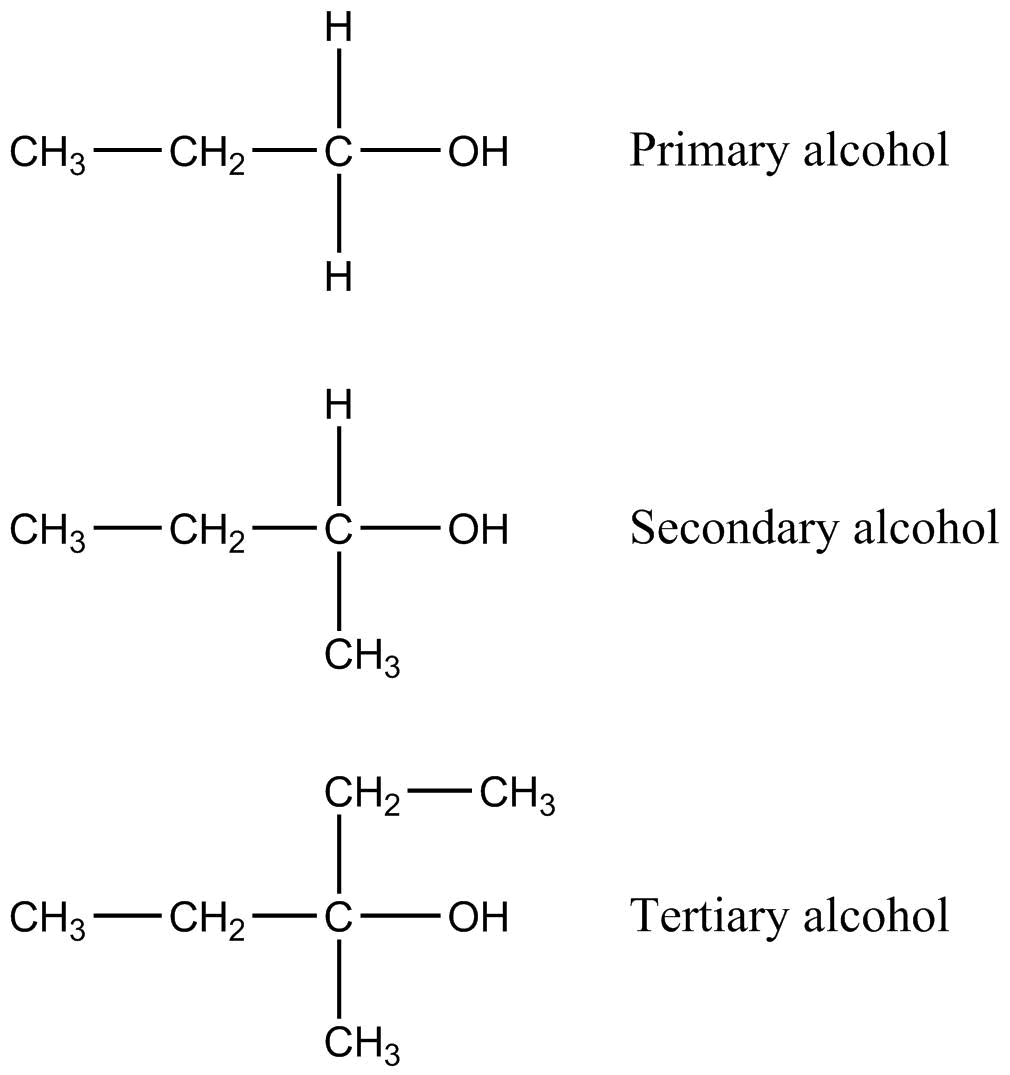
Los alcoholes pueden clasificarse como primarios, secundarios o terciarios en función de las características del carbono al que están unidos. En un alcohol primario, el carbono unido directamente al átomo de oxígeno también está unido a exactamente un átomo de carbono, con los otros enlaces generalmente yendo a átomos de hidrógeno. En un alcohol secundario, el carbono está unido a otros dos átomos de carbono, y en un alcohol terciario, el carbono está unido a otros tres átomos de carbono. El tipo de alcohol que se utilice determinará el producto de ciertas reacciones. Obsérvese el nombre de los alcoholes como se ilustra en la figura anterior. La ubicación del\(\ce{-OH}\) grupo se indica con el número del carbono al que está unido.
Ya estamos familiarizados con varios alcoholes comunes. Por ejemplo, el etanol\(\left( \ce{CH_3CH_2OH} \right)\) es el alcohol presente en las bebidas alcohólicas. También es ampliamente utilizado en la fabricación industrial de otros productos químicos. \(\left( \ce{CH_3OH} \right)\)El metanol se utiliza como aditivo de gasolina o alternativa. Adicionalmente, se puede usar metanol para fabricar formaldehído, el cual se emplea en la producción de plásticos, pinturas y otras sustancias útiles. El isopropanol se conoce comúnmente como alcohol para frotar. Además de sus usos industriales, el isopropanol se utiliza para limpiar diversas superficies, incluyendo monitores de computadora, pizarras blancas e incluso piel (por ejemplo, antes de extraerse sangre).
Éteres
El grupo funcional éter consiste en un átomo de oxígeno que forma enlaces sencillos con dos átomos de carbono.
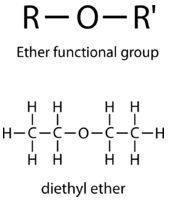
Los éteres son buenos solventes para otros compuestos orgánicos debido a su baja reactividad. Ellos disuelven fácilmente las moléculas no polares. El éter dietílico es quizás el éter más conocido. Es ampliamente utilizado como solvente y se ha utilizado como anestésico inhalable.
Aunque los propios éteres son relativamente poco reactivos, pueden convertirse en peróxidos después de una exposición prolongada al oxígeno. Los peróxidos son muy reactivos y suelen ser explosivos a temperaturas elevadas. Muchos éteres disponibles comercialmente vienen con una pequeña cantidad de un eliminador de peróxido disuelto en ellos para ayudar a prevenir este tipo de peligro para la seguridad.
Tiol
El grupo funcional tiol contiene un átomo de azufre unido a un átomo de hidrógeno. Es muy similar a un grupo funcional alcohol con el azufre reemplazando al O.
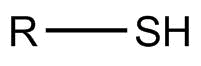
Los tioles también se llaman mercaptanos que se deriva de la frase latina para “capturar mercurio” debido a los fuertes enlaces que forma con los compuestos que contienen mercurio. Algunos compuestos de tiol tienen un olor distintivo similar a los huevos podridos. A menudo se agregan al gas natural, que por sí mismo no tiene olor, como una forma de detectar fugas ya que su olor puede ser detectado por los humanos en cantidades muy pequeñas. Un grupo tiol también está presente en el aminoácido cisteína que se discutirá más adelante.
Aminas
Una amina consiste en un átomo de nitrógeno unido a alguna combinación de carbonos e hidrógenos.
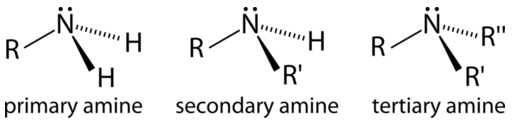
Al igual que los alcoholes, las aminas pueden clasificarse como primarias, secundarias o terciarias. No obstante, las reglas para asignar estas categorías son ligeramente diferentes. En un alcohol, el átomo de oxígeno siempre está unido a exactamente un átomo de carbono, así que observamos la ramificación en el carbono adyacente, no el átomo de oxígeno en sí. En una amina neutra, el nitrógeno puede unirse a uno, dos o tres átomos de carbono, y así es como decidimos si se llama amina primaria, secundaria o terciaria.
Las aminas neutras son bases débiles, porque el par solitario sobre nitrógeno puede actuar como aceptor de protones. Muchas aminas más pequeñas tienen olores muy fuertes y ofensivos. Por ejemplo, los compuestos denominados acertadamente cadaverina y putrescina son aminas malolientes, formadas como parte del proceso de descomposición después de la muerte.
Las aminas sirven para una amplia variedad de usos. La difenilamina actúa como estabilizador para ciertos tipos de explosivos. Las aminas se encuentran como componentes en algunos materiales lubricantes, en desarrolladores, y son parte de los textiles impermeabilizantes. Algunas aminas, como la novocaína, se utilizan como anestésicos. Muchos compuestos farmacéuticos contienen aminas, incluyendo 8 de los 10 medicamentos más recetados en 2012.
Aldehídos
Un componente estructural muy común de las estructuras orgánicas es el carbonilo, que es simplemente un átomo de carbono y un átomo de oxígeno conectados por un doble enlace. La reactividad de los carbonilos viene dictada principalmente por la polarización del\(\ce{C=O}\) enlace, pero los átomos circundantes también juegan un papel en sus vías de reacción específicas. Si bien el carbonilo es un componente de muchos grupos funcionales, no es en sí mismo un grupo funcional.
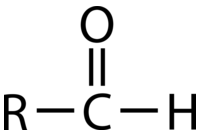
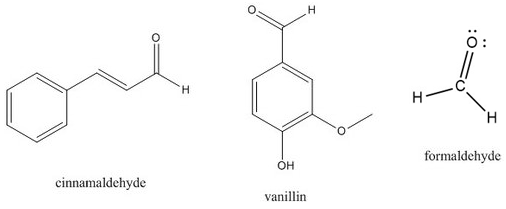
Un aldehído es un carbonilo en el que el átomo de carbono está unido a al menos un átomo de hidrógeno. El otro grupo unido al carbonilo puede ser un\(\ce{R}\) grupo -o un átomo de hidrógeno. Debido a que el átomo de hidrógeno es tan pequeño, la carga positiva parcial en el carbono carbonilo es muy fácil de acercarse para otras moléculas, haciendo de los aldehídos un tipo de carbonilo particularmente reactivo. Los aldehídos son reactivos versátiles para una amplia variedad de síntesis orgánicas. Muchos aldehídos también tienen sabores y aromas distintivos. Por ejemplo, el sabor de la canela se debe principalmente a la molécula cinamaldehído, y la vainillina es el aldehído más responsable del olor y sabor del extracto de vainilla.
Un aldehído especial es la molécula en la que el carbonilo está unido a dos átomos de hidrógeno. Esta molécula, llamada formaldehído, tiene una amplia variedad de usos. Por sí mismo, se puede utilizar como conservante de tejidos o como desinfectante muy duro. También se utiliza como precursor de diversos materiales, incluyendo plásticos, resinas y otros polímeros.
Cetonas
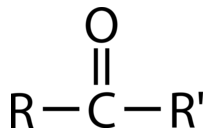
Una cetona implica un carbonilo en el que el átomo de carbono hace enlaces sencillos con dos\(\ce{R}\) grupos. Las cetonas experimentan la mayoría de las mismas reacciones que los aldehídos, pero tienden a ser ligeramente menos reactivas. La cetona más simple es la acetona, en la que el carbono carbonílico está unido a dos\(\ce{CH_3}\) grupos. Esta cetona se usa comúnmente para eliminar el esmalte de uñas y sirve como disolvente industrial. La metil etil cetona se utiliza como decapante de pintura y disolvente. Las cetonas también se utilizan en la producción de diversos polímeros, ya sea como bloque de construcción o como disolvente. El\(\ce{R}\) grupo -en una cetona puede ser igual o diferente como se ve en el ejemplo.
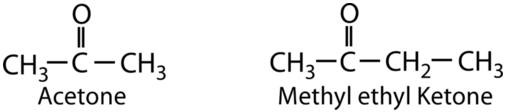
Ácidos Carboxílicos
Los ácidos carboxílicos son otro grupo funcional que contiene carbonilo, en el que el átomo de carbono está unido a un\(\ce{OH}\) grupo en un lado y ya sea un átomo de carbono o hidrógeno en el otro.
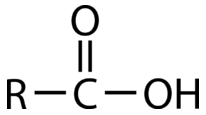
Como su nombre lo indica, los ácidos carboxílicos son ácidos débiles. Un\(\ce{OH}\) grupo que está conectado directamente a un carbonilo se ionizará en pequeña medida cuando se disuelva en agua. La razón de esto es la estabilidad relativa del anión resultante. Un ion carboxilato (ver figura abajo), en el que la carga negativa se extiende sobre dos átomos de oxígeno diferentes a través de estructuras de resonancia, es más estable que un anión aislado centrado en oxígeno. El ácido carboxílico y el ion carboxilato son intercambiables. Los iones carboxilato a menudo están presentes en los aminoácidos.
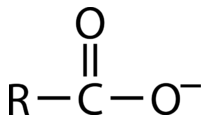
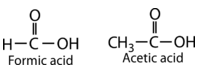
Los ácidos carboxílicos se utilizan en una variedad de ambientes. El ácido fórmico actúa como un químico protector para muchos insectos y plantas que pican. El ácido acético le da al vinagre su olor y sabor característicos y es un componente fundamental biológico e industrial. Los ácidos carboxílicos con cadenas carbonadas más largas (ácidos grasos) son utilizados por los animales como una forma de almacenar energía y son ampliamente utilizados en la fabricación de jabones. Algunos compuestos contienen múltiples ácidos carboxílicos dentro de una sola molécula. Por ejemplo, el ácido cítrico (tres grupos carboxilo) es especialmente abundante en los cítricos y se utiliza como saborizante y conservante en muchos alimentos y bebidas.
Ésteres
Un éster es similar a un ácido carboxílico, en que contiene un carbonilo donde el carbono está unido a un átomo de oxígeno adicional y un átomo de carbono o hidrógeno. Sin embargo, el segundo átomo de oxígeno está unido a otro carbono en lugar de a un átomo de hidrógeno ácido. Estructuralmente, los ácidos y ésteres carboxílicos están relacionados entre sí de la misma manera que los alcoholes y éteres.
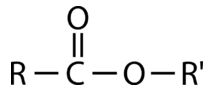
Los ésteres se pueden formar calentando ácidos carboxílicos y alcoholes en presencia de un catalizador ácido. Este proceso es reversible, y los materiales de partida pueden regenerarse haciendo reaccionar un éster con agua en presencia de una base débil.
Algunos ésteres tienen olores muy agradables, por lo que se utilizan en la fabricación de muchos perfumes. El acetato de propilo contribuye al olor de las peras, mientras que el acetato de isoamilo le da a los plátanos su olor. Este éster también sirve como señal de alarma para las abejas melíferas. Los ésteres se emplean en la fabricación de telas (poliésteres) y Plexiglás. Los anestésicos como la procaína y la benzocaína también contienen ésteres.
Amidas
Una amida es un carbonilo en el que el carbono está unido a un átomo de nitrógeno y a un átomo de carbono o hidrógeno. Alternativamente, podríamos definir una amida como una amina en la que uno de los átomos de carbono unidos al nitrógeno es parte de un carbonilo.
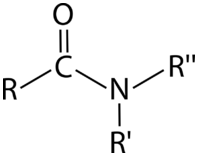
Se puede formar una amida combinando un ácido carboxílico y una amina. Solo las aminas primarias y secundarias pueden ser demandadas para formar amidas, ya que tienen un hidrógeno que puede ser reemplazado por el carbono carbonílico; las aminas terciarias no formarán amidas. La amida mostrada en la figura anterior se formó a partir de un ácido carboxílico y una amina primaria.
Las amidas se utilizan como agentes colorantes en crayones, lápices y tintas. Se emplean en las industrias del papel, plástico y caucho. La poliacrilamida es una amida muy utilizada; está involucrada en el tratamiento de agua potable y aguas residuales, y en la fabricación de plásticos. La amida Kevlar es ampliamente empleada para la producción de blindaje corporal, y el nylon es otro tipo de polímero a base de amida.
Haloalcanos
Los haloalcanos, también conocidos como haluros de alquilo, son un grupo de compuestos químicos compuestos por un alcano con uno o más hidrógenos reemplazados por un átomo de halógeno (átomo del Grupo 17). Existe una distinción bastante grande entre las propiedades estructurales y físicas de los haloalcanos y las propiedades estructurales y físicas de los alcanos. A
Los haloalcanos se encuentran en extintores, refrigerantes, propulsores, solventes y medicamentos. También son una fuente importante de contaminación y su uso se ha reducido o eliminado en algunos productos. Los clorofluorocarbonos (CFC) se utilizaron como refrigerantes en los aires acondicionados, pero se encontró que eran una causa importante del agotamiento de la capa de ozono. La investigación y el desarrollo de alternativas se iniciaron en la década de 1970. Los hidroclorofluorocarbonos (HCFC) se han utilizado desde hace muchos años ya que causan menos daños a la capa de ozono, pero muchos países acordaron eliminar los HCFC para 2020.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

