4.3: Geometría del grupo de electrones
- Page ID
- 77380
Resultados de aprendizaje
- Explicar las bases de la teoría VSEPR.
- Predecir las formas de las moléculas usando la teoría VSEPR.
- Predecir ángulos de enlace en una molécula.
- Dar cuenta de las variaciones en los ángulos de enlace en las fuerzas repulsivas relativas ejercidas por pares solitarios y pares de unión de electrones.
La geometría del grupo de electrones es la disposición tridimensional de los átomos en una molécula. La geometría de una molécula es un factor importante que afecta las propiedades físicas y químicas de un compuesto. Esas propiedades incluyen puntos de fusión y ebullición, solubilidad, densidad y los tipos de reacciones químicas que experimenta un compuesto. En esta sección, aprenderás una técnica para predecir la geometría de una molécula basada en una estructura de puntos de electrones de Lewis.
Teoría VSEPR
La capa de valencia es la capa más externa ocupada de electrones en un átomo. Esta capa contiene los electrones de valencia, que son los electrones que están involucrados en la unión y que se muestran en una estructura de Lewis. La teoría de repulsión de pares de electrones de valencia-concha, o teoría VSEPR, establece que una molécula ajustará su forma para que los pares de electrones de valencia permanezcan lo más alejados posible entre sí. Esto tiene sentido, basado en el hecho de que los electrones cargados negativamente se repelen entre sí. Clasificaremos sistemáticamente las moléculas de acuerdo con el número de pares de unión de electrones y el número de pares no enlazantes o solitarios alrededor del átomo central. Para los efectos del modelo VSEPR, un doble o triple enlace no es diferente en términos de repulsión que un enlace sencillo. Comenzaremos examinando moléculas en las que el átomo central no tiene pares solitarios.
Átomo Central sin Pares Solitarios
Para entender fácilmente los tipos de moléculas posibles, utilizaremos un sistema sencillo para identificar las partes de cualquier molécula.
\(\ce{A} =\)átomo central en una molécula
\(\ce{B} =\)átomos que rodean el átomo central
Los subíndices después del\(\ce{B}\) denotarán el número de\(\ce{B}\) átomos que están unidos al\(\ce{A}\) átomo central. Por ejemplo,\(\ce{AB_4}\) es una molécula con un átomo central rodeado por cuatro átomos unidos covalentemente. Nuevamente, no importa si esos bonos son simples, dobles o triples.
\(\ce{AB_2}\)
\(\left( \ce{BeH_2} \right)\)El hidruro de berilio consiste en un átomo central de berilio con dos enlaces simples a átomos de hidrógeno. Obsérvese que viola la regla del octeto, porque el átomo central tiene sólo 4 electrones de valencia. Esto es aceptable porque el berilio solo tiene dos electrones de valencia para empezar, por lo que no es posible que cree más de dos enlaces covalentes con átomos de hidrógeno.
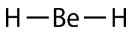
De acuerdo con el requisito de que los pares de electrones maximicen su distancia entre sí, los dos pares de enlace en las\(\ce{BeH_2}\) moléculas se dispondrán en lados directamente opuestos del\(\ce{Be}\) átomo central. La geometría resultante es una molécula lineal, mostrada en un modelo de “bola y palo” en la siguiente figura.
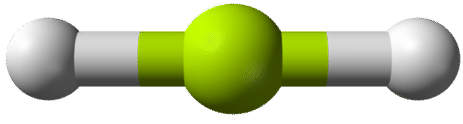
El ángulo de\(\ce{H-Be-H}\) unión se\(180^\text{o}\) debe a su geometría lineal.
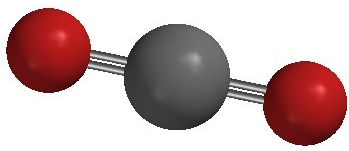
El dióxido de carbono es otro ejemplo de una molécula que cae dentro de la\(\ce{AB_2}\) categoría. Su estructura de Lewis consiste en dobles enlaces entre el átomo de carbono central y cada átomo de oxígeno.
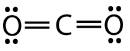
La repulsión entre los dos dobles enlaces a cada lado del átomo de carbono no es diferente a la repulsión entre los dos enlaces simples a cada lado del berilio en el ejemplo anterior. Por lo tanto, el dióxido de carbono también es lineal, ya que esto logra la distancia máxima entre los enlaces del par de electrones.
\(\ce{AB_3}\)
El trifluoruro de boro\(\left( \ce{BF_3} \right)\) consiste en un átomo central de boro con tres enlaces simples a los átomos de flúor. El átomo de boro es una excepción a la regla del octeto, y generalmente solo necesita 6 electrones para ser estable en una molécula unida.
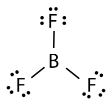
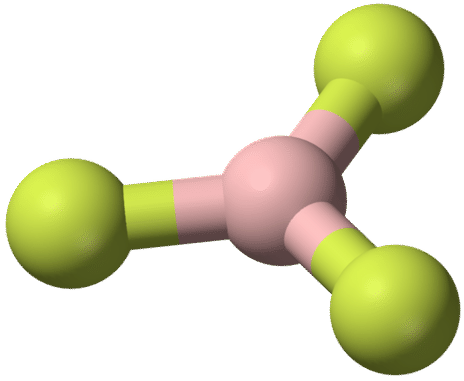
La geometría de la\(\ce{BF_3}\) molécula se llama plano trigonal. Los átomos de flúor están posicionados en los vértices de un triángulo equilátero. El\(\ce{F-B-F}\) ángulo es\(120^\text{o}\), y los cuatro átomos se encuentran en el mismo plano.
\(\ce{AB_4}\)
\(\left( \ce{CH_4} \right)\)El metano es un compuesto orgánico que es el componente principal del gas natural. Su estructura consiste en un átomo de carbono central con cuatro enlaces simples a átomos de hidrógeno.
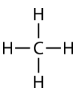
Para maximizar su distancia entre sí, los cuatro grupos de electrones de unión no se encuentran en el mismo plano. En cambio, cada uno de los átomos de hidrógeno se encuentra en las esquinas de una forma geométrica llamada tetraedro. El átomo de carbono está en el centro del tetraedro. Cada cara de un tetraedro es un triángulo equilátero.

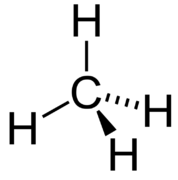
La geometría del grupo electrónico de la molécula de metano se conoce como tetraédrica. Los ángulos de\(\ce{H-C-H}\) enlace son\(109.5^\text{o}\), que es mayor\(90^\text{o}\) que el que serían si la molécula fuera plana. De esta manera, los enlaces están lo más separados posible para minimizar la repulsión de electrones. Al dibujar una fórmula estructural para una molécula como el metano, es ventajoso poder indicar el carácter tridimensional de su forma. La fórmula estructural en la siguiente figura se denomina dibujo en perspectiva. El enlace de línea punteada debe visualizarse como volviendo a la página, mientras que el enlace de triángulo sólido debe visualizarse como saliendo de la página.
Hay estructuras con cinco y seis enlaces que no vamos a explorar porque no se ven en moléculas biológicas.
| Átomos alrededor del átomo central | Geometría del grupo de electrones | Ejemplo |
|---|---|---|
| 2\(\ce{AB_2}\) | Lineal | \(\ce{BeCl_2}\) |
| 3\(\ce{AB_3}\) | Plano Trigonal | \(\ce{BF_3}\) |
| 4\(\ce{AB_4}\) | Tetraédrico | \(\ce{CH_4}\) |
Átomo central con uno o más pares solitarios
El número de enlaces al átomo central más el número de pares solitarios en el átomo central nos da lo que se llama la geometría del grupo de electrones. Las geometrías de grupos de electrones se refieren a las cinco geometrías: lineal, plana trigonal, tetraédrica, bipiramidal trigonal u octaédrica. Si uno o más de los pares de unión de electrones se reemplazan por un par solitario, la geometría de los electrones no cambia sino que se altera la forma de la molécula. Comprender el impacto de los pares solitarios de electrones será importante a la hora de observar las propiedades de los compuestos que se ven afectados por la polaridad de una molécula. Nos centraremos en la geometría del grupo electrónico tetraédrico ya que es más relevante para las moléculas orgánicas y biológicas. \(\ce{E}\)representa un par de electrones sin unión.
\(\ce{AB_3E}\)
La molécula de amoníaco contiene tres enlaces simples y un par solitario en el átomo de nitrógeno central.
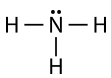
La geometría del grupo de electrones para una molécula con cuatro pares de electrones es tetraédrica, como se vio con\(\ce{CH_4}\). En la molécula de amoníaco, uno de los pares de electrones es un par solitario en lugar de un par de enlace. Aunque el par solitario no es visible, afectará la ubicación y los ángulos de enlace entre otros átomos en la molécula.
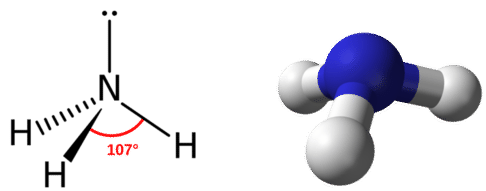
Recordemos que los ángulos de enlace en la\(\ce{CH_4}\) molécula tetraédrica son todos iguales a\(109.5^\text{o}\). Uno podría esperar que los ángulos de\(\ce{H-N-H}\) enlace en el amoníaco\(109.5^\text{o}\) también lo sean, pero es necesario hacer pequeños ajustes para la presencia de pares solitarios. Dentro del contexto del modelo VSEPR, se considera que los pares solitarios de electrones son ligeramente más repulsivos que los pares de electrones enlazantes, debido a su proximidad más cercana al átomo central. Es decir, los pares solitarios “ocupan más espacio”. Por lo tanto el\(\ce{H-N-H}\) ángulo es ligeramente menor que\(109.5^\text{o}\). Su valor real es aproximadamente\(107^\text{o}\).
\(\ce{AB_2E_2}\)
Una molécula de agua consiste en dos pares de unión y dos pares solitarios de electrones.
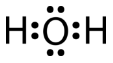
La molécula de agua, al igual que las moléculas de amoníaco y metano, tiene una geometría de grupo electrónico tetraédrico. En la molécula de agua, dos de los pares de electrones son pares solitarios en lugar de pares de unión. El ángulo de\(\ce{H-O-H}\) unión es\(104.5^\text{o}\), que es menor que el ángulo de unión en\(\ce{NH_3}\).
| Átomos más pares solitarios alrededor del átomo central | Número de átomos circundantes | Número de Pares Solitarios | Geometría del grupo de electrones | Ejemplo |
|---|---|---|---|---|
| 3\(\ce{AB_2E}\) | 2 | 1 | Plano Trigonal | \(\ce{O_3}\) |
| 4\(\ce{AB_3E}\) | 3 | 1 | Tetraédrico | \(\ce{NH_3}\) |
| 4\(\ce{AB_2E_2}\) | 2 | 2 | Tetraédrico | \(\ce{H_2O}\) |
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

