5.1: Isómeros
- Page ID
- 77316
Resultados de aprendizaje
- Definir isómero.
- Determinar la relación isomérica entre un par de moléculas.
- Identificar los centros quirales en una molécula.
- Describir diferentes tipos de isómeros.
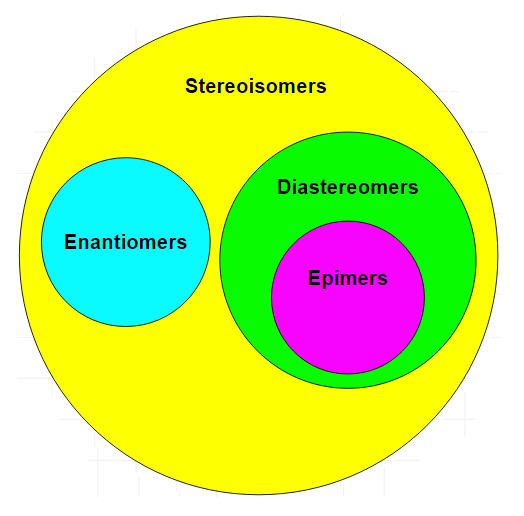
Uno de los aspectos interesantes de la química orgánica es que es tridimensional. Una molécula puede tener una forma en el espacio que puede contribuir a sus propiedades. Las moléculas pueden diferir en la forma en que están dispuestos los átomos; la misma combinación de átomos se puede ensamblar de más de una manera. Estos compuestos se conocen como isómeros. Los isómeros son moléculas con las mismas fórmulas moleculares, pero diferentes disposiciones de átomos. Hay varios tipos diferentes de isómeros que se describirán y un diagrama de flujo (vea la figura a continuación) puede ayudarle a determinar qué tipo de isómeros están presentes.
Isómeros conformacionales
Los isómeros conformacionales, también conocidos como confórmeros, difieren entre sí por su rotación alrededor de un enlace sencillo. Las rotaciones ocurren libremente alrededor de enlaces individuales carbono-carbono. A diferencia de los dobles y triples enlaces, que están “bloqueados” en su orientación, los bonos simples no tienen tales restricciones.
Isómeros estructurales
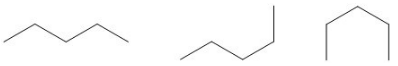
Un isómero estructural, también conocido como isómero constitucional, es aquel en el que dos o más compuestos orgánicos tienen las mismas fórmulas moleculares pero diferentes estructuras. Las dos moléculas siguientes tienen la misma fórmula química, pero son moléculas diferentes porque difieren en la ubicación del grupo metilo.
Los alquenos también pueden demostrar isomería estructural. En los alquenos, existen múltiples isómeros estructurales basados en dónde en la cadena se produce el doble enlace. Las fórmulas estructurales condensadas de 1-buteno y 2-buteno lo muestran.

El número en el nombre del alqueno se refiere al carbono numerado más bajo en la cadena que forma parte del doble enlace.
Estereoisómeros
Los estereoisómeros tienen la misma conectividad en sus átomos pero una disposición diferente en el espacio tridimensional. Existen diferentes clasificaciones de estereoisómeros dependiendo de cómo los arreglos difieran entre sí. Observe que en los isómeros estructurales, hubo alguna diferencia en la conexión de los átomos. Por ejemplo, el 1-buteno tiene un doble enlace seguido de dos enlaces simples mientras que el 2-buteno tiene un enlace sencillo, luego un doble enlace, luego un enlace sencillo. Un estereoisómero tendrá la misma conectividad entre todos los átomos de la molécula.
Isómeros geométricos
Con una molécula como el 2-buteno, se puede observar un tipo diferente de isomería llamado isomería geométrica. Los isómeros geométricos son isómeros en los que el orden de enlace de los átomos es el mismo pero la disposición de los átomos en el espacio es diferente. El doble enlace en un alqueno no es libre de rotar debido a la naturaleza del enlace. Por lo tanto, hay dos formas diferentes de construir la molécula de 2-buteno (ver figura a continuación). La siguiente imagen muestra los dos isómeros geométricos, llamados cis -2-buteno y trans -2-buteno.
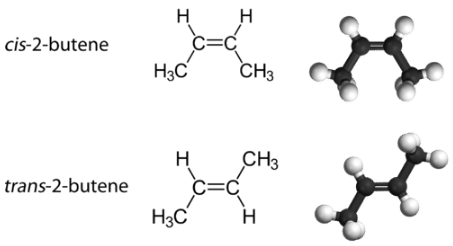
El isómero cis tiene los dos átomos de hidrógeno individuales en el mismo lado de la molécula, mientras que el isómero trans los tiene en lados opuestos de la molécula. En ambas moléculas, el orden de unión de los átomos es el mismo. Para que los isómeros geométricos existan, debe haber una estructura rígida en la molécula para evitar la libre rotación alrededor de un enlace. Esto ocurre con un doble enlace o un anillo. Además, los dos átomos de carbono deben tener cada uno dos grupos diferentes unidos para que haya isómeros geométricos. El propeno (ver figura abajo) no tiene isómeros geométricos porque uno de los átomos de carbono (el del extremo izquierdo) involucrados en el doble enlace tiene dos hidrógenos simples unidos a él.
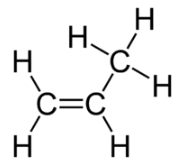
Las propiedades físicas y químicas de los isómeros geométricos son generalmente diferentes. Al igual que con los alquenos, los alquinos muestran isomería estructural comenzando con 1-butino y 2-butino. Sin embargo, no hay isómeros geométricos con alquinos porque solo hay otro grupo unido a los átomos de carbono que están involucrados en el triple enlace.
Isómeros ópticos
Los estereoisómeros que no son isómeros geométricos se conocen como isómeros ópticos. Los isómeros ópticos difieren en la colocación de grupos sustituidos alrededor de uno o más átomos de la molécula. Se les dio su nombre debido a sus interacciones con la luz polarizada en el plano. Los isómeros ópticos son enantiómeros o diastereómeros marcados.
Los enantiómeros son imágenes especulares no superpuestas. Un ejemplo común de un par de enantiómeros son tus manos. Tus manos son imágenes especulares unas de otras pero no importa cómo gires, tuerzas o gires tus manos, no son superpuestas.

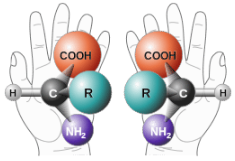
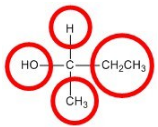
Los objetos que tienen imágenes especulares no superpuestas se denominan quirales. Al examinar una molécula, los átomos de carbono con cuatro grupos únicos unidos se consideran quirales. Mira la figura a continuación para ver un ejemplo de una molécula quiral. Obsérvese que tenemos que mirar más allá del primer átomo unido al átomo de carbono central. Los cuatro círculos indican los cuatro grupos únicos unidos al átomo de carbono central, que es quiral.
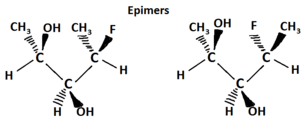
Otro tipo de isómero óptico son los diastereómeros, que son isómeros ópticos de imagen no especular. Los diastereómeros tienen una disposición diferente alrededor de uno o más átomos, mientras que algunos de los átomos tienen la misma disposición. Como se muestra en la siguiente figura, nótese que la orientación de los grupos en el primer y tercer carbonos son diferentes pero el segundo sigue siendo el mismo por lo que no son la misma molécula. La cuña sólida indica un grupo que sale de la página/pantalla hacia usted y la línea discontinua indica que un grupo se va alejando de usted “detrás” de la página/pantalla.
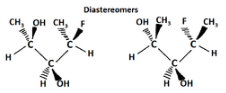
Los epímeros son un subgrupo de diastereómeros que difieren en una sola ubicación. Todos los epímeros son diastereómeros pero no todos los diastereómeros son epímeros.
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

