5.5: Propiedades de los Compuestos (Ejercicios)
- Page ID
- 77331
Se trata de ejercicios de tarea para acompañar al Capítulo 5 del LibreTexto de la Universidad de Kentucky para CHE 103 - Química para la Salud Aliada. Las soluciones están disponibles debajo de las preguntas.
Preguntas
(haga clic aquí para obtener soluciones)
Q5.1.1
Definir isómero.
Q5.1.2
Circula los carbonos quirales en cada estructura.
| a. |  |
| b. |  |
| c. |  |
| d. |  |
| e. |  |
| f. |  |
| g. |  |
| h. |  |
| i. |  |
| j. |  |
Q5.1.3
Determinar si cada molécula puede tener un isómero geométrico.
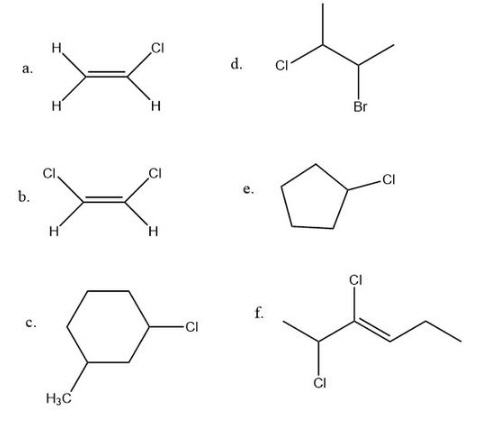
Q5.1.4
Para cada par, determinar si son isómeros. Si son isómeros, identificar el tipo.
| a. | 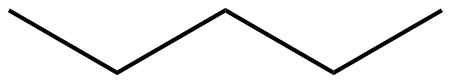 |
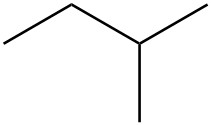 |
| b. | 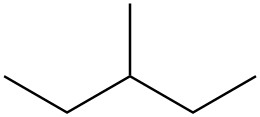 |
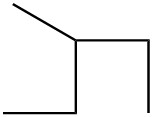 |
| c. | 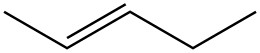 |
 |
| d. |  |
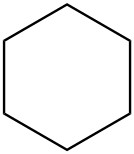 |
| e. | 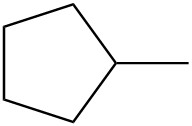 |
 |
| f. | 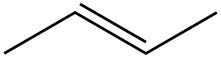 |
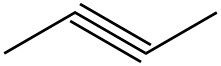 |
| g. | 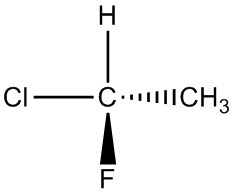 |
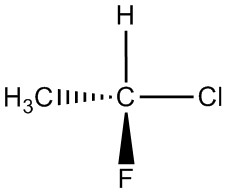 |
| h. | 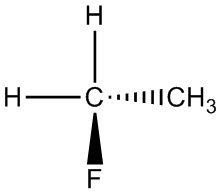 |
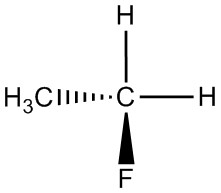 |
Q5.1.5
Dibujar dos isómeros con la fórmula C 2 H 6 O
(haga clic aquí para obtener soluciones)
Q5.2.1
Un monosacárido tiene 4 átomos de carbono. ¿Cuál es su fórmula química?
Q5.2.2
¿Cuáles son las diferencias entre monosacáridos, disacáridos, oligosacáridos y polisacáridos?
Q5.2.3
Compara y contrasta carbohidratos simples y complejos.
Q5.2.4
Dibuja cada una de las siguientes estructuras.
- aldoheptosa
- cetopentosa
- aldotriosa
- ketotetrose
Q5.2.5
Dibujar las proyecciones Fischer de dos aldohexosas que son diferentes de las cuatro dadas en la Figura 5.2.3.
Q5.2.6
Dibujar los enantiómeros de D-glucosa, D-alosa, D-manosa y D-galactosa. (Ver Figura 5.2.3).
Q5.2.7
Determinar si cada uno de los siguientes pares son diastereómeros? ¿Epimeros? (Busque las estructuras en el capítulo o en línea.)
- D-glucosa y D-alosa
- D-glucosa y D-galactosa
- D-alosa y D-manosa
- D-alosa y D-galactosa
Q5.2.8
Para cada una de las estructuras de Haworth dadas, identificar el azúcar como en forma α o β.
| a. | 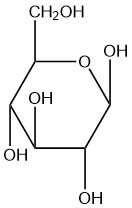 |
| b. | 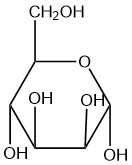 |
| c. | 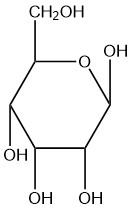 |
| d. | 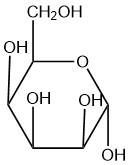 |
| e. | 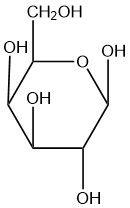 |
Q5.2.9
Consulte la Figura 5.2.7 al responder estas preguntas.
- ¿Qué tipo de sangre es el donante universal? ¿Por qué?
- ¿Qué tipo de sangre es el aceptor universal? ¿Por qué?
- ¿Se puede donar sangre tipo A a receptores con qué tipos de sangre?
- ¿Los receptores tipo B pueden aceptar qué tipos de sangre?
Q5.3.1
Definir la electronegatividad.
Q5.3.2
Describir las tendencias periódicas de los valores de electronegatividad.
Q5.3.3
Distinguir entre enlaces covalentes no polares y polares.
Q5.3.4
Describir el enlace entre cada par de elementos como covalente iónico, polar covalente o no polar. Consulte la Tabla 5.3.1 al responder a esta pregunta. Para el examen, si necesitas valores específicos, se te proporcionará una tabla de valores de electronegatividad. Tenga en cuenta que muchas preguntas pueden ser respondidas sin la tabla conociendo las tendencias periódicas.
- N y O
- C y P
- Si y Cl
- Al y F
- Al y yo
- P y S
- C y N
- B y Cl
- Be y Br
- Si y P
Q5.3.5
Colocar los siguientes enlaces en orden de menor a más polar. Consulte la Tabla 5.3.1 al responder a esta pregunta.
- Fe-N
- H-Cl
- Ca-O
- C-S
Q5.3.6
Colocar los siguientes enlaces en orden de menor a más polar. Utilizar tendencias periódicas para determinar el orden correcto sin mirar los valores de electronegatividad.
- PCl
- SCl
- PBr
- CbR
Q5.3.7
Marcar cada una de las moléculas como covalentes no polares o polares.
- CO 2
- CCl 4
- NH 3
Q5.3.8
Describir los tipos de moléculas que tienen los siguientes tipos de fuerzas intermoleculares.
- Fuerzas de dispersión de Londres
- fuerzas dipolo-dipolo
- enlaces de hidrógeno
Q5.3.9
¿Por qué las fuerzas intermoleculares en H 2 O y H 2 S son tan diferentes entre sí?
Q5.3.10
¿Qué tipo (s) de fuerzas intermoleculares están presentes en cada una de las moléculas de la pregunta 5.3.7?
Q5.3.11
¿Cuál es la relación entre la fuerza de las fuerzas intermoleculares en una molécula y su punto de ebullición?
Q5.3.12
Clasifique lo siguiente en orden de aumento (de menor a mayor) punto de ebullición.
- N 2
- CH 3 OH
- PH 3
Q5.4.1
Definir cromatografía.
Q5.4.2
Enumere dos tipos de cromatografía.
Q5.4.3
Distinguir entre las fases estacionaria y móvil.
RESPUESTAS
5.1: Isómeros
Q5.1.1
Los isómeros son moléculas con la misma fórmula química pero con una estructura o disposición de átomos diferente.
Q5.1.2
Circula los carbonos quirales en cada estructura.
| a. | 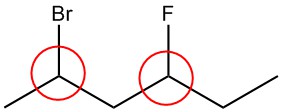 |
| b. | 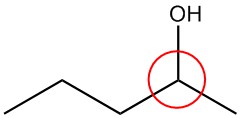 |
| c. | Sin carbonos quirales |
| d. | Sin carbonos quirales |
| e. | 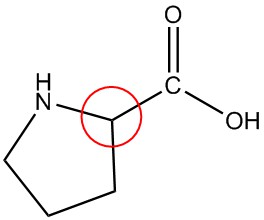 |
| f. | 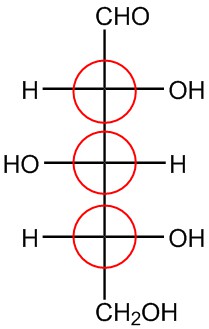 |
| g. | Sin carbonos quirales. |
| h. | 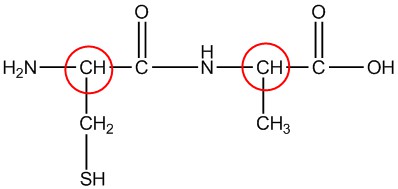 |
| i. | 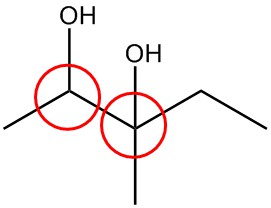 |
| j. | 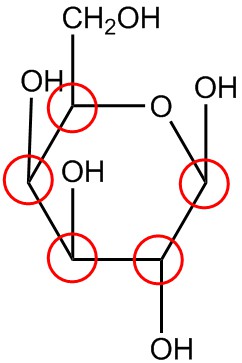 |
Q5.1.3
- No, debido a dos átomos de H en el lado izquierdo del doble enlace.
- Sí, porque los átomos de cloro se muestran trans pero podrían dibujarse cis.
- Sí, porque los dos grupos podrían estar en el mismo lado del anillo o en lados opuestos.
- No, porque necesitas un doble enlace o un anillo para tener un isómero geométrico.
- No, porque solo hay un grupo que no es hidrógeno en el anillo.
- Sí, porque cada carbono en el doble enlace tiene dos grupos diferentes por lo que podría describirse como cis o trans.
Q5.1.4
Para cada par, determinar si son isómeros. Si son isómeros, identificar el tipo.
- estructural
- conformacional
- no isómeros
- estructural
- estructural
- no isómeros
- enantiómeros
- misma molécula
Q5.1.5
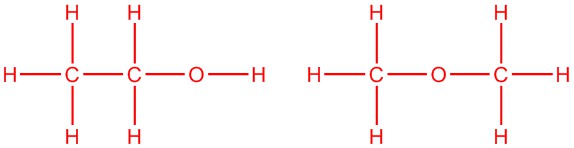
5.2: Estructuras de carbohidratos
Q5.2.1
C 4 H 8 O 4
Q5.2.2
Los monosacáridos son una sola molécula de carbohidrato. Los disacáridos tienen dos moléculas de carbohidratos unidas entre sí. Los polisacáridos tienen tres o más moléculas de carbohidratos unidas entre sí.
Q5.2.3
Los carbohidratos simples son monosacáridos o disacáridos y se descomponen fácilmente en el cuerpo. Los carbohidratos complejos son polisacáridos como los almidones y la fibra y tardan más en descomponerse en el cuerpo.
Q5.2.4
Las respuestas variarán debido a la orientación de H y OH en cada carbono quiral.
| a. | 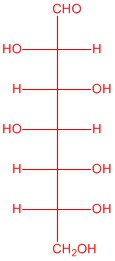 |
| b. | 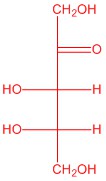 |
| c. | 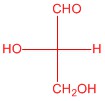 |
| d. | 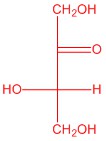 |
Q5.2.5
Dos cualesquiera de las estructuras que se muestran aquí en rojo. Las estructuras en negro son de la Figura 5.2.3.
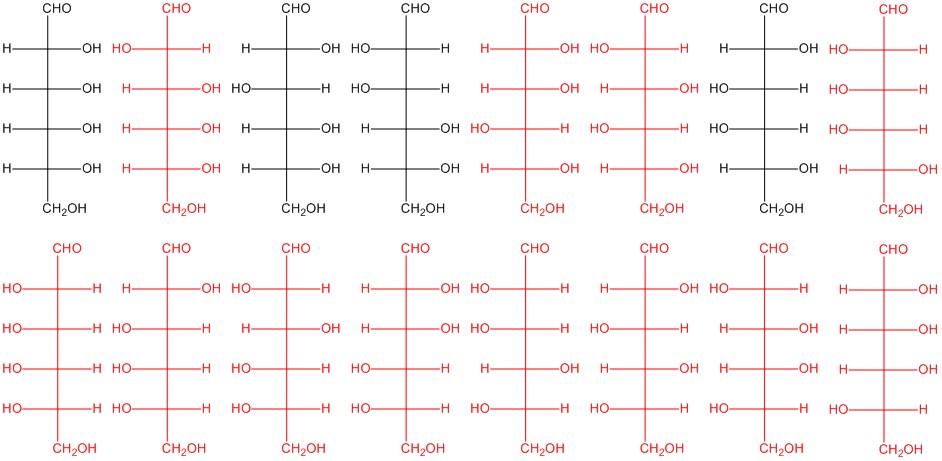
Q5.2.6
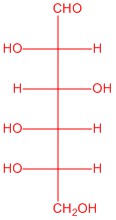 |
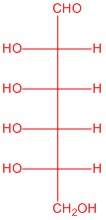 |
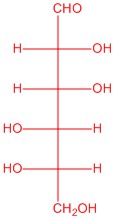 |
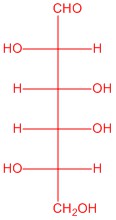 |
| L-glucosa | L-alosa | L-manosa | L-galactosa |
Q5.2.7
- Epímeros porque la orientación difiere en un solo carbono quiral.
- Diastereómeros porque la orientación difiere en múltiples (pero no todos) carbonos quirales.
- Diastereómeros porque la orientación difiere en múltiples (pero no todos) carbonos quirales.
- Diastereómeros porque la orientación difiere en múltiples (pero no todos) carbonos quirales.
Q5.2.8
- beta
- alfa
- beta
- alfa
- beta
Q5.2.9
- O porque tiene el menor número de tipos de carbohidratos.
- AB porque tiene todos los carbohidratos que se encuentran en los glóbulos rojos.
- A puede dar a A o AB.
- B puede recibir B u O.
5.3: Polaridad y Fuerzas Intermoleculares
Q5.3.1
La electronegatividad es la atracción de un átomo hacia un electrón en un enlace.
Q5.3.2
La electronegatividad aumenta de izquierda a derecha y de abajo hacia arriba con un máximo en flúor.
Q5.3.3
Los enlaces covalentes no polares incluso comparten electrones entre átomos, mientras que los electrones polares comparten electrones de manera desigual.
Q5.3.4
- polar
- no polar
- polar
- iónico
- polar
- no polar
- polar
- polar
- polar
- no polar
Q5.3.5
C-S < H-Cl < Fe-N < Ca-O
Calcular la diferencia en electronegatividad para cada vínculo. Cuanto menor es la diferencia, más no polar; cuanto mayor es la diferencia, más polar. Si un enlace tiene una diferencia suficientemente grande, es tan polar que se considera iónico.
Q5.3.6
S-Cl < P-Cl < P-Br < C-Br
- S y Cl están más cerca juntos por lo que tendrán la menor diferencia en electronegatividad y serán los menos polares.
- S-Cl y P-Cl se pueden comparar ya que comparten un elemento común. P está más a la izquierda que S, por lo que la electronegatividad de P debe ser menor que la de S. Por lo tanto, la diferencia entre P y Cl debe ser mayor que la diferencia entre S y Cl ya que los estamos comparando con el mismo elemento (Cl).
- Compara P-Cl y P-Br. Dado que Br está más abajo en la tabla periódica, tiene un valor de electronegatividad menor que Cl. Por lo tanto, la diferencia entre P y Cl es menor que la diferencia entre P y Br. P-Br es más polar que P-Cl.
- Compara P-Br y C-Br. C está más lejos de Br que P es así que la diferencia en electronegatividad es mayor para C-Br que P-Br, haciendo que C-Br sea el enlace más polar.
Q5.3.7
- no polar
- no polar
- polar
 |
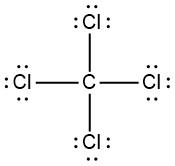 |
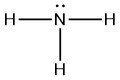 |
Q5.3.8
- todas las moléculas
- moléculas polares
- moléculas con un H unido a F, O o N que es atraído por el F, O o N en otra molécula
Q5.3.9
H 2 O tiene enlaces de hidrógeno mientras que H 2 S no.
Q5.3.10
- dispersión
- dispersión
- dispersión, dipolo-dipolo y enlaces de hidrógeno
Q5.3.11
Cuanto más fuertes sean las fuerzas intermoleculares, mayor será el punto de ebullición.
Q5.3.12
N 2 < PH 3 < CH 3 OH
Estas tres moléculas son comparables en tamaño por lo que las diferencias en las fuerzas de dispersión son pequeñas. N 2 es no polar y solo tiene fuerzas de dispersión. PH 3 es polar, por lo que tiene fuerzas de dispersión y dipolo-dipolo pero no tiene enlaces de hidrógeno. CH 3 OH tiene fuerzas de dispersión, dipolo-dipolo y enlaces de hidrógeno.
Q5.4.1
La cromatogafía se utiliza para separar una mezcla en sus componentes cuando viajan a diferentes velocidades en la fase móvil.
Q5.4.2
Papel, capa fina, líquido y gas son los tipos de cromatografía más conocidos
Q5.4.3
La fase móvil es un fluido que se mueve a través de la fase estacionaria. La fase estacionaria mantiene la muestra hasta que la fase móvil la mueve a lo largo de la fase estacionaria.

