7.1: Estados de la materia
- Page ID
- 77362
Resultados de aprendizaje
- Enumere los tres estados de la materia y dé ejemplos de cada uno.
- Describir las propiedades de cada estado de la materia.
- Identificar y describir cada tipo de cambio de estado.
- Reconocer que los puntos de ebullición y fusión varían con cada sustancia.
- Reconocer que el punto de ebullición de una sustancia depende de la presión.
Estados de la Materia
Otra forma en la que podemos describir las propiedades de la materia es el estado (también llamado fase). La cantidad de energía en las moléculas de la materia determina el estado de la materia. La materia puede existir en uno de varios estados diferentes, incluyendo un estado gaseoso, líquido o sólido. Estos diferentes estados de la materia tienen diferentes propiedades, las cuales se ilustran en la siguiente figura.
- Un gas es un estado de materia en el que los átomos o moléculas tienen suficiente energía para moverse libremente. Las moléculas entran en contacto entre sí sólo cuando chocan aleatoriamente. Las fuerzas entre átomos o moléculas no son lo suficientemente fuertes como para sostenerlos unidos.
- Un líquido es un estado de materia en el que átomos o moléculas están constantemente en contacto pero tienen suficiente energía para mantener posiciones cambiantes entre sí. Las fuerzas entre átomos o moléculas son lo suficientemente fuertes como para mantener las moléculas relativamente juntas pero no lo suficientemente fuertes como para evitar que se muevan más allá de las otras.
- Un sólido es un estado de materia en el que los átomos o moléculas no tienen suficiente energía para moverse. Están constantemente en contacto y en posiciones fijas entre sí. Las fuerzas entre átomos o moléculas son lo suficientemente fuertes como para mantener unidas las moléculas y evitar que se muevan más allá de las otras.

¿Qué determina el estado de una sustancia?
En qué estado se encuentra una sustancia depende en parte de la temperatura y la presión del aire. Por ejemplo, a la presión del aire que se encuentra al nivel del mar, el agua existe como líquido a temperaturas entre\(0^\text{o} \text{C}\) y\(100^\text{o} \text{C}\). Arriba\(100^\text{o} \text{C}\), el agua existe como un gas (vapor de agua). Abajo\(0^\text{o} \text{C}\), el agua existe como un sólido (hielo). Diferentes sustancias tienen un rango diferente de temperaturas a las que existen en cada estado. Por ejemplo, el oxígeno es un gas arriba\(-183^\text{o} \text{C}\), pero el hierro es un gas sólo por encima\(2861^\text{o} \text{C}\). Estas diferencias explican por qué algunas sustancias son siempre sólidas a temperaturas normales de la Tierra, mientras que otras son siempre gases o líquidos.
El agua puede tomar muchas formas. A bajas temperaturas (abajo\(0^\text{o} \text{C}\)), es un sólido. Es un líquido entre\(0^\text{o} \text{C}\) y\(100^\text{o} \text{C}\). Mientras que a temperaturas superiores\(100^\text{o} \text{C}\), el agua es un gas (vapor). El estado en el que se encuentra el agua depende de la temperatura. Cada estado (sólido, líquido y gas) tiene su propio conjunto único de propiedades físicas.
| Gas | Líquido | Sólido | |
|---|---|---|---|
|
Forma |
sin forma definida (toma la forma de su contenedor) |
sin forma definida (toma la forma de su contenedor) |
forma definida (rígida) |
|
Volumen |
las partículas se mueven en movimiento aleatorio con poca o ninguna atracción entre sí |
tiene un volumen definido |
volumen definido |
|
Movilidad |
las partículas se mueven en movimiento aleatorio con poca o ninguna atracción entre sí |
las partículas son libres de moverse unas sobre otras, pero aún se sienten atraídas entre sí |
partículas vibran alrededor de ejes fijos |
|
Compresibilidad |
altamente compresible |
débilmente compresible |
débilmente compresible |
Técnicamente hablando existe un cuarto estado de materia llamado plasma, pero no ocurre naturalmente en la tierra, por lo que lo omitiremos de nuestro estudio aquí.
Cambio de Estados
La materia pasa constantemente por ciclos que involucran estados cambiantes (también llamados fases de cambio). El agua y todos los elementos importantes para los organismos, incluyendo el carbono y el nitrógeno, se reciclan constantemente en la Tierra. A medida que la materia se mueve a través de sus ciclos, cambia de estado repetidamente. Por ejemplo, en el ciclo del agua, el agua cambia repetidamente de un gas a un líquido o sólido y de nuevo a un gas nuevamente. ¿Cómo sucede esto?
Agregar energía a la materia le da a sus átomos o moléculas la capacidad de resistir algunas de las fuerzas que los mantienen unidos. Por ejemplo, calentar el hielo hasta su punto de fusión le da a sus moléculas la energía suficiente para moverse. El hielo se derrite y se convierte en agua líquida. De igual manera, calentar el agua líquida hasta su punto de ebullición le da a sus moléculas la energía suficiente para apartarse unas de otras para que ya no tengan contacto. El agua líquida se vaporiza y se convierte en vapor de agua.
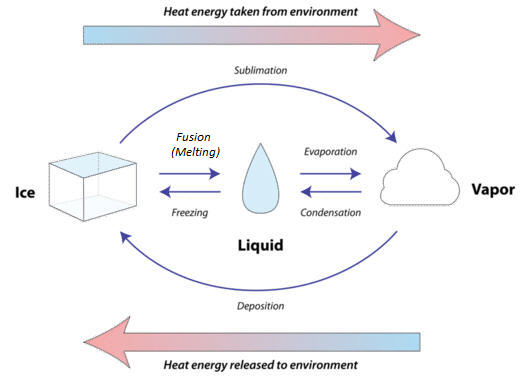
La temperatura de los puntos de fusión y ebullición depende de la identidad de la sustancia y de la presión atmosférica. Cada sustancia tiene sus propios puntos de ebullición y fusión que dependen de las propiedades de la sustancia, incluyendo la fuerza de sus fuerzas intermoleculares. Como ejemplo, los valores para el agua se dan en la Tabla\(\PageIndex{1}\). Observe cómo el punto de ebullición del agua varía mucho con la presión.
| Altitud\(\left( \text{ft} \right)\) | Presión\(\left( \text{atm} \right)\) | Punto de ebullición\(\left( ^\text{o} \text{C} \right)\) |
|---|---|---|
| \ (\ left (\ text {ft}\ right)\)” style="vertical-align:middle; text-align:center; ">-500 | \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">1.05 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center; ">100.5 |
| \ (\ left (\ text {ft}\ right)\)” style="vertical-align:middle; text-align:center; ">0 | \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">1.00 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center; ">100 |
| \ (\ left (\ text {ft}\ right)\)” style="vertical-align:middle; text-align:center; ">4000 | \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">0.892 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center; ">96 |
| \ (\ left (\ text {ft}\ right)\)” style="vertical-align:middle; text-align:center; ">7000 | \ (\ left (\ text {atm}\ right)\)” style="vertical-align:middle; text-align:center; ">0.797 | \ (\ left (^\ text {o}\ text {C}\ right)\)” style="vertical-align:middle; text-align:center; ">93 |
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

