7.2: Cambios de Estado y Energía
- Page ID
- 77330
Resultados de aprendizaje
- Identificar si la energía se consume o se libera durante un cambio de fase.
- Calcular la cantidad de energía consumida o liberada durante un cambio de fase.
- Reconocer que las entalpías de vaporización y condensación son iguales en magnitud pero opuestas en signo.
- Reconocer que las entalpías de fusión y congelación son iguales en magnitud pero opuestas en signo.
Curva de calentamiento
Cuando se suministra energía térmica a un sólido (como el hielo) a un ritmo constante por medio de una bobina eléctrica de calentamiento, encontramos que la temperatura sube constantemente hasta alcanzar el punto de fusión y se hacen evidentes los primeros signos de formación de líquido. A partir de entonces, aunque todavía estamos suministrando energía térmica al sistema, la temperatura permanece constante mientras estén presentes tanto líquidos como sólidos. En la gráfica siguiente, esto está representado por la línea plana, donde se está agregando energía al hielo, pero no se está produciendo ningún cambio en la temperatura. Toda la energía añadida al sistema en esta etapa se utiliza para convertir el hielo sólido en agua líquida.
Una vez que toda la muestra está en fase líquida, la adición de energía ahora aumenta la temperatura hasta que se alcanza el punto de ebullición y se observan los primeros signos de formación de gas. La temperatura permanece constante a pesar de que se está agregando energía al sistema. La energía se está utilizando para convertir el líquido en un gas. Una vez que toda la muestra está en fase gaseosa, se puede agregar energía adicional para aumentar la temperatura del gas.
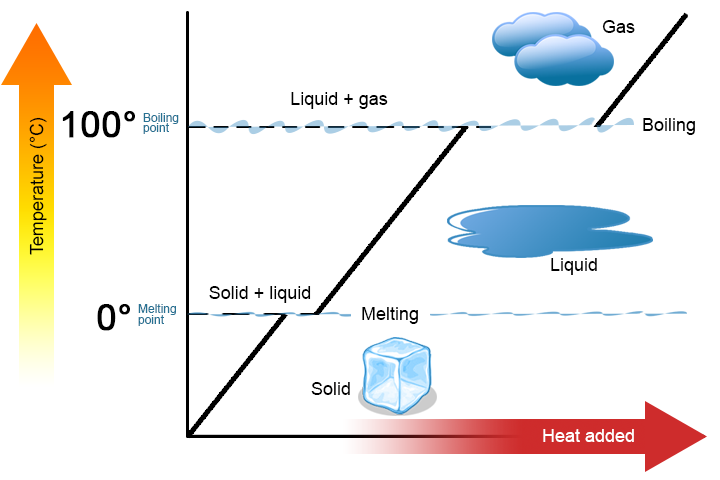
Este comportamiento macroscópico demuestra con bastante claridad que se debe suministrar energía a un sólido para fundirlo o vaporizarlo. A nivel microscópico, la fusión o vaporización implica separar moléculas que son atraídas entre sí. La cantidad de energía necesaria para separar las moléculas es proporcional a las fuerzas intermoleculares entre las moléculas.
Entalpía
La energía térmica que un sólido absorbe cuando se funde se llama entalpía de fusión (ΔH fus) o calor de fusión y generalmente se cotiza sobre una base molar. (La palabra fusión significa lo mismo que “fusión”.) Cuando se funde 1 mol de hielo, por ejemplo, encontramos a partir del experimento que se necesitan 6.01 kJ de energía. La entalpía molar de fusión de hielo es así +6.01 kJ por mol (\(\dfrac{6.01\;kJ}{mol}\)), y podemos escribir
\[\text{H}_{2}\text{O}(s) \rightarrow \text{H}_{2}\text{O}(l)\]
\[\triangle H_{fus} = \dfrac{6.01\;kJ}{mol}\]
Si se funden dos moles de agua, entonces requeriría el doble de energía (ver más abajo). La cantidad de energía necesaria para fundir una sustancia dependerá de la cantidad de la sustancia.
\(2\;mol\times \dfrac{6.01\;kJ}{mol}=\dfrac{12.0\;kJ}{mol}\)
Las entalpías molares seleccionadas de fusión se tabulan en la Tabla\(\PageIndex{1}\). Los sólidos como el hielo que tienen fuertes fuerzas intermoleculares tienen valores mucho más altos que aquellos como CH 4 con débiles.
Cuando se hierve (o vaporiza) un líquido, se requiere energía para separar las moléculas para pasar de la fase líquida a la fase gaseosa. La energía que un líquido absorbe cuando se vaporiza se conoce como entalpía de vaporización (ΔH vap). En el caso del agua, la entalpía molar de vaporización es (\(\dfrac{40.67\;kJ}{mol}\)). En otras palabras
\[\text{H}_{2}\text{O}(s) \rightarrow \text{H}_{2}\text{O}(l)\]
\[\triangle H_{vap} = 40.67 \dfrac {\text{kJ}}{\text{mol}}\]
La energía térmica se absorbe para vaporizar un líquido porque las moléculas que se mantienen unidas por fuerzas intermoleculares en el líquido se separan a medida que se forma el gas. Tal separación requiere energía. Al igual que con la fusión, la cantidad de energía necesaria para vaporizar una sustancia es proporcional a la cantidad de sustancia presente. Cuanto más líquido haya, más energía se requiere para vaporizarlo.
En general, la energía necesaria difiere de un líquido a otro dependiendo de la magnitud de las fuerzas intermoleculares. Podemos esperar que los líquidos con fuertes fuerzas intermoleculares tengan entalpías de vaporización más grandes. Vea los ejemplos en la tabla a continuación. Nótese que la entalpía de vaporización de una sustancia es siempre mayor que su entalpía de fusión. Cuando un sólido se funde, las moléculas no se separan entre sí casi en la misma medida que cuando un líquido hierve.
Los puntos de fusión y ebullición se dan en unidades de Kelvin (\(K = T_{^{\circ}C}\;+\;273.15 \))
* http://www1.lsbu.ac.uk/water/data.html
Ejemplo\(\PageIndex{1}\): Heat Energy
Calcular la energía térmica requerida para (a) vaporizar 100. g de plomo, (b) fundir 100. g de plomo, (c) vaporizar 100. g de agua, y (d) fundir 100. g de agua.
Solución
a) Para vaporizar 100. g de plomo:
\ [\ texto {Pb} (l)\ fila derecha\ texto {Pb} (g)\;\;\;\;\;\;\;\;\;\;
\;\ triángulo H_ {vap} = 178\ dfrac {kJ} {mol}\]
\[100.\;g\times\dfrac {1\;mol\;\text{Pb}}{207.2\;g\;\text{Pb}}\times \dfrac{178\;{kJ}}{mol} = 85.9\; kJ\]
b) Para fundir 100. g de plomo:
\[\text{Pb}(s) \rightarrow\text{Pb}(l)\;\;\;\;\;\;\;\;\;\;\triangle H_{fus} = 4.77 \dfrac {kJ}{mol}\]
\[100.\;g\times\dfrac {1\;mol\;\text{Pb}}{207.2\;g\;\text{Pb}}\times \dfrac{4.77\;{kJ}}{mol} = 2.30\; kJ\]
(c) Para vaporizar 100. g de agua:
\[\text{H}_2\text{O}(s) \rightarrow\text{H}_2\text{O}(l)\;\;\;\;\;\;\;\;\;\;\triangle H_{vap} =40.657\dfrac {kJ}{mol}\]
\[100.\;g\times\dfrac {1\;mol\;\text{H}_2\text{O}}{18.0\;g\;\text{H}_2\text{O}}\times \dfrac{40.657\;{kJ}}{mol} = 226\; kJ\]
d) Para fundir 100. g de agua:
\[\text{H}_2\text{O}(s) \rightarrow\text{H}_2\text{O}(l)\;\;\;\;\;\;\;\;\;\;\triangle H_{fus} = 6.01 \dfrac {kJ}{mol}\]
\[100.\;g\times\dfrac {1\;mol\;\text{H}_2\text{O}}{18.0\;g\;\text{H}_2\text{O}}\times \dfrac{6.01\;{kJ}}{mol} = 33.4\; kJ\]
Podría ser sorprendente que el calor requerido para fundir o vaporizar 100 g de plomo sea mucho menor que el que se requiere para fundir o vaporizar el agua. En primer lugar, la temperatura a la que se funde la sustancia no tiene nada que ver con la entalpía de fusión. Recuerda, solo estamos mirando la energía requerida para cambiar la fase, no la energía requerida para llevar la sustancia al punto de fusión o ebullición.
También tenga en cuenta que las entalpías de fusión y vaporización se dan como kJ por mol. Aunque el agua y el plomo tienen la misma masa, los moles de cada sustancia son muy diferentes (5.5 moles de agua vs. 0.48 moles de plomo).
Congelación y Condensación
La discusión aquí se ha centrado en la fusión (fusión) y vaporización. Pero ¿qué pasa con la congelación y la condensación? La fusión (sólido a líquido) y la congelación (líquido a sólido) son procesos opuestos. En consecuencia, la magnitud de la energía para cada uno es la misma, pero el signo es diferente. Con la fusión, la energía es un valor positivo porque es endotérmica (consume energía) mientras que la energía para congelar es negativa porque es un proceso exotérmico (liberando energía).
Comparemos las entalpías de fusión y congelación para metano. Ambos valores tienen la misma magnitud de 0.94 pero tienen el signo contrario.
\(\triangle H_{fusion}=0.94\;\dfrac{kJ}{mol}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\triangle H_{freezing}=-0.94\;\dfrac{kJ}{mol}\)
El mismo concepto se aplica a la vaporización (líquido a gas) y condensación (gas a líquido). La energía se consume durante la vaporización (energía positiva) y se libera durante la condensación (energía negativa). Las entalpías de vaporización y condensación son iguales en magnitud pero opuestas en signo.
\(\triangle H_{vaporization}=8.18\;\dfrac{kJ}{mol}\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\triangle H_{condensation}=-8.18\;\dfrac{kJ}{mol}\)
La energía se consume para cambiar una sustancia de sólida a líquida a gaseosa. Se libera energía para cambiar una sustancia de gas a líquida a sólida.
Colaboradores y Atribuciones
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

