7.5: Soluciones Acuosas
- Page ID
- 77332
Resultados de aprendizaje
- Definir una solución y describir las partes de una solución.
- Describir cómo se forma una solución acuosa a partir de compuestos iónicos y compuestos moleculares.
- Reconocer que algunos compuestos son insolubles en agua.
- Describir las diferencias entre electrolitos fuertes, electrolitos débiles y no electrolitos.
Formando una solución
Cuando una sustancia se disuelve en otra, se forma una solución. Una solución es una mezcla homogénea que consiste en un soluto disuelto en un disolvente. El soluto es la sustancia que se está disolviendo, mientras que el disolvente es el medio de disolución. Las soluciones se pueden formar con muchos tipos y formas diferentes de solutos y solventes. En este capítulo, nos centraremos en la solución donde el solvente es el agua. Una solución acuosa es agua que contiene una o más sustancias disueltas. Las sustancias disueltas en una solución acuosa pueden ser sólidos, gases u otros líquidos.
Para ser una verdadera solución, una mezcla debe ser estable. Cuando el azúcar se disuelve completamente en agua, puede permanecer durante un tiempo indefinido, y el azúcar no se sedimentará de la solución. Además, si la solución de azúcar-agua se pasa a través de un filtro, permanecerá con el agua. Esto se debe a que las partículas disueltas en una solución son muy pequeñas, generalmente menores que\(1 \: \text{nm}\) en diámetro. Las partículas de soluto pueden ser átomos, iones o moléculas, dependiendo del tipo de sustancia que se haya disuelto.

El proceso de disolución
El agua generalmente disuelve la mayoría de los compuestos iónicos y moléculas polares. Las moléculas no polares, como las que se encuentran en la grasa o el aceite, no se disuelven en agua. Primero examinaremos el proceso que ocurre cuando un compuesto iónico, como la sal de mesa (cloruro de sodio), se disuelve en agua.
Las moléculas de agua se mueven continuamente debido a su energía cinética. Cuando se coloca un cristal de cloruro de sodio en el agua, las moléculas del agua chocan con la red cristalina. Recordemos que la red cristalina está compuesta por iones positivos y negativos alternantes. El agua es atraída por el cristal de cloruro de sodio porque el agua es polar; tiene un final tanto positivo como negativo. Los iones de sodio cargados positivamente en el cristal atraen el extremo de oxígeno de las moléculas de agua porque son parcialmente negativas. Los iones cloruro cargados negativamente en el cristal atraen el extremo de hidrógeno de las moléculas de agua porque son parcialmente positivas. La acción de las moléculas polares de agua separa la red cristalina (véase la figura a continuación).
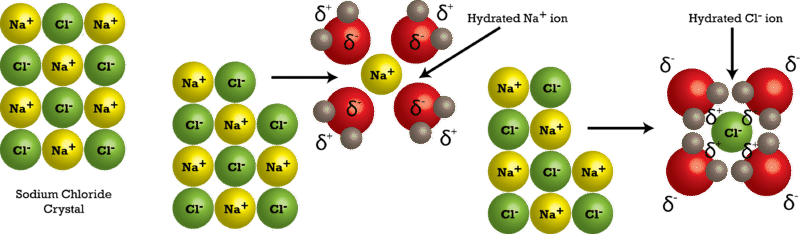
Después de separarse del cristal, los iones individuales son rodeados por partículas de disolvente en un proceso llamado solvatación. Obsérvese en la figura anterior que\(\ce{Na^+}\) los iones individuales están rodeados por moléculas de agua con el átomo de oxígeno orientado cerca del ion positivo. Asimismo, los iones cloruro están rodeados por moléculas de agua con la orientación opuesta. La hidratación es el proceso de partículas de soluto que están rodeadas por moléculas de agua dispuestas de manera específica. La hidratación ayuda a estabilizar las soluciones acuosas al evitar que los iones positivos y negativos se vuelvan a unir y formen un precipitado.
El azúcar de mesa está hecho del compuesto molecular sacarosa\(\left( \ce{C_{12}H_{22}O_{11}} \right)\). El azúcar sólido consiste en moléculas individuales de azúcar unidas por fuerzas atractivas intermoleculares. Cuando el agua disuelve el azúcar, separa las moléculas individuales de azúcar alterando las fuerzas atractivas, pero no rompe los enlaces covalentes entre los átomos de carbono, hidrógeno y oxígeno. Las moléculas de azúcar disueltas también están hidratadas. La capa de hidratación alrededor de una molécula de sacarosa está dispuesta de manera que sus átomos de oxígeno parcialmente negativos estén cerca de los átomos de hidrógeno parcialmente positivos en el disolvente, y viceversa.
Compuestos insolubles
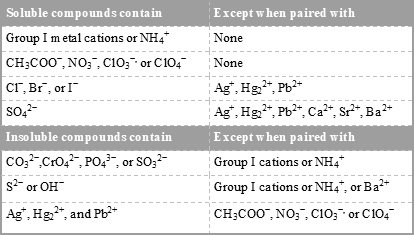
No todos los compuestos se disuelven bien en agua. Algunos compuestos iónicos, como el carbonato de calcio\(\left( \ce{CaCO_3} \right)\) y el cloruro de plata\(\left( \ce{AgCl} \right)\), son casi insolubles. Esto se debe a que las atracciones entre los iones en la red cristalina son más fuertes que la atracción que tienen las moléculas de agua por los iones. Como resultado, el cristal permanece intacto. La solubilidad de los compuestos iónicos se puede predecir usando las reglas de solubilidad como se muestra en la Tabla\(\PageIndex{1}\).
Cuadro\(\PageIndex{1}\): Reglas de solubilidad para compuestos iónicos en agua.
Los compuestos no polares tampoco se disuelven en agua. Las fuerzas de atracción que operan entre las partículas en un compuesto no polar son fuerzas de dispersión débiles. Para que una molécula no polar se disuelva en agua, tendría que romper algunos de los enlaces de hidrógeno entre las moléculas de agua adyacentes. En el caso de una sustancia iónica, estas interacciones favorables son reemplazadas por otras interacciones atractivas entre los iones y las cargas parciales sobre el agua. Sin embargo, las interacciones entre las moléculas no polares y el agua son menos favorables que las interacciones que el agua hace consigo misma. Cuando un líquido no polar como el aceite se mezcla con agua, se forman dos capas separadas, porque los líquidos no se disolverán entre sí (ver figura abajo). Cuando un líquido polar como el etanol se mezcla con agua, se mezclan completamente y se disuelven entre sí. Se dice que los líquidos que se disuelven unos en otros en todas las proporciones son miscibles. Los líquidos que no se disuelven entre sí se denominan inmiscibles. La regla general para decidir si una sustancia es capaz de disolver otra es “como se disuelve como”, donde la propiedad que se compara es la polaridad general de la sustancia. Por ejemplo, un sólido no polar como el yodo se disolverá en un fluido más ligero no polar, pero no se disolverá en agua polar.

Electrolitos y no electrolitos
Un electrolito es un compuesto que conduce una corriente eléctrica cuando se disuelve en agua o se funde. Para conducir una corriente, una sustancia debe contener iones móviles que puedan moverse de un electrodo a otro. Todos los compuestos iónicos son electrolitos. Cuando los compuestos iónicos se disuelven, se rompen en iones, que luego son capaces de conducir una corriente. Incluso los compuestos iónicos insolubles\(\ce{CaCO_3}\), tales como, se consideran electrolitos porque pueden conducir una corriente en estado fundido (fundido).

Un no electrolito es un compuesto que no conduce una corriente eléctrica ni en solución acuosa ni en estado fundido. Muchos compuestos moleculares, como el azúcar o el etanol, no son electrolitos. Cuando estos compuestos se disuelven en agua, no producen iones. A continuación se ilustra la diferencia entre un electrolito y un no electrolito.
Disociación
Anteriormente, se vio cómo una red cristalina iónica se rompe cuando se disuelve en agua. La disociación es la separación de iones que se produce cuando se disuelve un compuesto iónico sólido. Simplemente deshaga el método entrecruzado que aprendió al escribir fórmulas químicas para compuestos iónicos, y se quedará con los componentes de una ecuación de disociación iónica. Los subíndices para los iones en las fórmulas químicas se convierten en los coeficientes de los respectivos iones en el lado del producto de las ecuaciones. A continuación se muestran las ecuaciones de disociación para\(\ce{NaCl}\)\(\ce{Ca(NO_3)_2}\),, y\(\ce{(NH_4)_3PO_4}\).
\[\begin{align} &\ce{NaCl} \left( s \right) \rightarrow \ce{Na^+} \left( aq \right) + \ce{Cl^-} \left( aq \right) \\ &\ce{Ca(NO_3)_2} \left( s \right) \rightarrow \ce{Ca^{2+}} \left( aq \right) + 2 \ce{NO_3^-} \left( aq \right) \\ &\ce{(NH_4)_3PO_4} \left( s \right) \rightarrow 3 \ce{NH_4^+} \left( aq \right) + \ce{PO_4^{3-}} \left( aq \right) \end{align}\]
Una unidad de fórmula de cloruro de sodio se disocia en un ión de sodio y un ion de cloruro. La unidad de fórmula de nitrato de calcio se disocia en un ion calcio y dos iones nitrato, porque la\(2+\) carga de cada ion calcio requiere dos iones nitrato (cada uno con una carga de\(1-\)) para formar un compuesto eléctricamente neutro. La unidad de fórmula fosfato de amonio se disocia en tres iones amonio y un ion fosfato.
No confundir los subíndices de los átomos dentro del ion poliatómico con los subíndices que resultan del entrecruzamiento de las cargas que hacen neutro al compuesto original. El subíndice 3 del ion ntirato y el subíndice 4 del ión amonio son parte del ion poliatómico y permanecen como parte de la fórmula iónica después de que el compuesto se disocie. Observe que los compuestos son sólidos\(\left( s \right)\) que se convierten en iones cuando se disuelven en agua, produciendo una solución acuosa\(\left( aq \right)\).

Los no electrolitos no se disocian al formar una solución acuosa. Todavía se puede escribir una ecuación que simplemente muestre el sólido entrando en solución. Por ejemplo, el proceso de disolución de sacarosa en agua se puede escribir de la siguiente manera:
\[\ce{C_{12}H_{22}O_{11}} \left( s \right) \rightarrow \ce{C_{12}H_{22}O_{11}} \left( aq \right)\]
Electrolitos fuertes y débiles
Algunos compuestos moleculares polares no son electrolitos cuando están en estado puro pero se convierten en electrolitos cuando se disuelven en agua. \(\left( \ce{HCl} \right)\)El cloruro de hidrógeno es un gas en su estado molecular puro y no es un electrolito. Sin embargo, cuando\(\ce{HCl}\) se disuelve en agua, conduce un pozo de corriente porque la\(\ce{HCl}\) molécula se ioniza en iones hidrógeno y cloruro.
\[\ce{HCl} \left( g \right) \rightarrow \ce{H^+} \left( aq \right) + \ce{Cl^-} \left( aq \right)\]
Cuando\(\ce{HCl}\) se disuelve en agua, se llama ácido clorhídrico. Los compuestos iónicos y algunos compuestos polares se rompen completamente en iones y así conducen una corriente muy bien. Un electrolito fuerte es una solución en la que casi todo el soluto disuelto existe como iones.
Algunos otros compuestos moleculares polares se convierten en electrolitos al disolverse en agua pero no se ionizan en gran medida. Por ejemplo, el ácido nitroso\(\left( \ce{HNO_2} \right)\) solo se ioniza parcialmente en iones hidrógeno e iones nitrito cuando se disuelve en agua. El ácido nitroso acuoso está compuesto por solo aproximadamente\(5\%\) iones y moléculas\(95\%\) intactas de ácido nitroso Un electrolito débil es una solución en la que solo una pequeña fracción del soluto disuelto existe como iones. La ecuación que muestra la ionización de un electrolito débil utiliza una flecha de equilibrio, lo que indica un equilibrio entre los reactivos y los productos.
\[\ce{HNO_2} \left( aq \right) \rightleftharpoons \ce{H^+} \left( aq \right) + \ce{NO_2^-} \left( aq \right)\]
Colaboradores y Atribuciones
CK-12 Foundation by Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, and Jean Dupon.
Allison Soult, Ph.D. (Department of Chemistry, University of Kentucky)

