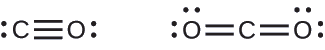4.3: Múltiples enlaces covalentes
- Page ID
- 72773
- Identificar cuándo se necesita un enlace múltiple (doble o triple) para completar un octeto.
La compartición de un par de electrones representa un solo enlace covalente, generalmente denominado solo enlace sencillo. Sin embargo, en muchas moléculas los átomos alcanzan octetos completos al compartir más de un par de electrones entre ellos:
- Dos pares de electrones comparten un doble enlace
- Tres pares de electrones comparten un triple enlace
Debido a que cada nitrógeno contiene 5 electrones de valencia, necesitan compartir 3 pares para lograr cada uno un octeto de valencia. El N 2 es bastante inerte, debido al fuerte triple enlace entre los dos átomos de nitrógeno.
Además del nitrógeno y el oxígeno, el carbono también formará comúnmente múltiples enlaces para completar octetos de valencia. A continuación se muestran ejemplos adicionales que involucran estos tres átomos.
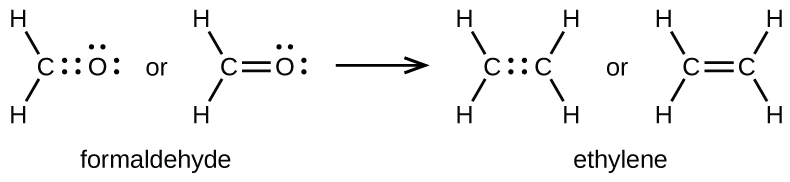
Se forma un doble enlace entre los átomos de carbono y oxígeno en CH 2 O (formaldehído) y entre los dos átomos de carbono en C 2 H 4 (etileno):
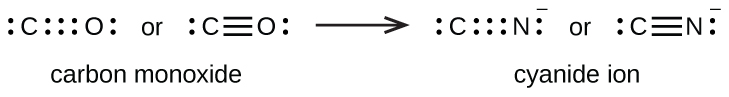
Se forma un triple enlace entre el carbono y el oxígeno en el monóxido de carbono (CO) y entre el carbono y el nitrógeno en el ion cianuro (CN —):
La misión Cassini-Huygens de la NASA detectó una gran nube de cianuro de hidrógeno tóxico (HCN) en Titán, una de las lunas de Saturno. Titán también contiene etano (H 3 CCH 3), acetileno (HCCH) y amoníaco (NH 3). ¿Cuáles son las estructuras de Lewis de estas moléculas?
Solución
Calcular el número de electrones de valencia.
- HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
- H 3 CCH 3: (1 × 3) + (2 × 4) + (1 × 3) = 14
- HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
- NH 3: (5 × 1) + (3 × 1) = 8
Dibuja un esqueleto y conecta los átomos con enlaces simples. Recuerda que H nunca es un átomo central:
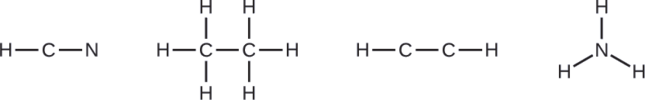
Cuando sea necesario, distribuya electrones a los átomos terminales:
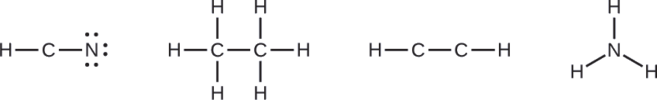
- HCN: seis electrones colocados en N
- H 3 CCH 3: no quedan electrones
- HCCH: sin átomos terminales capaces de aceptar electrones
- NH 3: sin átomos terminales capaces de aceptar electrones
Cuando sea necesario, coloque los electrones restantes en el átomo central:
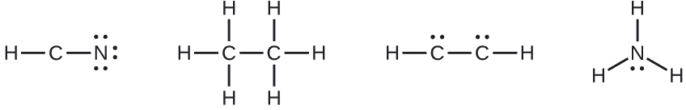
- HCN: no quedan electrones
- H 3 CCH 3: no quedan electrones
- HCCH: cuatro electrones colocados sobre carbono
- NH 3: dos electrones colocados sobre nitrógeno
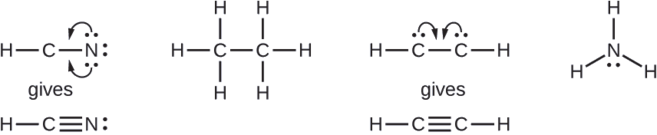
Cuando sea necesario, reorganice los electrones para formar múltiples enlaces con el fin de obtener un octeto en cada átomo:
- HCN: formar dos bonos C—N más
- H 3 CCH 3: todos los átomos tienen el número correcto de electrones
- HCCH: formar un triple enlace entre los dos átomos de carbono
- NH 3: todos los átomos tienen el número correcto de electrones
Tanto el monóxido de carbono, el CO, como el dióxido de carbono, CO 2, son productos de la combustión de combustibles fósiles. Ambos gases también causan problemas: el CO es tóxico y el CO 2 ha estado implicado en el cambio climático global. ¿Cuáles son las estructuras de Lewis de estas dos moléculas?
- Contestar
-