4.4: Enlaces Covalentes Coordinados
- Page ID
- 72811
- Describir la diferencia entre un enlace covalente y un enlace covalente coordinado.
- Identificar moléculas que forman enlaces covalentes coordinados.
¿Recuerdas cuando eras más joven y te dijeron que compartieras tu juguete favorito con tu hermano, hermana o amigo? Probablemente no querías compartir, pero lo hiciste de todos modos. Probablemente resultó que te divertiste más jugando con el juguete juntos que si te lo hubieras guardado para ti mismo. Los átomos suelen compartir electrones con otros átomos que no tienen nada que contribuir a la situación formando un enlace covalente coordinado; el resultado final es una nueva estructura.
Enlaces Covalentes Coordinados
Cada uno de los enlaces covalentes que hemos visto hasta ahora ha involucrado a cada uno de los átomos que se unen aportando uno de los electrones al par compartido. Existe un tipo alternativo de enlace covalente en el que uno de los átomos proporciona ambos electrones en un par compartido. El monóxido de carbono\(\ce{CO}\),, es un gas tóxico que se libera como subproducto durante la quema de combustibles fósiles. El enlace entre el\(\ce{C}\) átomo y el\(\ce{O}\) átomo puede pensarse en la siguiente procesión:
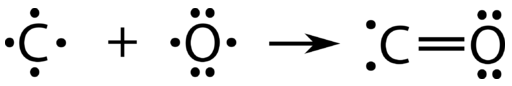
En este punto, se ha formado un doble enlace entre los dos átomos, con cada átomo proporcionando uno de los electrones a cada enlace. El átomo de oxígeno ahora tiene un octeto estable de electrones, pero el átomo de carbono sólo tiene seis electrones y es inestable. Esta situación se resuelve si el átomo de oxígeno aporta uno de sus pares solitarios para hacer un tercer enlace con el átomo de carbono.
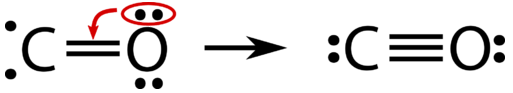
La molécula de monóxido de carbono está correctamente representada por un triple enlace covalente entre los átomos de carbono y oxígeno. Uno de los enlaces formados es un enlace covalente coordinado, un enlace covalente en el que uno de los átomos aporta ambos electrones en el par compartido. Una vez formado, un enlace covalente coordinado es el mismo que cualquier otro enlace covalente. No es como si los dos enlaces convencionales en la\(\ce{CO}\) molécula fueran más fuertes o diferentes de cualquier otra manera que el enlace covalente coordinado.
Las moléculas deficientes en electrones, como\(\ce{BF3}\), son muy reactivas y a menudo se combinan con otras moléculas formando enlaces covalentes coordinados. El átomo central de boro en\(\ce{BF3}\) no tiene ocho electrones, y por lo tanto es muy reactivo. Se puede combinar fácilmente con una molécula que contiene un átomo central con un par solitario de electrones. Por ejemplo,\(\ce{NH3}\) reacciona con\(\ce{BF3}\) porque el par solitario sobre nitrógeno se puede compartir con el átomo de boro:
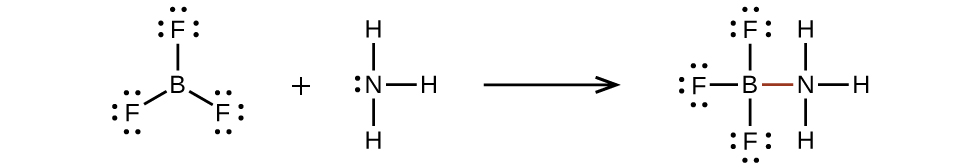
Resumen
- Los enlaces covalentes coordinados se pueden formar cuando un átomo proporciona un par solitario de electrones al enlace.
- Los enlaces covalentes coordinados son tan fuertes como otros enlaces covalentes.
Revisar
- ¿De dónde proviene el tercer enlace covalente en la molécula de CO?
- ¿Por qué es incorrecta la estructura incorrecta para CO arriba?
- ¿Los enlaces covalentes coordinados son más fuertes o más débiles que los enlaces covalentes regulares?

