4.9: Enlaces Covalentes Polares y Electronegatividad
- Page ID
- 72772
Objetivos de aprendizaje
- Describir la electronegatividad y polaridad.
- Utilice valores de electronegatividad para predecir la polaridad del enlace.
Nuestras discusiones sobre el enlace hasta ahora se han centrado en dos tipos, iónico y covalente. En los enlaces iónicos, como\(NaCl\), los electrones se transfieren; el electrón 3s se separa del átomo de Na y se incorpora a la estructura electrónica del átomo de Cl, y el compuesto se describe con mayor precisión como consistente en individuos\(Na^+\) e\(Cl^-\) iones. En el enlace covalente, los electrones desapareados de los átomos individuales se comparten para llenar la capa de valencia de cada átomo. Cuando se forma un enlace covalente entre el mismo tipo de átomos, tal como\(Cl_2\), los electrones se comparten por igual entre los dos. Sin embargo, cuando se forma un enlace covalente entre diferentes tipos de átomos, los electrones no necesariamente se comparten por igual. En estos compuestos su carácter de enlace cae entre los dos extremos: transferidos y compartidos por igual.
Polaridad de enlace
Como se demuestra a continuación, la polaridad del enlace es un concepto útil para describir la compartición de electrones entre átomos, dentro de un enlace covalente:
- Un enlace covalente no polar (Figura\(\PageIndex{1a}\)) es aquel en el que los electrones se comparten por igual entre dos átomos.
- Un enlace covalente polar (Figura\(\PageIndex{1b}\)) es aquel en el que un átomo tiene una mayor atracción por los electrones que el otro átomo.
- Si la atracción relativa de un átomo por electrones es lo suficientemente grande, entonces el enlace es un enlace iónico (Figura\(\PageIndex{1c}\)).
La densidad de electrones en un enlace polar se distribuye de manera desigual y es mayor alrededor del átomo que atrae a los electrones más que el otro. Por ejemplo, los electrones en el enlace H—Cl de una molécula de cloruro de hidrógeno pasan más tiempo cerca del átomo de cloro que cerca del átomo de hidrógeno. Tenga en cuenta que el área sombreada alrededor de Cl en la Figura\(\PageIndex{1b}\) es mucho mayor que alrededor de H. Este desequilibrio en la densidad de electrones da como resultado una acumulación de carga negativa parcial (designada como δ−) en un lado del enlace (Cl) y una carga positiva parcial (designada δ+) en el otro lado del enlace (H).
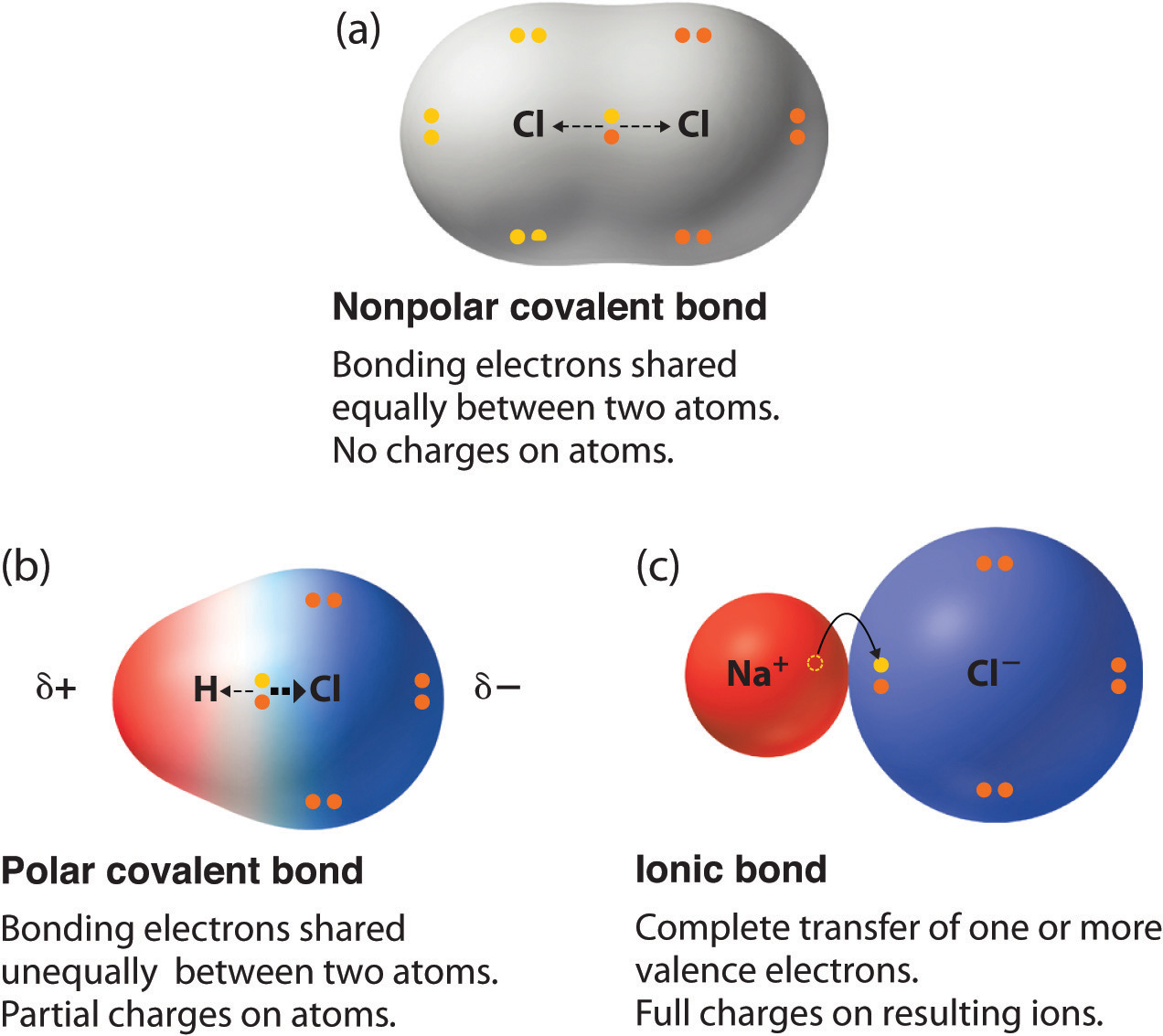
Figura\(\PageIndex{1}\): Distribución de electrones en un enlace covalente no polar, un enlace covalente polar y un enlace iónico mediante estructuras de electrones de Lewis. En un enlace puramente covalente (a), los electrones de enlace se comparten por igual entre los átomos. En un enlace puramente iónico (c), un electrón ha sido transferido completamente de un átomo al otro. Un enlace covalente polar (b) es intermedio entre los dos extremos: los electrones de unión se comparten de manera desigual entre los dos átomos, y la distribución de electrones es asimétrica, siendo la densidad electrónica mayor alrededor del átomo más electronegativo. Las regiones ricas en electrones (cargadas negativamente) se muestran en azul; las regiones pobres en electrones (cargadas positivamente) se muestran en rojo.
Cualquier enlace covalente entre átomos de diferentes elementos es un enlace polar, pero el grado de polaridad varía ampliamente. Algunos enlaces entre diferentes elementos son solo mínimamente polares, mientras que otros son fuertemente polares. Los enlaces iónicos pueden considerarse los últimos en polaridad, con electrones que se transfieren en lugar de ser compartidos. Para juzgar la polaridad relativa de un enlace covalente, los químicos utilizan la electronegatividad, que es una medida relativa de cuán fuertemente un átomo atrae electrones cuando forma un enlace covalente.
Electronegatividad
Debido a que la tendencia de un elemento a ganar o perder electrones es tan importante para determinar su química, se han desarrollado diversos métodos para describir cuantitativamente esta tendencia. El método más importante utiliza una medida llamada electronegatividad, definida como la capacidad relativa de un átomo para atraer electrones hacia sí mismo en un compuesto químico. Los elementos con altas electronegatividades tienden a adquirir electrones en reacciones químicas y se encuentran en la esquina superior derecha de la tabla periódica. Los elementos con bajas electronegatividades tienden a perder electrones en las reacciones químicas y se encuentran en la esquina inferior izquierda de la tabla periódica.
A diferencia de la energía de ionización o la afinidad electrónica, la electronegatividad de un átomo no es una propiedad simple y fija que pueda medirse directamente en un solo experimento. De hecho, la electronegatividad de un átomo debería depender en cierta medida de su entorno químico porque las propiedades de un átomo están influenciadas por sus vecinos en un compuesto químico. Sin embargo, cuando se comparan diferentes métodos para medir la electronegatividad de un átomo, todos tienden a asignar valores relativos similares a un elemento dado. Por ejemplo, todas las escalas predicen que el flúor tiene la mayor electronegatividad y el cesio el más bajo de los elementos estables, lo que sugiere que todos los métodos están midiendo la misma propiedad fundamental.
La electronegatividad es una función de:
- la energía de ionización del átomo (la fuerza con la que el átomo se adhiere a sus propios electrones) y
- la afinidad electrónica del átomo (con qué fuerza atrae el átomo a otros electrones).
Ambas son propiedades del átomo aislado. Un elemento será altamente electronegativo si tiene una gran afinidad electrónica (negativa) y una alta energía de ionización (siempre positiva para átomos neutros). Así, atraerá electrones de otros átomos y resistirá tener sus propios electrones atraídos.
La electronegatividad se define como la capacidad de un átomo en una molécula particular para atraer electrones hacia sí mismo. Cuanto mayor sea el valor, mayor será el atractivo para los electrones.
La Escala de Electronegatividad Pauling
La escala de electronegatividad original, desarrollada en la década de 1930 por Linus Pauling (1901— 1994) se basó en mediciones de las fuerzas de los enlaces covalentes entre diferentes elementos. Pauling fijó arbitrariamente la electronegatividad del flúor en 4.0 (aunque hoy se ha refinado a 3.98), creando así una escala en la que todos los elementos tienen valores entre 0 y 4.0.
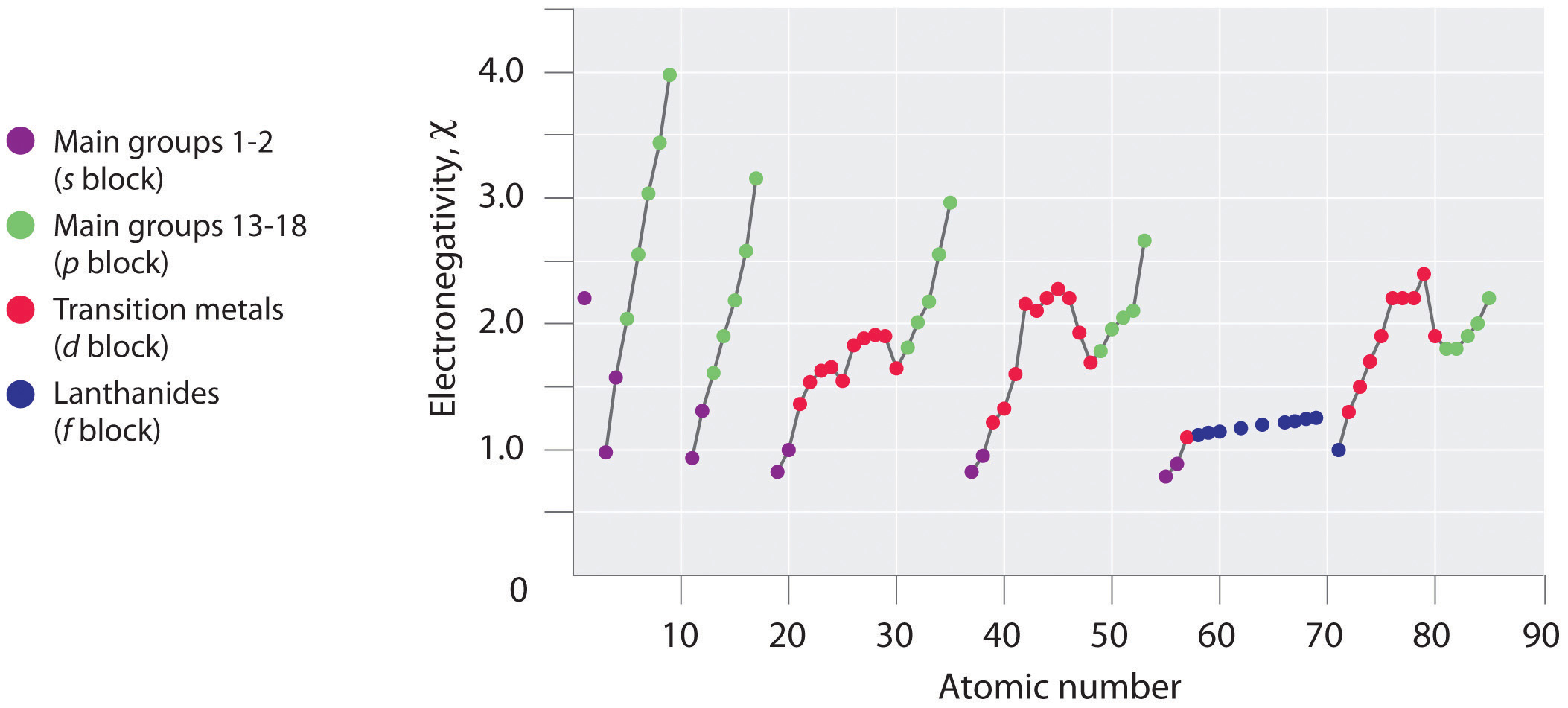
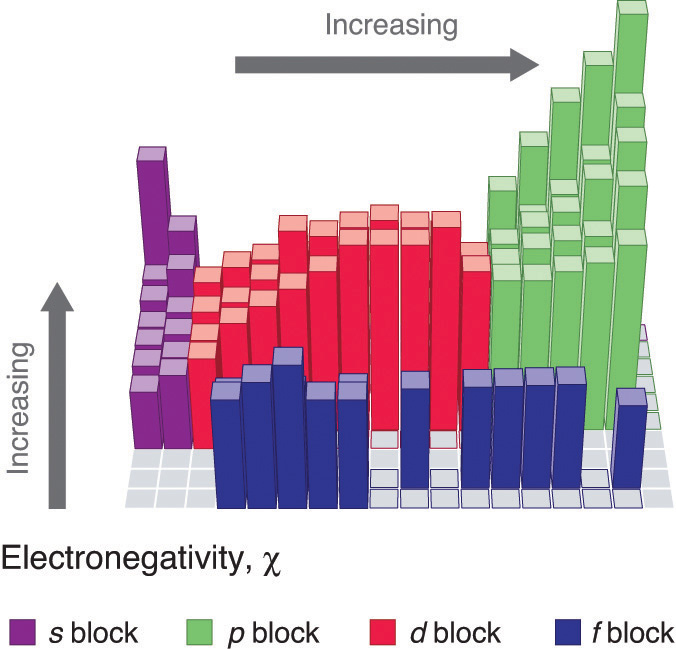
Las variaciones periódicas (tendencias) en los valores de electronegatividad de Pauling se ilustran en Figuras\(\PageIndex{2}\) y\(\PageIndex{3}\). Si ignoramos los gases inertes y elementos para los que no se conocen isótopos estables, vemos que el flúor es el elemento más electronegativo y el cesio es el elemento no radiactivo menos electronegativo. Debido a que las electronegatividades generalmente aumentan diagonalmente desde la parte inferior izquierda hasta la parte superior derecha de la tabla periódica, los elementos que se encuentran en líneas diagonales que van desde la parte superior izquierda hasta la parte inferior derecha tienden a tener valores comparables (por ejemplo, O y Cl, y N, S y Br).
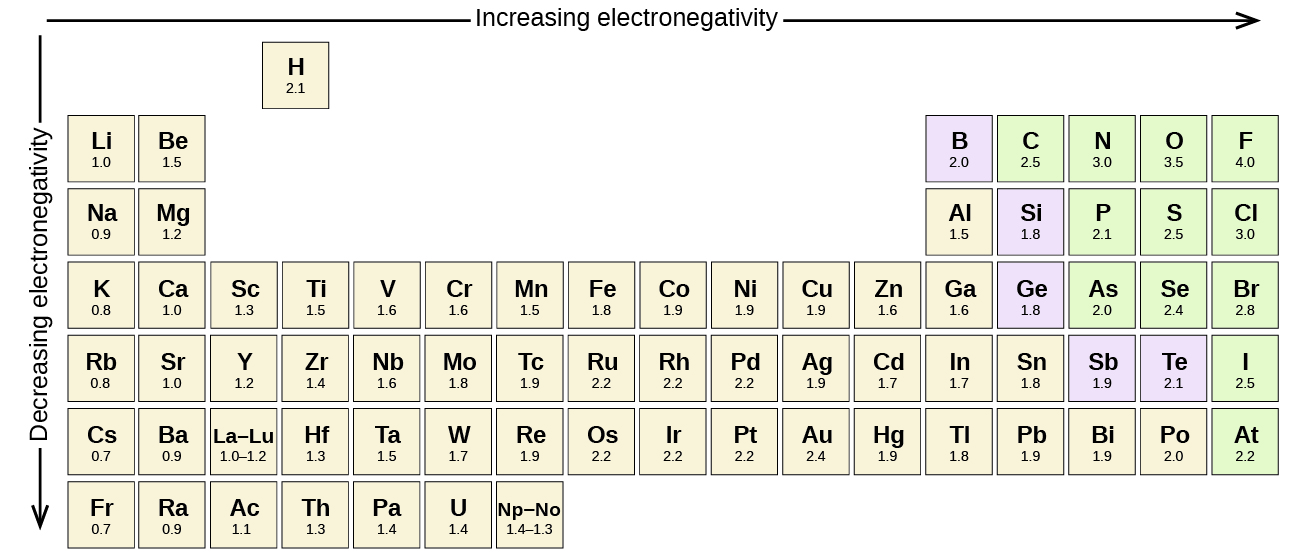
La polaridad de un enlace covalente se puede juzgar determinando la diferencia en las electronegatividades de los dos átomos que forman el enlace. Cuanto mayor sea la diferencia en las electronegatividades, mayor será el desequilibrio del intercambio de electrones en el enlace. Si bien no existen reglas duras y rápidas, la regla general, (ver Figura\(\PageIndex{5}\)), es que si la diferencia en las electronegatividades es menor de aproximadamente 0.4, el enlace se considera no polar; si la diferencia es mayor a 0.4, el enlace se considera polar. Si la diferencia en las electronegatividades es lo suficientemente grande (generalmente mayor que aproximadamente 1.8), el compuesto resultante se considera iónico en lugar de covalente. Una diferencia de electronegatividad de cero, por supuesto, indica un enlace covalente no polar.

Ejemplo\(\PageIndex{1}\)
Describir la diferencia de electronegatividad entre cada par de átomos y la polaridad resultante (o tipo de enlace).
- C y H
- H y H
- Na y Cl
- O y H
Solución
- El carbono tiene una electronegatividad de 2.5, mientras que el valor para hidrógeno es 2.1. La diferencia es 0.4, que es bastante pequeña. Por lo tanto, el enlace C-H se considera no polar.
- Ambos átomos de hidrógeno tienen el mismo valor de electronegatividad: 2.1. La diferencia es cero, por lo que el enlace es no polar.
- La electronegatividad del sodio es 0.9, mientras que la de cloro es 3.0. La diferencia es 2.1, que es bastante alta, y así el sodio y el cloro forman un compuesto iónico.
- Con 2.1 para hidrógeno y 3.5 para oxígeno, la diferencia de electronegatividad es 1.4. Esperaríamos un vínculo muy polar. La distribución de electrones entre O y H es desigual con los electrones más fuertemente atraídos hacia O.
Ejercicio\(\PageIndex{1}\)
Describir la diferencia de electronegatividad (EN) entre cada par de átomos y la polaridad resultante (o tipo de enlace).
- C y O
- K y Br
- N y N
- Cs y F
- Respuesta a:
-
La diferencia EN es 1.0, de ahí polar. La distribución de electrones entre C y O es desigual con los electrones más fuertemente atraídos hacia O.
- Respuesta b:
-
La diferencia EN es mayor a 1.8, de ahí iónica.
- Respuesta c:
-
Los átomos idénticos tienen cero diferencia EN, de ahí no polares.
- Respuesta d:
-
La diferencia EN es mayor a 1.8, de ahí iónica.
Mirando más de cerca: Linus Pauling
Podría decirse que el químico más influyente del siglo XX, Linus Pauling (1901—94) es la única persona que ha ganado dos premios Nobel individuales (es decir, no compartidos). En la década de 1930, Pauling utilizó nuevas teorías matemáticas para enunciar algunos principios fundamentales del vínculo químico. Su libro de 1939 La naturaleza del enlace químico es uno de los libros más significativos jamás publicados en química.
Para 1935, el interés de Pauling se volvió hacia las moléculas biológicas, y fue galardonado con el Premio Nobel de Química 1954 por su trabajo sobre la estructura proteica. (Estuvo muy cerca de descubrir la estructura de doble hélice del ADN cuando James Watson y James Crick anunciaron su propio descubrimiento de su estructura en 1953.) Posteriormente fue galardonado con el Premio Nobel de la Paz de 1962 por sus esfuerzos para prohibir los ensayos de armas nucleares.

Linus Pauling fue uno de los químicos más influyentes del siglo XX.
En sus últimos años, Pauling se convenció de que grandes dosis de vitamina C prevendrían enfermedades, incluido el resfriado común. La mayoría de las investigaciones clínicas no lograron mostrar una conexión, pero Pauling continuó tomando grandes dosis diariamente. Murió en 1994, habiendo pasado toda una vida estableciendo un legado científico que pocos jamás igualarán.

