4.10: Moléculas polares
- Page ID
- 72805
Objetivos de aprendizaje
- Reconocer las características de enlace de los compuestos covalentes: longitud de enlace y polaridad de enlace.
- Utilice valores de electronegatividad para predecir la polaridad del enlace.
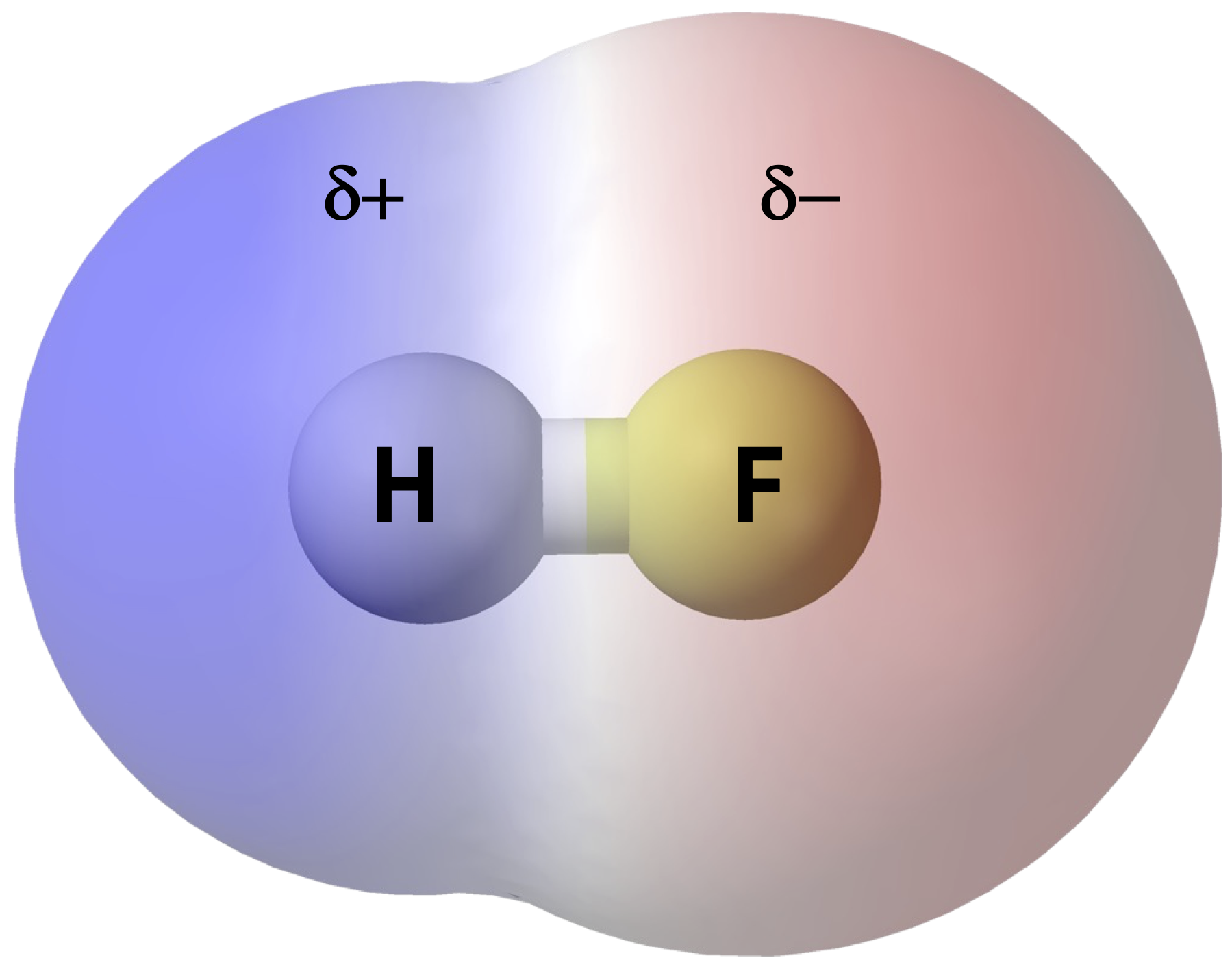
Si solo hay un enlace en la molécula, la polaridad del enlace determina la polaridad molecular. Cualquier molécula diatómica en la que los dos átomos sean el mismo elemento debe ser una molécula no polar. Una molécula diatómica que consiste en un enlace covalente polar, como HF, es una molécula polar donde un extremo de la molécula es ligeramente positivo, mientras que el otro extremo es ligeramente negativo. Las dos regiones cargadas eléctricamente en cada extremo de la molécula se denominan polos, similares a un imán que tiene un polo norte y otro sur. De ahí que una molécula con dos polos tenga un momento dipolar.
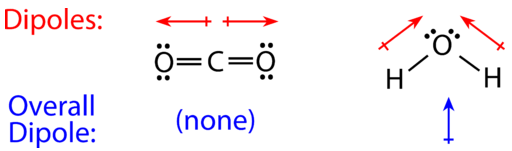
Para las moléculas con más de dos átomos, también se debe tomar en cuenta la geometría molecular a la hora de determinar si la molécula es polar o no polar. La siguiente figura muestra una comparación entre dióxido de carbono y agua.
\(\left( \ce{CO_2} \right)\)El dióxido de carbono es una molécula lineal con carbono en el centro y dos oxígenos en los extremos terminales. Los átomos de oxígeno son más electronegativos que el átomo de carbono, por lo que hay dos dipolos individuales que apuntan hacia afuera desde el\(\ce{C}\) átomo hacia cada\(\ce{O}\) átomo. Sin embargo, dado que los dipolos son de igual fuerza y apuntan en direcciones opuestas, se cancelan y la polaridad molecular global de\(\ce{CO_2}\) es cero (sin dipolo neto), por lo tanto\(\ce{CO_2}\) es una molécula no polar.
El agua tiene una estructura molecular doblada porque tiene cuatro grupos de electrones, dos grupos enlazados y dos grupos de electrones solitarios en el átomo de oxígeno central. Los dipolos individuales del enlace O-H apuntan desde los\(\ce{H}\) átomos ligeramente positivos hacia el\(\ce{O}\) átomo más electronegativo. Debido a la forma doblada, los dipolos, que son iguales en fuerza, ambos apuntan hacia el átomo de oxígeno y no se cancelarán entre sí, por lo tanto, la molécula de agua es polar. En la siguiente figura, se puede ver que el extremo de oxígeno de la molécula es ligeramente negativo y el lado del hidrógeno es ligeramente positivo, hay una separación de carga a lo largo de toda la molécula, un dipolo neto (mostrado en azul) que apunta hacia arriba.
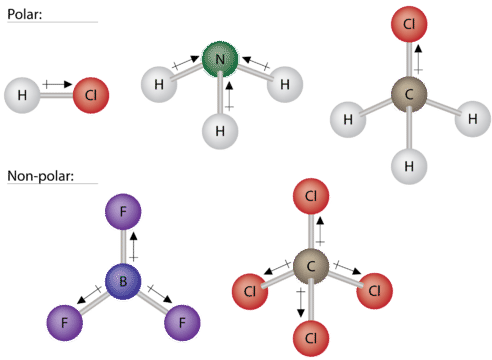
Algunas otras moléculas se muestran en la siguiente figura. Observe que una molécula tetraédrica como\(\ce{CH_4}\) es no polar. Sin embargo, si uno de los\(\ce{H}\) átomos periféricos es reemplazado por otro átomo que tiene una electronegatividad diferente, la molécula se vuelve polar. Una molécula plana trigonal\(\left( \ce{BF_3} \right)\) puede ser no polar si los tres átomos periféricos son iguales, pero una molécula piramidal trigonal\(\left( \ce{NH_3} \right)\) es polar.
Para resumir, para ser polar, una molécula debe:
- Contienen al menos un enlace covalente polar.
- Tener una estructura molecular tal que la suma de los vectores de cada momento dipolo enlace no cancele.
- Dibuja la estructura de Lewis.
- Determinar la geometría (usando la teoría VSEPR).
- Visualiza o dibuja la geometría.
- Encuentra el momento dipolo neto (no tienes que hacer cálculos si puedes visualizarlo).
- Si el momento dipolo neto es cero, es no polar. De lo contrario, es polar.
Propiedades de Moléculas Polares
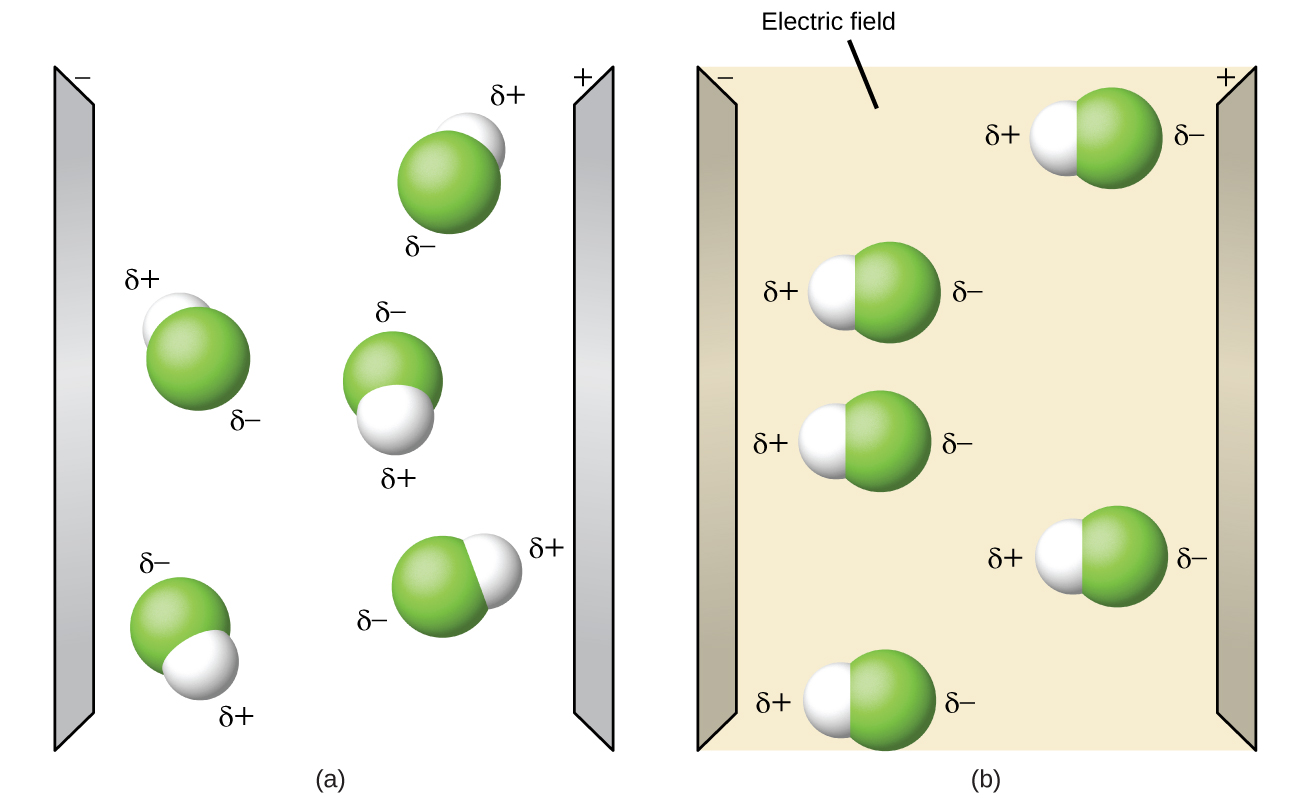
Las moléculas polares tienden a alinearse cuando se colocan en un campo eléctrico con el extremo positivo de la molécula orientado hacia la placa negativa y el extremo negativo hacia la placa positiva (Figura\(\PageIndex{4}\)). Podemos usar un objeto cargado eléctricamente para atraer moléculas polares, pero las moléculas no polares no son atraídas. Además, los solventes polares son mejores para disolver sustancias polares, y los solventes no polares son mejores para disolver sustancias no polares.
Si bien las moléculas pueden describirse como “covalentes polares” o “iónicas”, hay que señalar que este suele ser un término relativo, siendo una molécula simplemente más polar o menos polar que otra. Sin embargo, las siguientes propiedades son típicas de tales moléculas. Las moléculas polares tienden a:
- tienen puntos de fusión más altos que las moléculas no polares
- tienen puntos de ebullición más altos que las moléculas no polares
- ser más soluble en agua (disolver mejor) que las moléculas no polares
- tienen presiones de vapor más bajas que las moléculas no polares
La siguiente simulación es muy útil para explorar más sobre el enlace y la polaridad molecular. Explore por su cuenta o use el ejercicio y los ejemplos a continuación.
Abra la simulación de polaridad de la molécula (arriba) y seleccione la pestaña “Tres átomos” en la parte superior. Esto debería mostrar una molécula ABC con tres ajustadores de electronegatividad. Puede mostrar u ocultar los momentos de enlace, los dipolos moleculares y las cargas parciales a la derecha. Al encender el Campo Eléctrico se mostrará si la molécula se mueve cuando se expone a un campo.
Use los controles de electronegatividad para determinar cómo buscará el dipolo molecular para la molécula doblada inicial si:
- A y C son muy electronegativos y B está en el medio del rango.
- A es muy electronegativo, y B y C no lo son.
Solución
- El momento dipolo molecular apunta inmediatamente entre A y C.
- El momento dipolo molecular apunta a lo largo del enlace A—B, hacia A.
Determinar las cargas parciales que darán los dipolos de enlace más grandes posibles.
- Contestar
-
Los momentos de bonos más grandes se producirán con los mayores cargos parciales. Las dos soluciones anteriores representan cuán desigualmente se comparten los electrones en el enlace. Los momentos de vínculo se maximizarán cuando la diferencia de electronegatividad sea mayor. Los controles para A y C deben establecerse en un extremo, y B debe establecerse en el extremo opuesto. Si bien la magnitud del momento de unión no cambiará en función de si B es el más electronegativo o el menor, la dirección del momento de enlace lo hará.

