8.11: Presiones parciales y Ley de Dalton
- Page ID
- 73334
La ley de gas ideal también se puede reorganizar para mostrar que la presión de un gas es proporcional a la cantidad de gas:
\[P=\frac{RT}{V}\,n\label{1} \]
Así, el factor RT/V puede ser utilizado para interconvertir cantidad de sustancia y presión en un recipiente de volumen y temperatura especificados.
\(\ref{1}\)La ecuación también es útil para tratar la situación en la que dos o más gases están confinados en un mismo contenedor (es decir, el mismo volumen). Supongamos, por ejemplo, que tenemos 0.010 mol de un gas en un recipiente de 250 ml a una temperatura de 32°C.
\[\begin{align}P & =\frac{RT}{V}\,n =\frac{\text{0}\text{.0820 liter atm mol}^{-\text{1}}\text{ K}^{-\text{1}}\,\times \text{ 305 K}}{\text{0}\text{.250 liter}}\,\times \text{ 0}\text{.010 mol}\\ & =\text{1}\text{.00 atm}\end{align} \nonumber \]
Ahora supongamos que llenamos el mismo recipiente con 0.004 mol H 2 (g) a la misma temperatura. La presión sería
\[\begin{align}p_{\text{H}_{\text{2}}} & =\frac{\text{0}\text{.0820 liter atm mol}^{-\text{1}}\text{ K}^{-\text{1}}\,\times \text{ 305 K}}{\text{0}\text{.250 liter}}\,\times \text{ 0}\text{.004 mol}\\ & =\text{0}\text{.40 atm}\end{align} \nonumber \]
Si ponemos 0.006 mol N 2 en el contenedor,
\[p_{\text{N}_{\text{2}}}=\frac{\text{0}\text{.0820 liter atm mol}^{-\text{1}}\text{ K}^{-\text{1}}\,\times \text{ 305 K}}{\text{0}\text{.250 liter}}\,\times \text{ 0}\text{.006 mol}=\text{0}\text{.60 atm} \nonumber \]
Ahora supongamos que ponemos tanto los 0.004 mol H 2 como los 0.006 mol N 2 en el mismo matraz juntos. ¿Cuál sería la presión? Dado que la ley de gas ideal no depende del gas que tengamos sino sólo de la cantidad de cualquier gas, la presión del (0.004 + 0.006) mol, o 0.010 mol, sería exactamente lo que obtuvimos en nuestro primer cálculo. Pero esta es solo la suma de la presión que ejercería H 2 si ocupara solo el contenedor más la presión de N 2 si fuera el único gas presente. Es decir,
\[P_{total} = p_{\text{H}_{2}} + p_{\text{N}_{2}} \nonumber \]
La siguiente figura demuestra el concepto de presión parcial en términos más concretos, mostrando la presión de cada gas solo en un contenedor y luego mostrando la presión combinada de gases una vez mezclados.

Acabamos de sacar un ejemplo de la ley de Dalton de presiones parciales (llamada así por John Dalton, su descubridor). Esta ley establece que en una mezcla de dos o más gases, la presión total es la suma de las presiones parciales de todos los componentes. La presión parcial de un gas es la presión que ejercería el gas si ocupara el contenedor por sí mismo. La presión parcial está representada por una letra minúscula p.
La ley de Dalton de presiones parciales se encuentra más comúnmente cuando un gas es recolectado por desplazamiento de agua, como se muestra en la Figura 2.
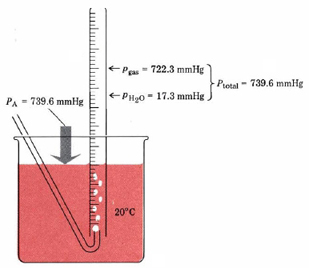
Debido a que el gas ha sido burbujeado a través del agua, contiene algunas moléculas de agua y se dice que está “húmedo”. La presión total de este gas húmedo es la suma de la presión parcial del propio gas y la presión parcial del vapor de agua que contiene. Esta última presión parcial se llama presión de vapor del agua. Depende únicamente de la temperatura del experimento y puede obtenerse de un manual o de la Tabla 1.
| Temperatura (°C) | Presión de vapor (mmHg) | Presión de vapor (kPa) |
|---|---|---|
| 0 | 4.6 | 0.61 |
| 5 | 6.5 | 0.87 |
| 10 | 9.2 | 1.23 |
| 15 | 12.8 | 1.71 |
| 20 | 17.5 | 2.33 |
| 25 | 23.8 | 3.17 |
| 30 | 31.8 | 4.24 |
| 50 | 92.5 | 12.33 |
| 70 | 233.7 | 31.16 |
| 75 | 289.1 | 38.63 |
| 80 | 355.1 | 47.34 |
| 85 | 433.6 | 57.81 |
| 90 | 525.8 | 70.10 |
| 95 | 633.9 | 84.51 |
| 100 | 760.0 | 101.32 |
Supongamos que se dejan reaccionar 0.321 g de zinc metálico con exceso de ácido clorhídrico (una solución acuosa de gas HCl) de acuerdo con la ecuación
\[\text{Zn} (s) + 2 \text{HCL} (aq) \rightarrow \text{Zn} \text{Cl}_{2} (aq) + \text{H}_{2} (g) \nonumber \]
El gas hidrógeno resultante se recoge sobre agua a 25°C, mientras que la presión barométrica es de 745.4 mmHg. ¿Qué volumen de hidrógeno húmedo se recogerá?
Solución Del Cuadro 1 encontramos que a 25°C la presión de vapor del agua es de 23.8 mmHg. En consecuencia
p H 2 = p total — p H 2 O = 754 mmHg — 23.8 mmHg = 721.6 mmHg.
Esto debe convertirse en unidades compatibles R:
\[p_{\text{H}_{\text{2}}}=\text{721}\text{.6 mmHg }\times \,\frac{\text{1 atm}}{\text{760 mmHg}}=\text{0}\text{.949 atm} \nonumber \]
La hoja de ruta para este problema es
\[m_{\text{Zn}}\xrightarrow{M_{\text{Zn}}}n_{\text{Zn}}\xrightarrow{S\left( \text{H}_{\text{2}}\text{/Zn} \right)}n_{\text{H}_{\text{2}}}\xrightarrow{RT/P}V_{\text{H}_{\text{2}}} \nonumber \]
Por lo tanto
\[\begin{align}V_{\text{H}_{\text{2}}} & =\text{0}\text{.321 g Zn }\times \,\frac{\text{1 mol Zn}}{\text{65}\text{.38 g Zn}}\,\times \,\frac{\text{1 mol H}_{\text{2}}}{\text{2 mol Zn}}\,\times \,\frac{\text{0}\text{.0820 liter atm}}{\text{1 K mol H}_{\text{2}}}\,\times \,\frac{\text{293}\text{0.15 K}}{\text{0}\text{.987 atm}}\\ & =\text{0}\text{.126 liter}\end{align} \nonumber \]


