6.14: Lantánidos y Actínidos
- Page ID
- 70573
¿Cuántas muñecas hay en esta imagen?
Las “muñecas de anidación” rusas (a menudo conocidas como muñecas matryoshka) tienen una larga historia en Rusia. Estas muñecas están diseñadas para anidar una dentro de la otra. Cuando abrimos la muñeca más grande, encontramos una muñeca un poco más pequeña dentro de ella. Estas muñecas a menudo pueden bajar siete u ocho capas, y algunas tienen más de treinta y cinco capas.
Lantánidos y Actínidos
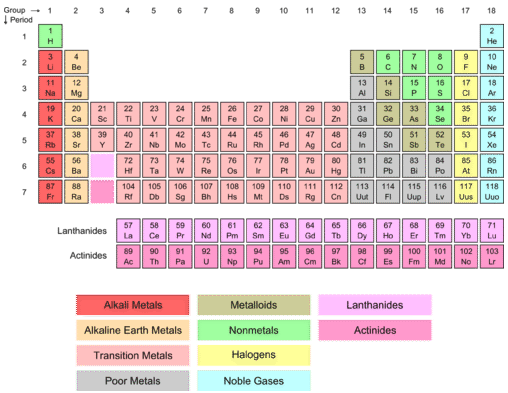
Vemos algunas “capas” ocultas en la química. Examinando la siguiente tabla periódica, son visibles dos cajas rosadas, una entre\(\ce{Ba}\) (elemento 56) y\(\ce{Hf}\) (elemento 72) y la otra entre\(\ce{Ra}\) (88) y\(\ce{Rf}\) (104). Todos estos elementos tienen\(f\) -subniveles sin llenar. Debido a la singularidad de las configuraciones electrónicas, estos elementos encajan en las dos cajas de la tabla periódica más grande.
A medida que aumenta el número de electrones en un átomo, comenzamos a ver algunos comportamientos extraños. Debido a la forma en que funcionan los niveles de energía electrónica, algunos niveles internos se llenan después de que una o más capas externas lo hacen. Esto lo vemos en dos grupos similares de elementos: los lantánidos y los actínidos.
El\(f\) -Block
El primero de los\(f\) subniveles en comenzar a llenar es el\(4f\) subnivel. Se llena después del\(6s\) subnivel, lo que significa que\(f\) los subniveles son dos niveles principales de energía detrás. La configuración general de electrones para los elementos en el \(f\)bloque -es\(\left( n-2 \right) f^{1-14} ns^2\). Los siete orbitales del\(f\) subnivel acomodan 14 electrones, por lo que el\(f\) bloque tiene 14 elementos de longitud. Se saca del cuerpo principal de la tabla periódica y se muestra en la parte inferior. Debido a eso, los elementos del\(f\) bloque no pertenecen a un grupo, quedando acuñados entre los Grupos 3 y 4. Los lantánidos son los 14 elementos desde el cerio (número atómico 58) hasta el lutecio (número atómico 71). La palabra proviene del griego "\(\lambda \alpha \nu \theta \alpha \nu \epsilon \iota \nu \)" que significa “estar oculto”. El nombre probablemente surgió porque todos estos elementos se esconden uno detrás del otro en la tabla periódica. El\(4f\) subnivel está en proceso de ser llenado para los lantánidos. Todos son metales y son similares en reactividad a los metales alcalinotérreos del Grupo 2.
Los actínidos son los 14 elementos que van desde torio (número atómico 90) hasta el larguero (número atómico 103). El\(5f\) subnivel está en proceso de ser llenado. Los actínidos son todos elementos radiactivos y sólo los cuatro primeros se han encontrado de forma natural en la Tierra. Todos los demás sólo han sido hechos artificialmente en el laboratorio. Los lantánidos y actínidos juntos a veces se denominan elementos de transición internos.
Usos de los lantánidos
Los lantánidos se han utilizado ampliamente como aleaciones para impartir resistencia y dureza a los metales. El lantánido principal utilizado para este propósito es el cerio, mezclado con pequeñas cantidades de lantano, neodimio y praseodimio. Estos metales también son ampliamente utilizados en la industria petrolera para refinar petróleo crudo en productos de gasolina.

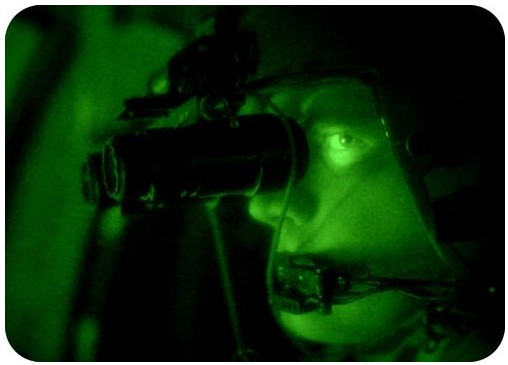
El erbio y otros lantánidos son ampliamente utilizados en algunos dispositivos ópticos, como gafas de visión nocturna, rayos láser y materiales fosforescentes.
Usos de Actínidos
Los actínidos son valiosos principalmente porque son radiactivos. Estos elementos pueden ser utilizados como fuentes de energía para aplicaciones tan variadas como los marcapasos cardíacos, a la generación de energía eléctrica para instrumentos en la luna. El uranio y el plutonio han sido empleados en armas nucleares y en centrales nucleares.

Resumen
- Los lantánidos y actínidos son elementos con\(f\) orbitales sin llenar.
- Los lantánidos son todos metales con reactividad similar a los elementos del grupo 2.
- Los actínidos son todos elementos radiactivos.
- Los lantánidos se utilizan en dispositivos ópticos (gafas de visión nocturna), refinación de petróleo y aleaciones.
- Los actínidos se encuentran principalmente en aplicaciones donde su radiactividad puede ser utilizada para alimentar dispositivos como marcapasos cardíacos.
Revisar
- ¿Qué subnivel de electrones se está llenando en los lantánidos?
- ¿Qué subnivel de electrones se está llenando en los actínidos?
- ¿Qué subnivel se llena justo antes del llenado de este subnivel?
- ¿Qué actínidos se encuentran naturalmente en la tierra?
- Enumere algunos usos para lantánidos.
- Enumere algunos usos para actínidos.

