7.3: Trabajo y Calor
- Page ID
- 75025
- Definir un tipo de trabajo en términos de presión y volumen.
- Definir calor.
- Relacionar la cantidad de calor con un cambio de temperatura.
Ya hemos definido el trabajo como una fuerza que actúa a través de la distancia. Existen otras definiciones equivalentes de trabajo que también son importantes en química.
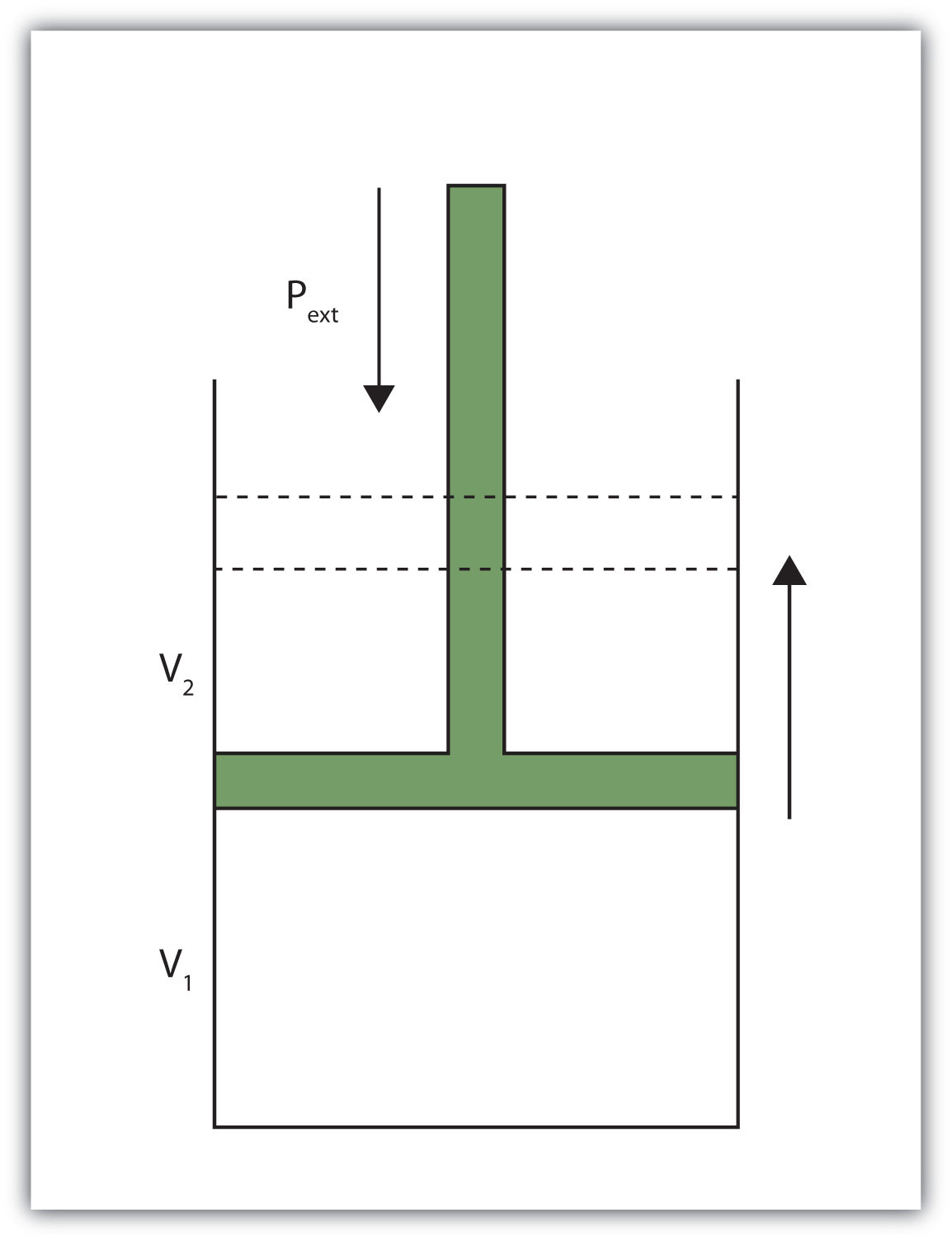
Cuando un cierto volumen de un gas se expande, funciona contra una presión externa para expandirse (Figura\(\PageIndex{1}\) - Volumen versus Presión). Es decir, el gas debe realizar trabajos. Suponiendo que la presión externa P ext es constante, la cantidad de trabajo realizado por el gas viene dada por la ecuación
\[w = −P_{ext} × ΔV \nonumber \]
donde\(ΔV\) esta el cambio en el volumen del gas. Este término es siempre el volumen final menos el volumen inicial,
\[ΔV = V_{final} − V_{initial} \nonumber \]
y puede ser positivo o negativo, dependiendo de si V final es mayor (se está expandiendo) o menor (se contrae) que V inicial. El signo negativo en la ecuación para el trabajo es importante e implica que a medida que se expande el volumen (Δ V es positivo), el gas en el sistema está perdiendo energía como trabajo. Por otro lado, si el gas se está contrayendo, Δ V es negativo, y los dos signos negativos hacen que el trabajo sea positivo, por lo que se está sumando energía al sistema.
Por último, consideremos las unidades. Los cambios de volumen generalmente se expresan en unidades como litros, mientras que las presiones generalmente se expresan en atmósferas. Cuando usamos la ecuación para determinar el trabajo, la unidad para el trabajo sale como litro·atmósferas, o l·atm. Esta no es una unidad muy común para el trabajo. Sin embargo, existe un factor de conversión entre l·atm y la unidad común de trabajo, julios:
1 L·atm = 101.32 J
Utilizando este factor de conversión y la ecuación anterior para el trabajo, podemos calcular el trabajo realizado cuando un gas se expande o se contrae.
¿Cuál es el trabajo que realiza un gas si se expande de 3.44 L a 6.19 L contra una presión externa constante de 1.26 atm? Expresar la respuesta final en julios.
Solución
Primero necesitamos determinar el cambio de volumen, Δ V. Un cambio es siempre el valor final menos el valor inicial:
Δ V = V final − V inicial = 6.19 L − 3.44 L = 2.75 L
Ahora podemos usar la definición de trabajo para determinar el trabajo realizado:
w = − P ext · Δ V = − (1.26 atm) (2.75 L) = −3.47 l·atm
Ahora construimos un factor de conversión a partir de la relación entre litro·atmósferas y julios:
\[-3.47\cancel{L.atm}\times \times \frac{101.32\, J}{1\cancel{L.atm}}=-351\, J\nonumber \]
Limitamos la respuesta final a tres cifras significativas, según corresponda.
¿Cuál es el trabajo realizado cuando un gas se expande de 0.66 L a 1.33 L contra una presión externa de 0.775 atm?
- Contestar
-
−53 J
El calor es otro aspecto de la energía. El calor es la transferencia de energía de un cuerpo a otro debido a una diferencia de temperatura. Por ejemplo, cuando tocamos algo con nuestras manos, interpretamos ese objeto como caliente o frío dependiendo de cómo se transfiera la energía: Si la energía se transfiere a tus manos, el objeto se siente caliente. Si la energía se transfiere de tus manos al objeto, tus manos se sienten frías. Debido a que el calor es una medida de la transferencia de energía, el calor también se mide en julios.
Para un objeto dado, la cantidad de calor (q) involucrada es proporcional a dos cosas: la masa del objeto (\(m\)) y el cambio de temperatura (\(ΔT\)) evocado por la transferencia de energía. Podemos escribir esto matemáticamente como
\[q\alpha \, m\times \Delta T\nonumber \]
donde ∝ significa “es proporcional a”. Para hacer de una proporcionalidad una igualdad, incluimos una constante de proporcionalidad. En este caso, la constante de proporcionalidad se etiqueta c y se llama la capacidad calorífica específica, o, más sucintamente, calor específico:
\ [q = mCδt\ nonumber\]
donde la masa, el calor específico y el cambio de temperatura se multiplican entre sí. El calor específico es una medida de cuánta energía se necesita para cambiar la temperatura de una sustancia; cuanto mayor sea el calor específico, más energía se necesita para cambiar la temperatura. Las unidades para calor específico son
dependiendo de cuál\(ΔT\) sea la unidad. Se puede notar una desviación de la insistencia en que la temperatura se exprese en Kelvin. Eso se debe a que un cambio de temperatura tiene el mismo valor ya sea que las temperaturas se expresen en grados Celsius o Kelvin.
Calcular el calor involucrado cuando 25.0 g de Fe aumentan la temperatura de 22°C a 76°C. El calor específico de Fe es 0.449 J/g·°C.
Solución
Primero tenemos que determinar Δ T. Un cambio es siempre el valor final menos el valor inicial:
Δ T = 76°C − 22°C = 54°C
Ahora podemos usar la expresión para q, sustituir todas las variables y resolver por calor:
\[q=(25.0\, g)(0.449\frac{J}{g.^{\circ}C})(54^{\circ}C)=610\, J\nonumber \]
Observe cómo cancelan las unidades g y °C, dejando J, una unidad de calor. También tenga en cuenta que este valor de q es inherentemente positivo, es decir, que la energía va entrando al sistema.
Calcular el calor involucrado cuando 76.5 g de Ag aumentan la temperatura de 17.8°C a 144.5°C.El calor específico de Ag es 0.233 J/g·°C.
- Contestar
-
2,260 J
Como con cualquier ecuación, cuando conoces todas las variables menos una en la expresión para q, puedes determinar la variable restante usando álgebra.
Se necesitan 5,408 J de calor para elevar la temperatura de 373 g de Hg en 104°C ¿Cuál es el calor específico de Hg?
Solución
Podemos comenzar con la ecuación para q, pero ahora se dan diferentes valores, y necesitamos resolver para calor específico. Obsérvese que Δ T se da directamente como 104°C. Sustituyendo,
5,408 J = (373 g) c (104°C)
Dividimos ambos lados de la ecuación entre 373 g y 104°C:
\[c=\frac{5408\, J}{(373g)(104^{\circ}C)}\nonumber \]
Combinando los números y reuniendo todas las unidades, obtenemos
\[c=0.139\frac{J}{g.^{\circ}C}\nonumber \]
El oro tiene un calor específico de 0.129 J/g·°C. Si se necesitan 1,377 J para aumentar la temperatura de una muestra de oro en 99.9°C, ¿cuál es la masa del oro?
- Contestar
-
107 g
Tabla\(\PageIndex{1}\): Calores Específicos de Sustancias Diversas, enumera los calores específicos de algunas sustancias. El calor específico es una propiedad física de las sustancias, por lo que es una característica de la sustancia. La idea general es que cuanto menor sea el calor específico, menos energía se requiere para cambiar la temperatura de la sustancia en cierta cantidad.
| Sustancia | Calor Específico (J/g·°C) |
|---|---|
| agua | 4.184 |
| hierro | 0.449 |
| oro | 0.129 |
| mercurio | 0.139 |
| aluminio | 0.900 |
| alcohol etílico | 2.419 |
| magnesio | 1.03 |
| helio | 5.171 |
| oxígeno | 0.918 |
Principales conclusiones
- El trabajo se puede definir como un volumen de cambio de gas contra una presión externa constante.
- El calor es la transferencia de energía debido a las diferencias de temperatura.
- El calor se puede calcular en términos de masa, cambio de temperatura y calor específico.


