10.2: Fuerzas intermoleculares
- Page ID
- 74780
- Relacionar la fase con las fuerzas intermoleculares.
¿Por qué una sustancia tiene la fase que tiene? La fase preferida de una sustancia en un conjunto dado de condiciones es un equilibrio entre la energía de las partículas y las fuerzas intermoleculares (o interacciones intermoleculares) entre las partículas. Si las fuerzas entre partículas son lo suficientemente fuertes, la sustancia es un líquido o, si es más fuerte, un sólido. Si las fuerzas entre partículas son débiles y hay suficiente energía presente, las partículas se separan entre sí, por lo que la fase gaseosa es la fase preferida. La energía de las partículas está determinada principalmente por la temperatura, por lo que la temperatura es la principal variable que determina qué fase es estable en cualquier punto dado.
¿Qué fuerzas definen las interacciones intermoleculares? Hay varios. Una fuerza presente en todas las sustancias con electrones es la fuerza de dispersión (a veces llamada la fuerza de dispersión de Londres, después del físico Fritz London, quien describió por primera vez esta fuerza a principios del siglo XX). Esta interacción es causada por la posición instantánea de un electrón en una molécula, lo que temporalmente hace que ese punto de la molécula esté cargado negativamente y el resto de la molécula cargado positivamente. En un instante, el electrón está ahora en otro lugar, pero el desequilibrio fugaz de la carga eléctrica en la molécula permite que las moléculas interactúen entre sí. Como cabría esperar, cuanto mayor sea el número de electrones en una especie, más fuerte será la fuerza de dispersión; esto explica parcialmente por qué las moléculas más pequeñas son gases y las moléculas más grandes son líquidos y sólidos a la misma temperatura. (La masa también es un factor.)
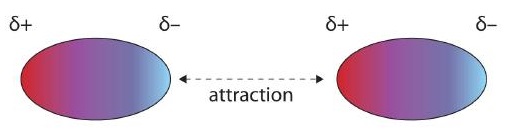
Las moléculas con un momento dipolo permanente experimentan interacciones dipolo-dipolo, que generalmente son más fuertes que las fuerzas de dispersión si todas las demás cosas son iguales. Los extremos cargados opuestamente de una molécula polar, que tienen cargas parciales sobre ellos, se atraen entre sí (Figura\(\PageIndex{1}\)). Así, una molécula polar como CH 2 Cl 2 tiene un punto de ebullición significativamente mayor (313 K, o 40°C) que una molécula no polar como CF 4 (145 K, o −128°C), aunque tiene una menor masa molar (85 g/mol vs. 88 g/mol).
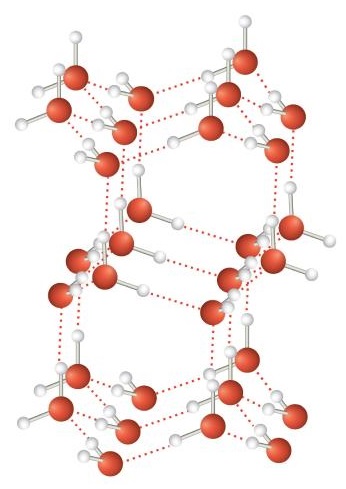
Una forma inusualmente fuerte de interacción dipolo-dipolo se llama enlace de hidrógeno. Los enlaces de hidrógeno se encuentran en moléculas con un átomo de H unido a un átomo de N, un átomo de O o un átomo de F. Dichos enlaces covalentes son muy polares, y la interacción dipolo-dipolo entre estos enlaces en dos o más moléculas es lo suficientemente fuerte como para crear una nueva categoría de fuerza intermolecular. Los enlaces de hidrógeno son la razón por la que el agua tiene propiedades inusuales Para una molécula tan pequeña (su masa molar es de solo 18 g/mol), H 2 O tiene puntos de fusión y ebullición relativamente altos. Su punto de ebullición es de 373 K (100°C), mientras que el punto de ebullición de una molécula similar, H 2 S, es de 233 K (−60°C). Esto se debe a que las moléculas H 2 O experimentan enlaces de hidrógeno, mientras que las moléculas H 2 S no. Esta fuerte atracción entre las moléculas de H 2 O requiere energía adicional para separar las moléculas en la fase condensada, por lo que su punto de ebullición es mayor de lo esperado. Los enlaces de hidrógeno también son responsables de la capacidad del agua como solvente, su alta capacidad calorífica y su capacidad de expandirse al congelarse; las moléculas se alinean de tal manera que hay espacio extra entre las moléculas, aumentando su volumen en estado sólido (Figura\(\PageIndex{2}\)).
Identificar la fuerza intermolecular más significativa en cada sustancia.
- C 3 H 8
- CH 3 OH
- H 2 S
Solución
- Aunque los enlaces C—H son polares, solo son mínimamente polares. La fuerza intermolecular más significativa para esta sustancia serían las fuerzas de dispersión.
- Esta molécula tiene un átomo de H unido a un átomo de O, por lo que experimentará enlaces de hidrógeno.
- Aunque esta molécula no experimenta enlaces de hidrógeno, el diagrama de puntos electrónicos de Lewis y VSEPR indican que está doblada, por lo que tiene un dipolo permanente. La fuerza más significativa en esta sustancia es la interacción dipolo-dipolo.
Identificar la fuerza intermolecular más significativa en cada sustancia.
- HF
- HCl
RESPUESTAS
- enlaces de hidrógeno
- interacciones dipolo-dipolo
La fase preferida que adopta una sustancia puede cambiar con la temperatura. A bajas temperaturas, la mayoría de las sustancias son sólidas (solo se prevé que el helio sea líquido a cero absoluto). A medida que aumenta la temperatura, aquellas sustancias con fuerzas intermoleculares muy débiles se convierten en gases directamente (en un proceso llamado sublimación, que se discutirá en la Sección 10.3). Las sustancias con interacciones débiles pueden convertirse en líquidos a medida que aumenta la temperatura. A medida que la temperatura aumente aún más, las partículas individuales tendrán tanta energía que se superen las fuerzas intermoleculares, por lo que las partículas se separan entre sí, y la sustancia se convierte en un gas (asumiendo que sus enlaces químicos no son tan débiles como para que el compuesto se descomponga del alto temperatura). Aunque es difícil predecir los rangos de temperatura para los cuales sólido, líquido o gas es la fase preferida para cualquier sustancia aleatoria, todas las sustancias progresan de sólido a líquido a gas (en ese orden) a medida que aumenta la temperatura.
Resumen
- Todas las sustancias experimentan fuerzas de dispersión entre sus partículas.
- Las sustancias polares experimentan interacciones dipolo-dipolo.
- Las sustancias con enlaces covalentes entre un átomo de H y átomos de N, O o F experimentan enlaces de hidrógeno.
- La fase preferida de una sustancia depende de la fuerza de la fuerza intermolecular y de la energía de las partículas.


