10.3: Transiciones de Fase - Fusión, Hervir y Sublimar
- Page ID
- 74788
- Describir lo que ocurre durante un cambio de fase.
- Calcular el cambio de energía necesario para un cambio de fase.
Las sustancias pueden cambiar de fase, a menudo debido a un cambio de temperatura. A bajas temperaturas, la mayoría de las sustancias son sólidas; a medida que aumenta la temperatura, se vuelven líquidas; a temperaturas más altas aún, se vuelven gaseosas.
El proceso de que un sólido se convierta en líquido se llama fusión (un término más antiguo que puede ver a veces es fusión). Al proceso contrario, un líquido convirtiéndose en sólido, se llama solidificación. Para cualquier sustancia pura, la temperatura a la que se produce la fusión, conocida como punto de fusión, es una característica de esa sustancia. Requiere energía para que un sólido se derrita en un líquido. Toda sustancia pura tiene una cierta cantidad de energía que necesita para cambiar de un sólido a un líquido. Esta cantidad se denomina entalpía de fusión (o calor de fusión) de la sustancia, representada como Δ H fus. Algunos valores de Δ H fus se listan en la Tabla\(\PageIndex{1}\); se supone que estos valores son para el punto de fusión de la sustancia. Tenga en cuenta que la unidad de Δ H fus es kilojulios por mol, por lo que necesitamos conocer la cantidad de material para saber cuánta energía está involucrada. El Δ H fus siempre se tabula como un número positivo. Sin embargo, se puede utilizar tanto para los procesos de fusión como de solidificación, pensando en que la fusión siempre es endotérmica (por lo que Δ H será positiva), mientras que la solidificación es siempre exotérmica (por lo que Δ H será negativa).
| Sustancia (punto de fusión) | Δ H fus (kJ/mol) |
|---|---|
| Agua (0°C) | 6.01 |
| Aluminio (660°C) | 10.7 |
| Benceno (5.5°C) | 9.95 |
| Etanol (−114.3°C) | 5.02 |
| Mercurio (−38.8°C) | 2.29 |
¿Cuál es el cambio de energía cuando 45.7 g de\(\ce{H2O}\) fusión a 0°C?
Solución
El\(ΔH_{fus}\) de\(\ce{H2O}\) es 6.01 kJ/mol. No obstante, nuestra cantidad se da en unidades de gramos, no en moles, por lo que el primer paso es convertir gramos en moles usando la masa molar de\(\ce{H_2O}\), que es de 18.0 g/mol. Entonces podemos usar\(ΔH_{fus}\) como factor de conversión. Debido a que la sustancia se está derritiendo, el proceso es endotérmico, por lo que el cambio energético tendrá un signo positivo.
\[45.7\cancel{g\: H_{2}O}\times \frac{1\cancel{mol\: H_{2}O}}{18.0\cancel{g}}\times \frac{6.01kJ}{\cancel{mol}}=15.3\,kJ \nonumber \nonumber \]
Sin señal, se supone que el número es positivo.
Ejercicio\(\PageIndex{1}\)
¿Cuál es el cambio de energía cuando se\(\ce{C6H6}\) congelan 108 g a 5.5°C?
- Contestar
-
−13.8 kJ
Durante la fusión, la energía va exclusivamente a cambiar la fase de una sustancia; no va a cambiar la temperatura de una sustancia. De ahí que la fusión sea un proceso isotérmico porque una sustancia permanece a la misma temperatura. Sólo cuando toda una sustancia se funde, la energía adicional va a cambiar su temperatura.
¿Qué sucede cuando un sólido se convierte en líquido? En un sólido, las partículas individuales se pegan en su lugar porque las fuerzas intermoleculares no pueden ser superadas por la energía de las partículas. Cuando se suministra más energía (por ejemplo, elevando la temperatura), llega un punto en el que las partículas tienen suficiente energía para moverse, pero no suficiente energía para separarse. Esta es la fase líquida: las partículas aún están en contacto, pero son capaces de moverse unas alrededor de otras. Esto explica por qué los líquidos pueden asumir la forma de sus contenedores: las partículas se mueven y, bajo la influencia de la gravedad, llenan el menor volumen posible (a menos que el líquido esté en un ambiente de gravedad cero, ver Figura\(\PageIndex{1}\).

El cambio de fase entre un líquido y un gas tiene algunas similitudes con el cambio de fase entre un sólido y un líquido. A cierta temperatura, las partículas en un líquido tienen suficiente energía para convertirse en gas. El proceso de que un líquido se convierta en gas se denomina ebullición (o vaporización), mientras que el proceso de que un gas se convierta en líquido se llama condensación. Sin embargo, a diferencia del proceso de conversión sólido/líquido, el proceso de conversión líquido/gas se ve notablemente afectado por la presión circundante sobre el líquido porque los gases se ven fuertemente afectados por la presión. Esto significa que la temperatura a la que un líquido se convierte en gas, el punto de ebullición, puede cambiar con la presión circundante. Por lo tanto, definimos el punto de ebullición normal como la temperatura a la que un líquido cambia a gas cuando la presión circundante es exactamente de 1 atm, o 760 torr. A menos que se especifique lo contrario, se supone que un punto de ebullición es para 1 atm de presión.
Al igual que el cambio de fase sólido/líquido, el cambio de fase líquido/gas implica energía. La cantidad de energía requerida para convertir un líquido en un gas se denomina entalpía de vaporización (o calor de vaporización), representada como Δ H vap. Algunos valores δ H vap se listan en la Tabla\(\PageIndex{2}\); se supone que estos valores son para la temperatura normal del punto de ebullición de la sustancia, que también se da en la tabla. La unidad para Δ H vap también es de kilojulios por mol, por lo que necesitamos saber la cantidad de material para saber cuánta energía está involucrada. El ΔH vap también se tabula siempre como un número positivo. Se puede utilizar tanto para los procesos de ebullición como para los procesos de condensación siempre y cuando se tenga en cuenta que la ebullición siempre es endotérmica (por lo que Δ H será positiva), mientras que la condensación es siempre exotérmica (por lo que Δ H será negativa).
| Sustancia (punto de ebullición normal) | ΔH vap (kJ/mol) |
|---|---|
| Agua (100°C) | 40.68 |
| Bromo (59.5°C) | 15.4 |
| Benceno (80.1°C) | 30.8 |
| Etanol (78.3°C) | 38.6 |
| Mercurio (357°C) | 59.23 |
¿Cuál es el cambio de energía cuando 66.7 g de Br 2 (g) se condensan a un líquido a 59.5°C?
Solución
El ΔH vap de Br 2 es 15.4 kJ/mol. A pesar de que se trata de un proceso de condensación, todavía podemos usar el valor numérico de Δ H vap siempre y cuando nos demos cuenta de que debemos sacar energía, por lo que el valor Δ H será negativo. Para determinar la magnitud del cambio de energía, primero debemos convertir la cantidad de Br 2 a moles. Entonces podemos usar Δ H vap como factor de conversión.
\[66.7\cancel{g\: Br_{2}}\times \frac{1\cancel{mol\: Br_{2}}}{159.8\cancel{g}}\times \frac{15.4kJ}{\cancel{mol}}=6.43\,kJ \nonumber \nonumber \]
Debido a que el proceso es exotérmico, el valor real será negativo: Δ H = −6.43 kJ.
Ejercicio\(\PageIndex{2}\)
¿Cuál es el cambio de energía cuando 822 g de\(\ce{C2H5OH(ℓ)}\) ebullición en su punto de ebullición normal de 78.3°C?
- Contestar
-
689 kJ
Al igual que con la fusión, la energía en ebullición va exclusivamente a cambiar la fase de una sustancia; no va a cambiar la temperatura de una sustancia. Por lo que hervir también es un proceso isotérmico. Sólo cuando toda una sustancia ha hervido, cualquier energía adicional va a cambiar su temperatura.
¿Qué sucede cuando un líquido se convierte en gas? Ya hemos establecido que un líquido está compuesto por partículas en contacto entre sí. Cuando un líquido se convierte en gas, las partículas se separan entre sí, y cada partícula va su propio camino en el espacio. Es así como los gases tienden a llenar sus contenedores. En efecto, en la fase gaseosa la mayor parte del volumen es espacio vacío; solo alrededor de 1/1,000 del volumen es realmente absorbido por la materia (Figura\(\PageIndex{1}\)). Es esta propiedad de los gases la que explica por qué se pueden comprimir, hecho que se considera en el Capítulo 6.


En algunas circunstancias, la fase sólida puede pasar directamente a la fase gaseosa sin pasar por una fase líquida, y un gas puede convertirse directamente en sólido. El cambio de sólido a gas se llama sublimación, mientras que el proceso inverso se llama deposición. La sublimación es isotérmica, al igual que los otros cambios de fase. Hay un cambio de energía medible durante la sublimación—este cambio de energía se llama entalpía de sublimación, representada como Δ H sub. La relación entre el sub Δ H y los otros cambios de entalpía es la siguiente:
\[ΔH_{sub} = ΔH_{fus} + ΔH_{vap}\nonumber \]
Como tal, Δ H sub no siempre se tabula porque puede calcularse simplemente a partir de Δ H fus y Δ H vap.
Existen varios ejemplos comunes de sublimación. Un producto bien conocido, el hielo seco, es en realidad el CO 2 sólido. El hielo seco es seco porque se sublima, con el sólido evitando la fase líquida y yendo directo a la fase gaseosa. La sublimación se produce a una temperatura de −77°C, por lo que debe manejarse con precaución. Si alguna vez has notado que los cubitos de hielo en un congelador tienden a hacerse más pequeños con el tiempo, es porque el agua sólida se sublima muy lentamente. La “quemadura del congelador” no es en realidad una quemadura; ocurre cuando ciertos alimentos, como las carnes, pierden lentamente el contenido de agua sólida debido a la sublimación. La comida sigue siendo buena, pero parece poco apetecible. Reducir la temperatura de un congelador ralentizará la sublimación de agua sólida.
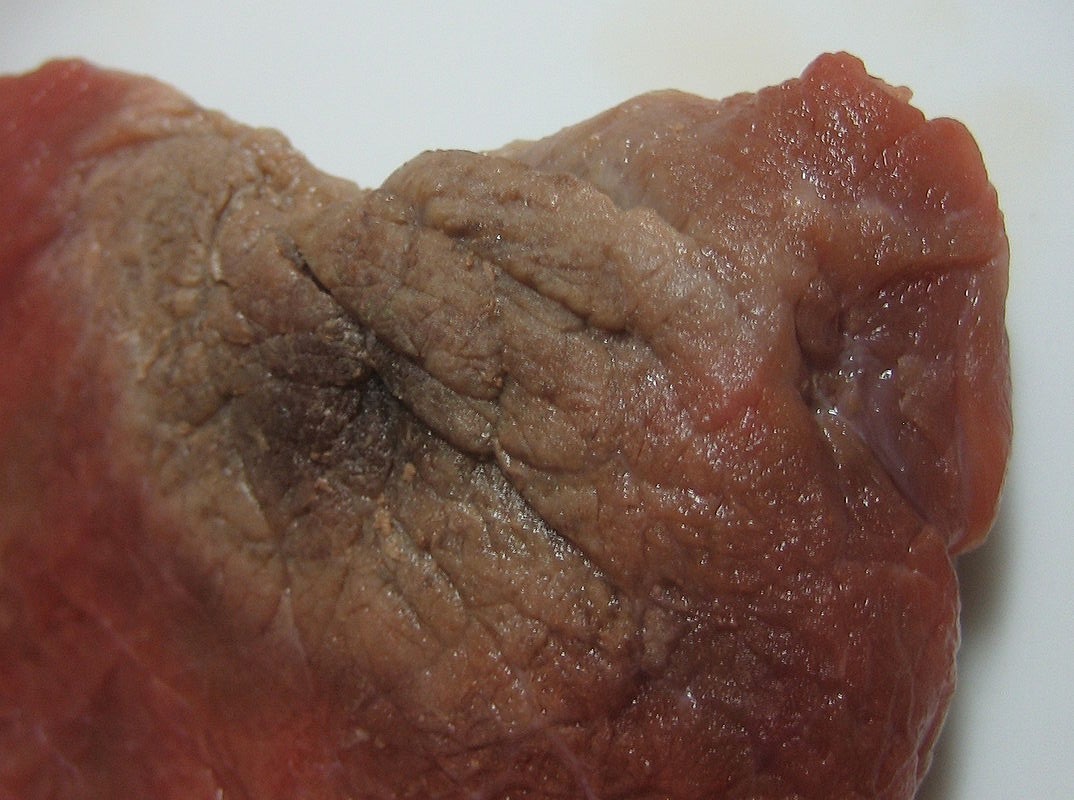
Las ecuaciones químicas pueden ser utilizadas para representar un cambio de fase. En tales casos, es crucial usar etiquetas de fase en las sustancias. Por ejemplo, la ecuación química para el derretimiento del hielo para hacer agua líquida es la siguiente:
\[H_2O(s) → H_2O(ℓ)\nonumber \]
No se está produciendo ningún cambio químico; sin embargo, se está produciendo un cambio físico.
Resumen
- Los cambios de fase pueden ocurrir entre dos fases cualesquiera de la materia.
- Todos los cambios de fase ocurren con un cambio simultáneo en la energía.
- Todos los cambios de fase son isotérmicos.


